耐低温西瓜种质筛选及低温对西瓜生理指标的影响
2021-06-30沈虹孟佳丽吴绍军余翔
沈虹,孟佳丽,吴绍军,余翔
(江苏省农业科学院宿迁农科所,江苏宿迁223800)
西瓜原产于热带地区,生长期适宜的温度为18~32℃,低于15℃则生长缓慢甚至停滞,西瓜栽培受季节约束较大。西瓜反季节栽培不仅满足了人们对不同季节西瓜消费的需求,而且满足了种植户追求较高经济效益的需求,深受消费者和种植户的青睐。然而,由于种植技术和设施条件等因素的限制,西瓜生产中常遭遇冬春季长期低温胁迫以及倒春寒的影响,低温冷害时常发生,造成西瓜产量降低、品质下降。筛选和培育耐低温西瓜品种是解决低温冷害的有效途径之一。西瓜遗传背景狭窄,耐低温种质资源缺乏,若要培育耐低温品种,必须加强耐冷种质资源的筛选和鉴定。为了有效鉴定西瓜种质资源和品种的耐低温性,目前国内外学者在低温对西瓜种子萌发、幼苗生长量、冷害指数、生理生化机制影响等[1-4]方面进行了一系列研究,并形成耐低温性评价体系。多项研究表明,植物不同品种间耐低温能力和响应机制均存在差异[5-7]。本研究以宿迁地区西瓜生产中的主栽品种中果型早佳8424和小果型小兰为对照,通过对江苏省农业科学院宿迁农科所西瓜课题组拥有的30份西瓜品种(系)、组合和高代自交系进行耐低温性筛选,并对比早佳8424和迁丽4号的生理响应,旨在为选育耐低温西瓜品种提供种质材料,为耐低温西瓜新品种的应用和推广提供基础。
1 材料和方法
1.1 试验材料
30份西瓜供试材料为江苏省农业科学院宿迁农科所设施园艺研究室西瓜课题组搜集、保存、培育的品种、组合和高代自交系,材料名称与来源见表1。
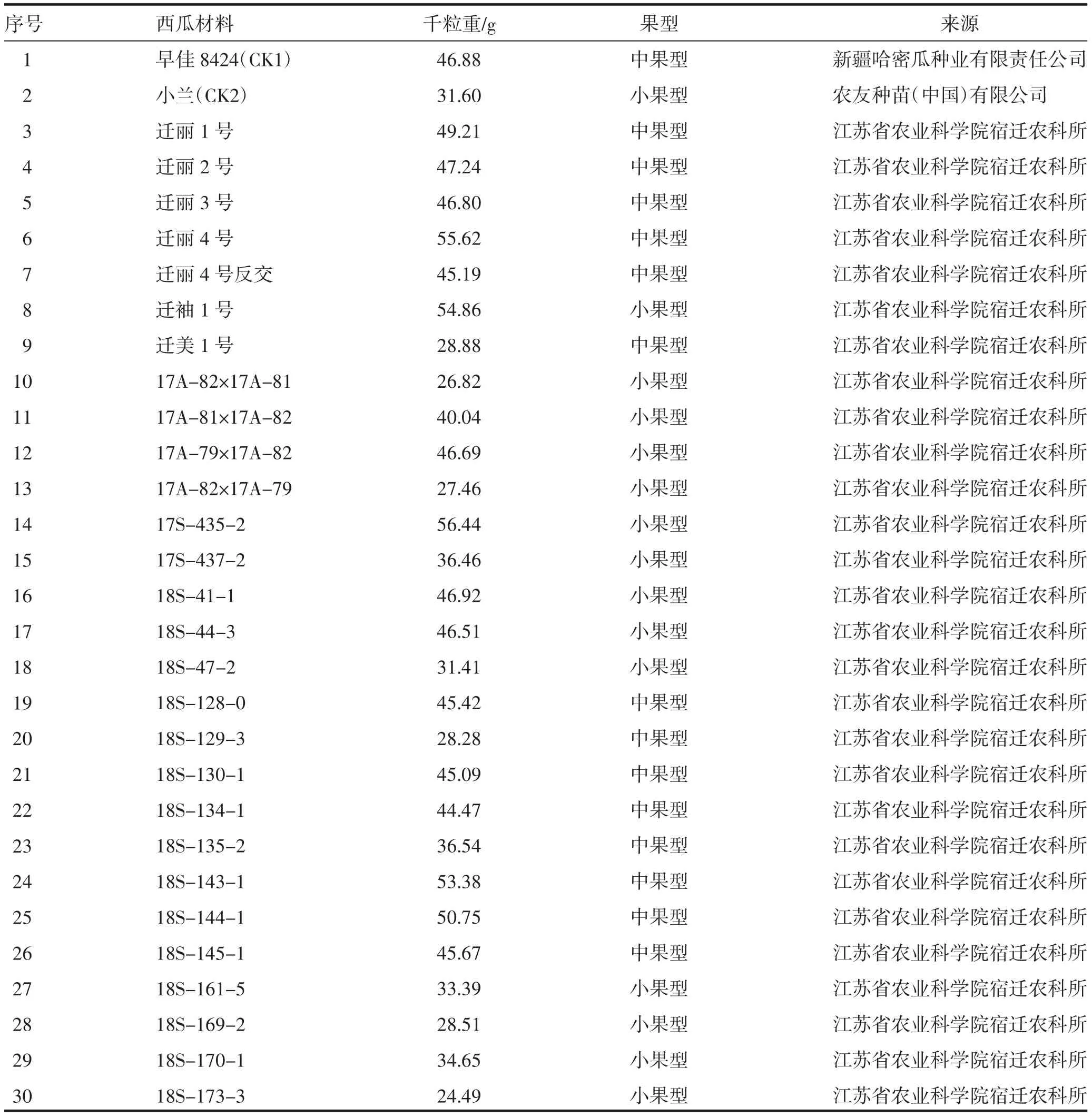
表1 材料名称与来源
1.2 试验方法
1.2.1 试验设计将30份供试材料(中果型早佳8424,小果型小兰为对照)用55℃温水边浸种边搅拌15 min,自然冷却后浸种4 h,置于28℃培养箱内催芽30 h,播种于50孔穴盘内。穴盘置于育苗棚内,白天温度控制在26~28℃,晚上控制在18~20℃。西瓜幼苗生长至三叶一心时,置于培养箱内进行低温(7.5℃,光照度12 000 lx)处理。每份材料随机选择15株,每个处理设置3次重复,处理10 d后统计低温胁迫下西瓜幼苗冷害症状。随后置于培养箱恢复生长(28/22℃,光照度12 000 lx,12 h/12 h)7 d,统计西瓜恢复生长情况,恢复症状分级标准见表2。
选择当地西瓜生产中主栽品种早佳8424以及宿迁农科所新培育、耐低温能力显著强于早佳8424的迁丽4号为试验材料,分析长时间低温胁迫、短时间较低低温胁迫以及常温恢复生长对幼苗生理指标的影响。长时间低温胁迫设置:将早佳8424和迁丽4号三叶一心期幼苗置于培养箱内8℃低温处理15 d后,取植株叶片,测量生理指标。短时间较低低温胁迫设置:取早佳8424和迁丽4号三叶一心期幼苗,置于培养箱内4℃低温处理2 d后,取植株叶片,测量生理指标。常温恢复生长设置:将4℃低温处理2 d后西瓜幼苗置于培养箱内恢复生长(28/22℃,光照度12 000 lx,12 h/12 h)5 d,取植物叶片,测量生理指标。对照设置:取育苗棚内正常生长(白天26~28℃,夜间18~20℃)的早佳8424和迁丽4号三叶一心期幼苗叶片,测量生理指标。
1.2.2 测定项目和方法冷害指数测定:参照许勇等[8]的冷害分级方法统计各材料的冷害情况并计算冷害指数。公式为

恢复指数测定:根据表2分级标准,统计各材料的恢复生长情况并计算恢复指数。公式为

表2 恢复症状分级标准

抗氧化酶活性、丙二醛和活性氧含量测定:称取0.1 g叶片(第2片叶子),加入1 mL提取液,进行冰浴匀浆,8 000×g 4℃离心10 min,取上清液,置冰上待测。超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、丙二醛(MDA)测定方法按照南京瑞源生物技术有限公司提供的试剂盒说明书进行,抗坏血酸过氧化物酶(APX)、超氧阴离子(O2-)、过氧化氢(H2O2)测定按照北京索莱宝科技有限公司的试剂盒说明书进行,并按照各自说明书上提供的公式进行计算。
渗透调节物质测定:可溶性总糖采用蒽酮法测定,可溶性蛋白含量采用考马斯亮蓝比色法测定,脯氨酸含量采用茚三酮比色法测定,均参考王学奎[9]编著的《植物生理生化试验原理和技术》。
1.3 数据分析
利用Excel 2010和SPSS 20统计学软件对试验数据进行统计和分析。
2 结果与分析
2.1 耐低温西瓜种质筛选
西瓜幼苗受到低温胁迫2 d后,叶片陆续出现轻微的皱缩、变形现象,随着胁迫时间延长,叶片出现上卷,叶缘发黑、萎蔫、发黄、枯死的症状。冷害指数和恢复指数是鉴定种质资源耐低温能力的重要指标,一般认为冷害指数越小、恢复指数越大植株耐低温能力越好。由表3可知,供试西瓜材料部分冷害指数差异显著(P<0.05),恢复指数差异不显著(P>0.05)。17A-82×17A-79组合冷害指数最小,为2.53,其次为迁丽3号(2.60)、17A-79×17A-82(2.60)、迁丽4号(2.67)、小兰(2.73)、18S-135-2(2.73)、18S-145-1(2.73)、18S-169-2(2.73)、18S-170-1(2.73)、迁丽2号(2.80)、17A-82×17A-81(2.87)、17A-81×17A-82(2.87)、17S-435-2(2.87)、18S-47-2(2.87)、18S-129-3(2.87)、18S-130-1(2.87)、17S-437-2(2.93)、18S-44-3(2.93)、迁丽1号(3.00)和18S-144-1(3.00),且均与17A-82×17A-79无显著差异(P>0.05)。早佳8424(3.13)冷害指数与17A-82×17A-79存在显著差异(P<0.05),但与17A-82×17A-81、17A-81×17A-82、17S-435-2、18S-47-2、18S-129-3、18S-130-1、17S-437-2、18S-44-3、迁丽1号、18S-144-1、迁丽4号反交、18S-134-1、18S-161-5、18S-143-1、18S-173-3、迁袖1号、18S-41-1和18S-128-0均无显著差异(P>0.05)。迁美1号冷害指数最高,为3.47,与18S-173-3、迁袖1号、18S-41-1、18S-128-0无显著差异(P>0.05)。由此可见,供试材料中有10个材料耐低温能力显著(P<0.05)强于早佳8424(CK1),有18个材料耐低温能力与早佳8424(CK1)无显著差异(P>0.05),有1个材料(迁美1号)耐低温能力显著(P<0.05)弱于早佳8424(CK1);供试材料中有4个材料耐低温能力强于小兰(CK2),但均与小兰(CK2)无显著差异(P>0.05);19个材料的耐低温能力与小兰(CK2)无显著差异(P>0.05)。14个中果型材料中有12个材料耐低温能力强于早佳8424,其中,5个材料显著强于早佳8424(P<0.05);14个小果型材料中有2个材料(17A-79×17A-82、17A-82×17A-79)的耐低温能力强于小兰(CK2),但与小兰(CK2)无显著差异(P>0.05)。

表3 低温胁迫下西瓜植株冷害指数及恢复指数
2.2 低温对西瓜幼苗生理指标的影响
2.2.1 低温对SOD活性的影响由图1可知,低温处理后,处理组的西瓜幼苗叶片中SOD活性均增加;长时间低温处理(8℃,处理15 d)比短时间较低低温处理(4℃,处理2 d)幼苗叶片中SOD增加更多;常温恢复生长后,SOD活性最高。迁丽4号品种的SOD活性在对照和处理组中均高于早佳8424品种;短时间较低低温处理(4℃,处理2 d)和常温恢复生长处理2个西瓜材料SOD活性差异显著(P<0.05)。

图1 低温对西瓜幼苗SOD活性的影响
2.2.2 低温对POD活性的影响由图2可知,低温处理后,处理组的西瓜幼苗叶片中POD活性均增加;长时间低温处理(8℃,处理15 d)比短时间较低低温处理(4℃,处理2 d)幼苗叶片中POD增加更多;常温恢复生长后,POD活性最高。迁丽4号的POD活性在对照和处理组中均高于早佳8424;常温恢复生长处理2个西瓜材料POD活性差异不显著(P>0.05)。
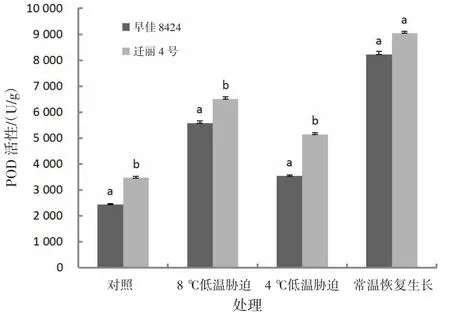
图2 低温对西瓜幼苗POD活性的影响
2.2.3 低温对CAT活性的影响由图3可知,早佳8424处理组的CAT活性均比对照低;常温恢复生长后幼苗的CAT活性最低,比对照降低80%。迁丽4号长时间低温处理(8℃,处理15 d)的CAT活性比对照高22.16%;短时间较低低温处理(4℃,处理2 d)和常温恢复生长后幼苗CAT活性分别比对照低21.63%和45.99%。迁丽4号的CAT活性在对照和处理组中均高于早佳8424;长时间低温处理(8℃,处理15 d)和常温恢复生长处理2个西瓜材料的CAT活性差异显著(P<0.05)。
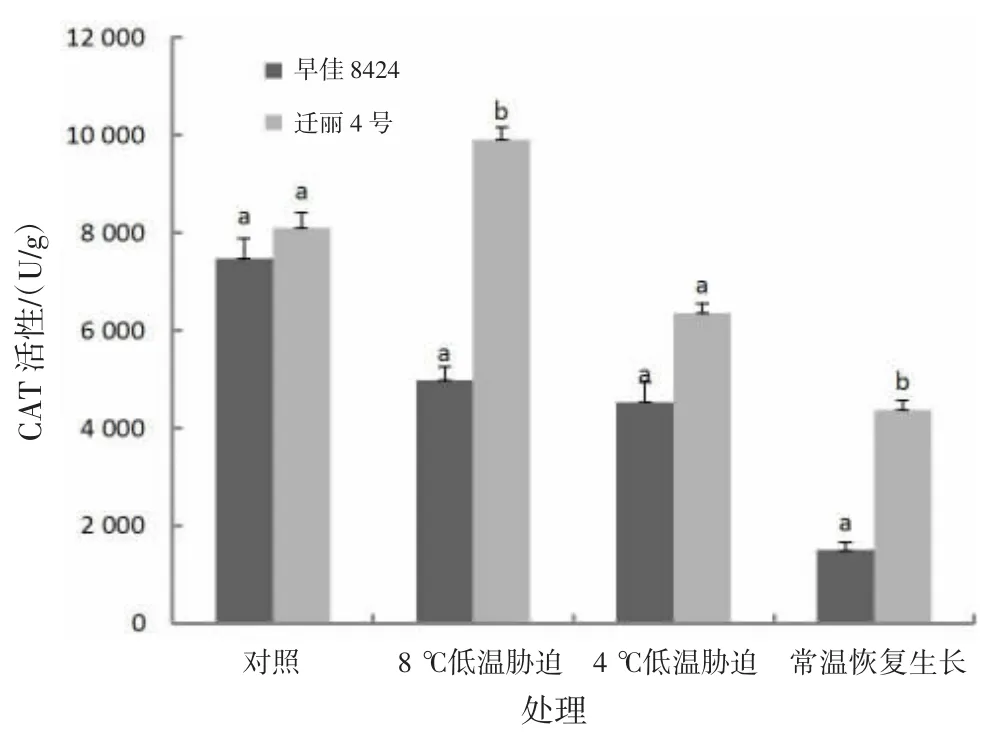
图3 低温对西瓜幼苗CAT活性的影响
2.2.4 低温对MDA含量的影响由图4可知,短时间较低低温处理(4℃,处理2 d)的西瓜幼苗MDA含量比对照高,早佳8424和迁丽4号分别比对照高48.55%和18.47%;长时间低温处理(8℃,处理15 d)和常温恢复生长幼苗的MDA含量均低于对照。迁丽4号的MDA活性在对照和处理组中均低于早佳8424;短时间较低低温处理(4℃,处理2 d)和常温恢复生长处理2个西瓜材料MDA含量差异显著(P<0.05)。
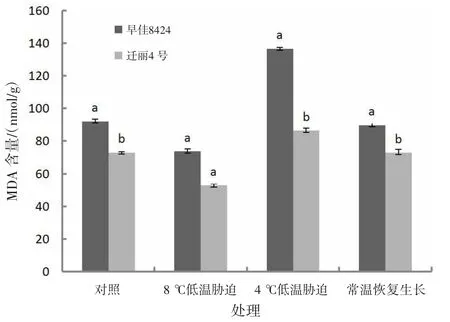
图4 低温对西瓜幼苗MDA含量的影响
2.2.5 低温对APX活性的影响由图5可知,对照组和长时间低温处理(8℃,处理15 d)的早佳8424和迁丽4号APX活性差异不显著(P>0.05);短时间较低低温处理(4℃,处理2 d)和常温恢复生长的幼苗APX活性均降低,与对照相比,早佳8424分别降低78.02%、81.91%,迁丽4号分别降低59.51%、43.37%。迁丽4号的APX活性在处理组中均高于早佳8424;短时间较低低温处理(4℃,处理2 d)和常温恢复生长处理2个西瓜材料APX活性差异显著(P<0.05)。

图5 低温对西瓜幼苗APX活性的影响
2.2.6 低温对超氧阴离子含量的影响由图6可知,长时间低温处理(8℃,处理15 d)后,早佳8424和迁丽4号超氧阴离子含量分别比对照高263.74%和51.00%;常温恢复生长后,早佳8424和迁丽4号超氧阴离子含量分别比对照高112.82%和115.73%;短时间较低低温处理(4℃,处理2 d)后,早佳8424和迁丽4号超氧阴离子含量分别比对照低6.62%和2.29%。迁丽4号的超氧阴离子在对照和处理组中均低于早佳8424;长时间低温处理(8℃,处理15 d)2个西瓜材料超氧阴离子差异显著(P<0.05)。
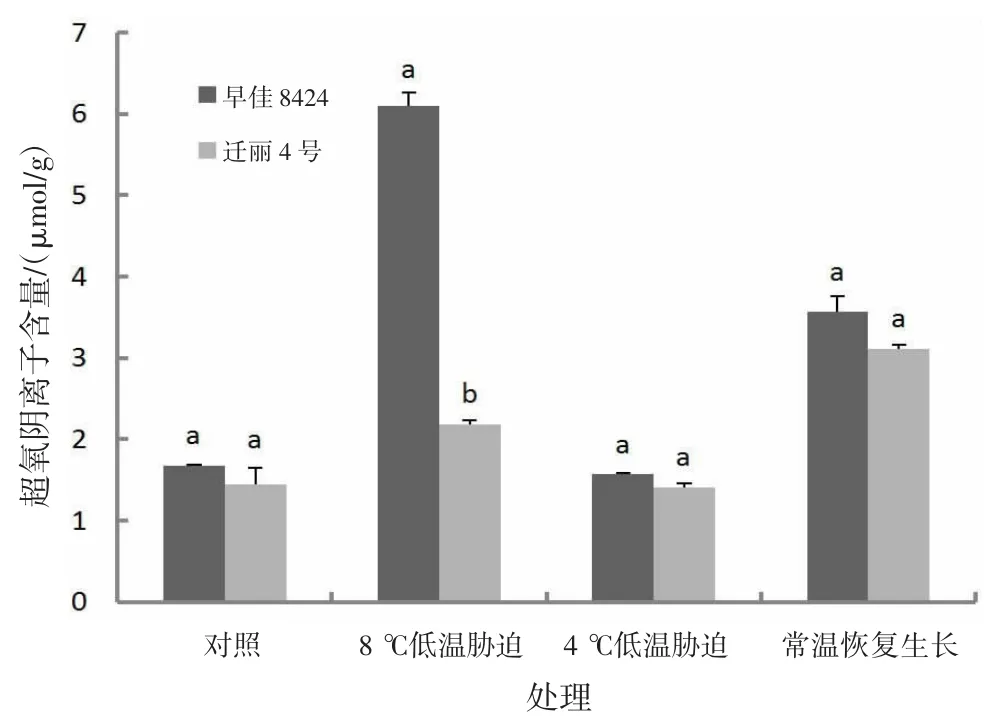
图6 低温对西瓜幼苗超氧阴离子含量的影响
2.2.7 低温对H2O2含量的影响由图7可知,低温处理后,处理组的西瓜幼苗叶片中H2O2含量均降低;长时间低温处理(8℃,处理15 d)后,早佳8424和迁丽4号幼苗叶片中H2O2含量分别比对照低40.41%和29.89%;短时间较低低温处理(4℃,处理2 d)后,早佳8424和迁丽4号幼苗叶片中H2O2含量分别比对照低29.31%和13.74%;常温恢复生长后,早佳8424和迁丽4号幼苗叶片中H2O2含量比对照低17.75%和33.05%。迁丽4号的H2O2含量在对照和处理组中均低于早佳8424;常温恢复生长处理2个西瓜材料H2O2含量差异显著(P<0.05)。
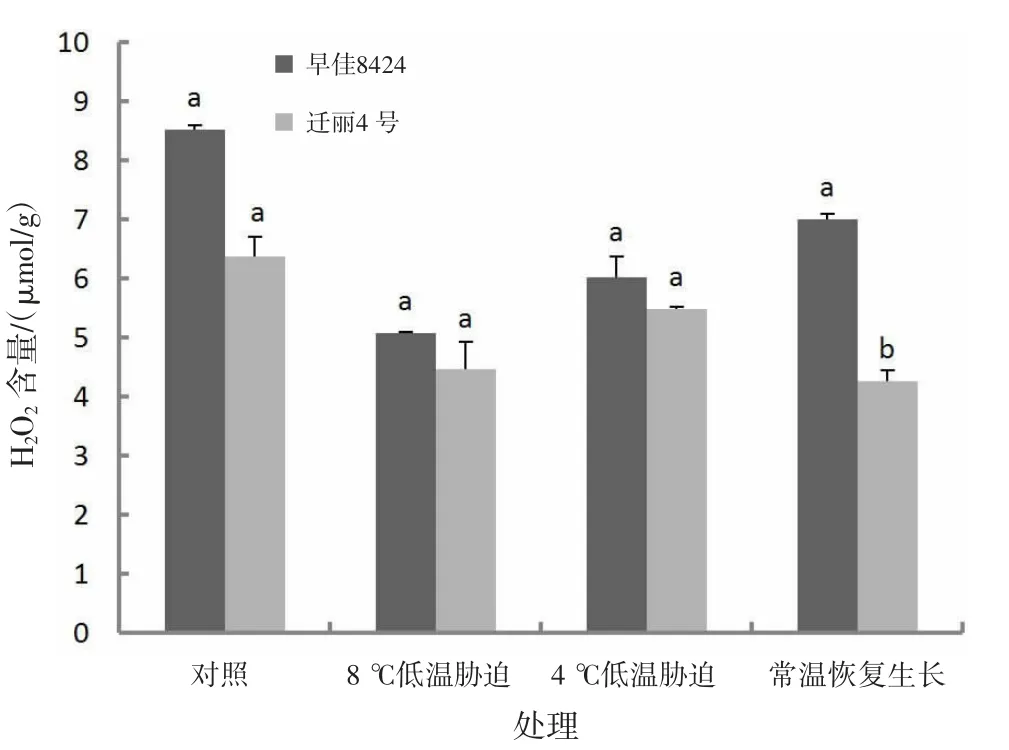
图7 低温对西瓜幼苗H2O2含量的影响
2.2.8 低温对可溶性糖含量的影响由图8可知,长时间低温处理(8℃,处理15 d)后,早佳8424和迁丽4号可溶性糖含量分别比对照高18.68%和73.58%;常温恢复生长后,早佳8424和迁丽4号可溶性糖含量分别比对照低12.38%和19.09%;短时间较低低温处理(4℃,处理2 d)后,早佳8424可溶性糖含量比对照低46.80%,迁丽4号可溶性糖含量比对照高6.57%;迁丽4号的可溶性糖含量在对照和处理组中均高于早佳8424;短时间较低低温处理(4℃,处理2 d)2个西瓜材料可溶性糖含量差异显著(P<0.05)。

图8 低温对西瓜幼苗可溶性糖含量的影响
2.2.9 低温对可溶性蛋白含量的影响由图9可知,低温处理后,处理组的西瓜幼苗叶片中可溶性蛋白含量均降低;长时间低温处理(8℃,处理15 d)后,早佳8424和迁丽4号可溶性蛋白含量分别比对照低26.94%和11.61%;短时间较低低温处理(4℃,处理2 d)后,早佳8424和迁丽4号可溶性蛋白含量分别比对照低68.35%和26.92%;常温恢复生长后,早佳8424和迁丽4号可溶性蛋白含量分别比对照低44.42%和29.09%;迁丽4号的可溶性蛋白含量在处理组中均高于早佳8424;短时间较低低温处理(4℃,处理2 d)2个西瓜材料可溶性蛋白含量差异显著(P<0.05)。
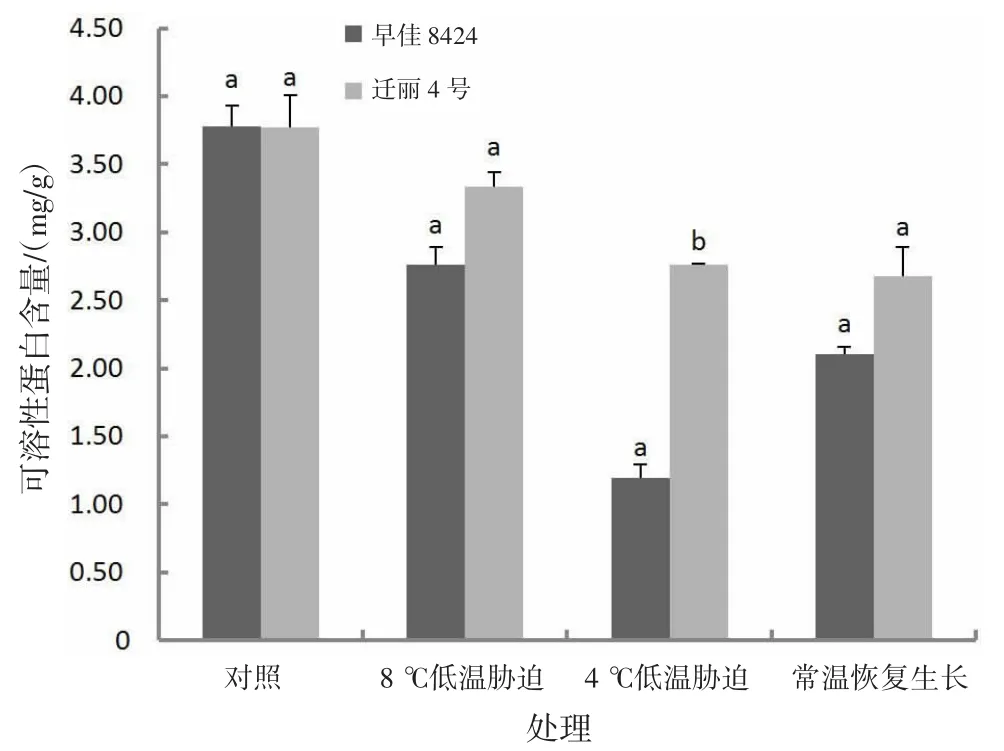
图9 低温对西瓜幼苗可溶性蛋白含量的影响
2.2.10 低温对Pro含量的影响由图10可知,低温处理后,处理组迁丽4号Pro含量均比对照高,长时间低温处理(8℃,处理15 d)、短时间较低低温处理(4℃,处理2 d)和常温恢复生长西瓜幼苗叶片Pro含量分别比对照高148.57%、165.71%和225.71%;早佳8424长时间低温处理(8℃,处理15 d)和常温恢复生长西瓜幼苗叶片Pro含量分别比对照高141.18%和92.94%,短时间较低低温处理(4℃,处理2 d)西瓜幼苗叶片Pro含量比对照低58.82%;对照、长时间低温处理(8℃,处理15 d)和常温恢复生长,早佳8424 Pro含量高于迁丽4号;短时间较低低温处理(4℃,处理2 d),早佳8424 Pro含量低于迁丽4号;长时间低温处理(8℃,处理15 d)2个西瓜材料Pro含量差异显著(P<0.05)。
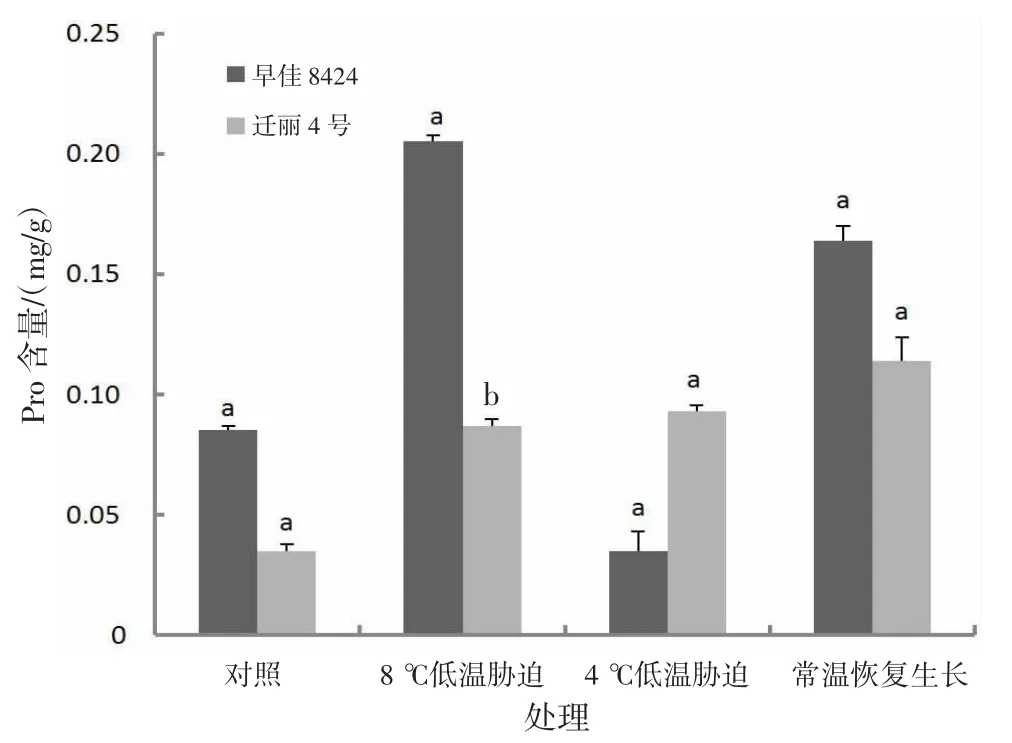
图10 低温对西瓜幼苗Pro含量的影响
3 结论与讨论
低温冷害是西瓜生产中常见的逆境因子之一。冷害症状和恢复症状分级可直观反映低温对植株的伤害程度和恢复能力。冷害指数与植株的耐低温性呈负相关,恢复指数与植株的耐低温性呈正相关[4]。本研究利用7.5℃低温胁迫进行耐低温材料筛选,30个材料恢复指数无显著差异(P>0.05);根据冷害指数,从中果型材料中筛选出5个材料(迁丽2号、迁丽3号、迁丽4号、18S-135-2和18S-145-1)耐低温能力显著强于早佳8424(P<0.05),8个材料(迁丽1号、迁丽4号反交、18S-129-3、18S-130-1、18S-134-1、18S-143-1、18S-144-1和18S-128-0)与早佳8424无显著差异(P>0.05)。从小果型材料中筛选出2个材料(17A-79×17A-82、17A-82×17A-79)的耐低温能力强于小兰,10个材料(17A-82×17A-81、17A-81×17A-82、17A-79×17A-82、17A-82×17A-79、17S-435-2、17S-437-2、18S-44-3、18S-47-2、18S-169-2和18S-170-1)与小兰无显著差异(P>0.05)。这些不同低温耐受性的西瓜种质材料,可为西瓜早春育种和遗传研究提供参考和原材料。
植物在受到低温等逆境胁迫时,生理代谢调节机制的动态平衡被打破,引起植物细胞膜保护系统及活性氧清除系统受损,从而导致细胞受到伤害[10]。抗氧化酶具有清除活性氧自由基的作用,是评判植物耐低温能力的重要指标之一。目前,低温胁迫对植物抗氧化酶活性的研究结论有差异,这与植物种类、品种耐性及低温处理时间、温度等不同有关。王萍等[11]研究发现,低温处理后4个西瓜砧木品种幼苗的SOD和POD活性均比处理前显著升高。李爱民等[12]研究发现,低温弱光胁迫下,西瓜叶片中SOD、CAT活性随着处理时间延长先增加后降低。杨燕[13]研究发现,随着低温胁迫时间延长,籽用西瓜幼苗SOD和CAT活性下降,POD和APX活性增加。
本研究发现,低温胁迫下,西瓜叶片的SOD和POD活性均升高;CAT活性因不同品种表现不同,早佳8424 CAT活性下降,迁丽4号不同处理有的升高有的下降;APX活性因低温处理不同表现不同。由此可见,低温胁迫下,植物体内通过抗氧化酶活性改变抵御低温伤害,短时间较低低温处理和长时间低温处理抗氧化酶活性变化不同,不同品种间抗氧化酶活性变化也不同,耐低温品种(迁丽4号)的酶活性更高。丙二醛(MDA)是膜脂过氧化的产物,MDA含量越高,受伤害程度越高。李严曼等[2]研究发现,低温对不同品种西瓜幼苗叶片MDA含量具有显著影响,不同品种增加幅度不同。段会军等[14]研究发现,低温胁迫下,西瓜幼苗MDA含量升高,与冷害指数呈极正相关。
本研究发现,短时间较低低温胁迫(4℃,处理2 d)MDA含量升高,长时间低温胁迫(8℃,处理15 d)和常温恢复生长后MDA含量降低,较耐低温的品种(迁丽4号)MDA含量更低。低温胁迫下,植物细胞内超氧阴离子、羟基自由基、过氧化氢和单线态氧等活性氧积累,引起细胞膜结构破坏,生物大分子损伤,导致植物受到伤害。韩娅楠等[15]研究发现,随着低温处理时间的延长,番茄叶片中超氧阴离子(O2-)和过氧化氢(H2O2)呈现上升趋势。本研究发现,短时间较低低温胁迫,超氧阴离子含量降低,长时间低温胁迫和恢复生长后,超氧阴离子含量升高,可能是短时间较低低温胁迫使SOD清除了体内活性氧的产生,造成活性氧含量的下降;长期低温胁迫和恢复生长后,活性氧积累超出活性氧清除能力,造成了活性氧含量的升高。
本研究中处理组和常温恢复生长后过氧化氢的含量与对照相比均降低,可能是POD催化过氧化氢参与还原氧化反应,清除了过氧化氢。可溶性蛋白、可溶性糖和脯氨酸(Pro)是植物体内重要的渗透调节物质,在逆境条件下大量积累以维持细胞的膨压,从而减轻低温等逆境伤害。张爱华等[16]研究认为,耐低温品种的可溶性蛋白含量积累量更高。本研究也发现,低温胁迫下,可溶性蛋白含量降低,较耐低温品种可溶性蛋白含量更高。彭金光等[1]研究发现,低温相对敏感的品种在15℃低温处理的初期就积累了大量的可溶性糖和脯氨酸,耐低温较强的品种在10℃低温处理较长时间后体内才积累大量可溶性糖和脯氨酸,且变化幅度小于低温敏感品种。本研究也发现,不同低温处理下,可溶性糖含量变化也不同,长时间低温胁迫(8℃,处理15 d)2个品种可溶性糖含量升高,短时间较低低温胁迫(4℃,处理2 d)下,较耐低温品种含量稍微增加,较不耐低温品种含量降低,常温恢复生长后2个品种的可溶性糖含量均降低,但较耐低温品种可溶性糖含量均高于较不耐低温品种。
本研究中,脯氨酸含量也因不同处理和不同品种表现不同,迁丽4号处理组和常温恢复生长后,脯氨酸含量均比对照升高,但早佳8424短时间较低低温胁迫下,脯氨酸含量下降,长时间低温胁迫和常温恢复生长后,脯氨酸含量均增加。综上可知,低温胁迫下,西瓜幼苗叶片中抗氧化酶活性、渗透调节物质、活性氧均发生了改变,但不同低温处理和不同品种表现不同,因此,不同的低温胁迫下,不同品种受到的低温伤害不同,可筛选出耐低温西瓜种质材料,为西瓜耐低温品种选育提供了理论参考。
