多种纳米结构Fe掺杂TiO2光热耦合水分解制氢研究
2021-06-29吴启亮梅晋豪范海东张彦威
吴启亮,梅晋豪,李 铮,范海东,张彦威
(1.浙江大学能源清洁利用国家重点实验室,杭州 310027;2.浙江省能源集团有限公司,浙江省太阳能利用及节能技术重点实验室,杭州 310000)
传统能源的应用是现代社会发展的基石,随之而来的能源问题使得太阳能制取氢能和碳氢燃料受到越来越多的关注[1].多年来,以TiO2为代表的半导体功能材料,因其能够有效地响应太阳光被广泛研究[2].基于各种修饰策略,高效的太阳能燃料制取技术得以实现,对绿色能源工程起到关键作用[3].
一直以来,缺陷工程被认为是高效的材料改性手段[4],其中,金属半导体氧化物的氧缺陷能够有效地扩展光谱吸收范围、提高电荷分离能力和提供表面活性位点[5],因此受到光、电催化领域的广泛关注.同时,金属氧化物的氧缺陷在热化学反应中是重要的还原剂,在高温下实现二氧化碳和水的解离[6].对比热化学循环中的高温氧空位(>1000 ℃)制取方法,催化材料的氧空位可通过高能光照获得[7],可在常温下形成缺陷.最近研究表明,富氧空位催化剂在常温光催化水分解中被观察到具有“氧修补”能力,表明光学导致的氧空位同样具备分解水的强还原性[8].基于光学氧空位的形成和使用而建立的光热耦合水分解制氢反应[9]由两步构成,分别为自然光照下光致氧空位的形成和高温环境中光致氧空位对水的分解.上述过程可表示为

式中:M 代表被还原的金属离子;OL代表晶格氧(Lattice oxygen);hv为光子能量;VO代表氧空位(Oxygen vacancy).光热耦合反应在不同阶段分别利用光能和热能,能有效地匹配太阳能低波段和高波段的能量形式,是高效的太阳能利用手段.近年来,基于光致氧空位的热利用研究受到不同领域的关注和扩展延伸[10],被用来进行如二氧化碳的还原[11]以及甲烷化[12]等不同的反应.
在光热耦合反应中,纳米颗粒因具有粒径分散均匀,易于进一步金属修饰的特点一直是最主要的研究目标.现有研究表明,具有不同纳米形貌的TiO2材料在催化反应中表现出独特的性质[13,14].其中,TiO2纳米片因其能够有效暴露出高活性的(001)晶面,被广泛用于光催化实验[13],而TiO2纳米线作为典型的一维材料,因其吸附能力强且具备较强的电荷分离能力也受到广泛关注[14].此外,区别于形貌优化的策略,金属掺杂修饰是材料优化改性中的重要组成部分,通过设置杂质能级能有效提高材料光响应能力,降低光生电子空穴复合率[15].
本文制备了TiO2纳米颗粒、纳米片和纳米线及其Fe 掺杂改性的半导体材料,用于光热耦合纯水分解制氢实验.通过高分辨透射电子显微镜(HRTEM)、X射线衍射(XRD)以及电子顺磁共振(EPR)对各种材料的形貌特征进行了比对,并对Fe掺杂前后的性能提升进行分析,为光热耦合制氢材料设计指引了方向.
1 实验部分
1.1 试剂与仪器
钛酸四丁酯、四氯化钛(TiCl4)、异丙醇、乙二醇、无水乙醇、氢氧化钠、氢氟酸(HF)、冰乙酸、盐酸和九水合硝酸铁[Fe(NO3)3·9H2O]均为分析纯,购于上海阿拉丁生化科技股份有限公司.
HT-7700 型透射电子显微镜(TEM,日本日立公司,工作电压120 kV);D/max2550/PC 型X 射线衍射仪(XRD,日本理学公司,工作电压40 kV,工作电流100 mA);A300 型电子顺磁共振波谱仪(EPR,德国布鲁克公司);UV-3600型此外-可见分光光度计(UV-Vis,日本岛津公司);FLS920型稳态瞬态荧光光谱仪(PC,英国爱丁堡公司);7820A型气相色谱仪(美国安捷伦科技有限公司);lvium-N-Stat型多通道电化学工作站(荷兰lvium 公司);PLS-SXE300 型氙灯光源(北京泊菲莱科技有限公司);Gastight#1001型进样针(瑞士汉密尔顿公司).
1.2 样品的制备
二氧化钛纳米颗粒(TiO2nanoparticles,TP):参照文献[16]方法制备.将20 mL 钛酸四丁酯和60 mL 无水乙醇混合均匀,记为溶液A;将8 mL 冰乙酸、10 mL 去离子水和60 mL 无水乙醇混合均匀,记为溶液B;在持续搅拌下,将溶液B 缓慢加入到溶液A 并在室温下陈化24~36 h,直至得到透明凝胶.所得样品在100 ℃下完全干燥,然后置于400 ℃马弗炉中煅烧3 h成晶,室温下冷却获得TP样品.Fe 掺杂的二氧化钛纳米颗粒(FTP)的制备过程与TP 相似,在配置溶液B 时,加入适量的Fe(NO3)3·9H2O搅拌至完全溶解,FTP设定掺杂量为m(Fe)/m(TiO2)=0.5%.
二氧化钛纳米片(TiO2nanosheets,TS):参照文献[17]方法制备.将0.35 mL 40%(质量分数)氢氟酸、2 mL钛酸四丁酯与30 mL无水乙醇充分混合搅拌直至形成胶状后,移至50 mL内衬为聚四氟乙烯的反应釜中在180 ℃下持续36 h.待材料冷却至室温后,通过高速离心机,用去离子水与无水乙醇反复洗涤数次.所得材料溶解在0.1 mol/L氢氧化钠溶液中,持续搅拌8 h后,再用高速离心机反复洗涤数次.最后在80 ℃烘箱中完全干燥后收集TS 样品.Fe 掺杂的二氧化钛纳米片(FTS)制备过程与TS 类似,通过在30 mL 无水乙醇中预先溶解适量的Fe(No3)3·9H2O,获得设定掺杂量为m(Fe)/m(TiO2)=0.5%的FTS样品.
二氧化钛纳米线(TiO2nanowires,TW):参照文献[18]方法制备.取10 mL钛酸丁酯、20 mL异丙醇和40 mL 10 mol/L氢氧化钠溶液充分搅拌混合后移至100 mL反应釜中,于180 ℃下水热反应24 h.冷却至室温后,样品用0.1 mol/L盐酸溶液调至pH≈7,再利用去离子水过滤洗涤,pH调节与洗涤过程循环重复3次后获得干净的样品.洗涤后的样品在80 ℃的烘箱中完全干燥得到TW材料.Fe掺杂的二氧化钛纳米线(FTW)在TW基础上采用湿浸渍法制备.将0.2 g TW样品溶于25 mL无水乙醇并加入适量的Fe(NO3)3·9H2O,室温下放置48 h.所得样品经过滤后用质量分数36%的盐酸酸洗,再利用去离子水多次过滤洗涤.置于100 ℃烘箱中完全干燥后,于500 ℃马弗炉中煅烧1.5 h.冷却后的FTP设定掺杂量为m(Fe)/m(TiO2)=0.5%.
1.3 样品的纯水分解性能评价
样品薄膜的制备:取50 mg样品完全溶解于5 mL去离子水中,超声振荡30 min后移至直径5 cm的石英皿中,在80 ℃烘箱中完全干燥.所得薄膜样品置于400 ℃的管式炉中,在流动的氧气气氛下充分预处理12 h以移除表面吸附物,最后冷却至室温.
光热耦合纯水分解实验:将薄膜样品置于体积为200 mL 的石英反应器中,持续通入100 mL/min的氩气,使腔体内保持惰性气氛.用氙灯光源透过石英盖照射样品,样品光反应过程持续1 h.样品热反应过程中,通过电加热器将反应器加热至350 ℃后关闭前后气阀形成常压密闭腔体,再通过注射口注入约0.03 mL去离子水形成微压水蒸汽环境(腔体表压约为35 kPa),热反应过程持续1 h.最后,反应后的气体通过进样器收集,利用气相色谱检测腔体内各组分及其含量.
2 结果与讨论
2.1 材料的形貌表征

Fig.1 HRTEM image(A),EDXS mapping image(B) and the lattice spacing measurement(C)of FTP

Fig.2 HRTEM image(A),EDXS mapping image(B) and the lattice spacing measurement(C)of FTS

Fig.3 HRTEM image(A),EDXS mapping image(B) and the lattice spacing measurement(C)of FTW
图1~图3分别为各形貌Fe掺杂TiO2的HRTEM 照片及能量色散X射线能谱EDXS 图.通过不同方法制备的FTP,FTS和FTW材料成型良好[图1(A),图2(A)和图3(A)],FTP呈现半径10~20 nm左右的球状颗粒,FTS为边长约40~50 nm,厚度约8 nm的正方形薄片,FTW则为宽150 nm的纳米线.各材料的EDXS 图[图1(B)、图2(B)和图3(B)]表明,Fe,Ti及O元素分布均匀,且元素面扫描结果显示出Fe元素在所示区域的质量分数.其中,FTP的Fe元素掺杂质量分数接近预设值(0.5%),而FTS 和FTW中Fe 的实际掺杂量分别为0.10%和0.24%,均低于预设值.在高倍率图像[图1(C),图2(C)和图3(C)]中,测得FTP,FTS 和FTW 的平均晶格间距分别为0.351,0.358和0.350 nm,表明所制备的材料均展现出良好的锐钛矿(101)晶面特征.此外,图中未显示出可见的负载型颗粒,表明Fe主要以掺杂的形式对材料进行修饰.
图4(A)给出了不同纳米形貌TiO2及其Fe掺杂样品的XRD谱图.可见,制备的样品表现出明显的晶体特征,各衍射峰分别对应锐钛矿的(101),(004),(200),(105),(211),(204),(116),(220)和(215)晶面[19],其中,(101)晶面为晶体主峰,与TEM照片吻合.相比于TP和TW样品,TS的晶面衍射强度更高,这是由于HF被认为是有效的形貌控制手段,通过第一性原理计算,F元素的引入有效降低了(101)晶面的形成能[13].对比Fe掺杂前后的各形貌样品,主峰(101)位置发生约0.04°~0.06°的偏移,表明Fe离子成功掺杂进锐钛矿晶格中[见图4(B1)~(B3)].同时,TP样品在掺杂Fe元素后(101)晶面峰强度明显升高,主要归因于Fe离子掺杂所带来的电荷补偿大大降低了纳米颗粒形成过程中的缺陷,提高了成晶强度,而TS和TW样品本身晶体较为完整,因此Fe掺杂前后强度保持稳定.

Fig.4 XRD patterns of un-doped and Fe-doped TiO2 samples(A) and the main peak XRD patterns(23.0°—28.0°)of bare TiO2 and Fe-doped TiO2 samples of(B1)—(B3)
图5 给出了不同形貌TiO2及其Fe 掺杂样品的EPR 谱图.可见,原始的TP,TS 和TW 样品在g=2.003处表现出明显的EPR信号,该处常被认为是Ti3+以及氧空位VO的特征值[20],且信号强度顺序为TP>TW>TS,表明TP 样品体相中含有较多缺陷位,而TS 样品较为完整,这与XRD 谱图相符.对Fe 掺杂样品的高g值位置表征,发现FTP,FTS 和FTW样品在g=4.230处出现信号,被证实为锐钛矿晶格中存在的八面体对称协调的孤立Fe 原子[21],表明Fe 原子顺利掺杂替位Ti 原子,且Fe 掺杂TiO2样品中的Fe信号强度关系与EDXS结果相对应.结合VO与Fe 信号图像,能够发现缺陷的存在促进了Fe 的有效掺杂,现有研究表明,缺陷位点附近金属原子的替位能最低,因此Fe 更易在缺陷临近的位置上掺杂,实现锚定和促进作用[22].
2.2 材料的水分解产氢性能

Fig.5 EPR signals of TP,TS and TW samples

Fig.6 Hydrogen production by bare and Fe-doped samples in the water splitting experiment(A),energy profiles and optimized configurations of the thermochemical reaction process on TiO2(black line)and Fe-doped TiO2(red line)samples(B)
对TP,TS,TW进行5次光热耦合反应实验,所得平均氢气产量如图6(A)所示.TP,TS和TW材料的反应产氢量分别为0.75,2.02和1.46 μmol/g.光热耦合反应包含产生表面氧空位的光反应,以及强还原性氧空位分解水的热反应过程,后者的反应能力很依赖于光反应的效果.TP样品中含有较多的体相氧空位缺陷,导致了较高的光生电子-空穴对复合,致使光反应中的光生VO生成受到抑制,因此热反应水分解产氢能力较低.研究表明,制备富氧空位材料能显著提高TiO2光催化纯水分解效率[23],而光热耦合纯水分解是两步式反应,过多的体相缺陷妨碍了TiO2的光还原产生VO过程,这也是光热耦合反应与传统光催化的关键区别.
过渡金属掺杂是有效的TiO2改性策略,通过在禁带中提供杂质能级,增强光吸收能力.构建锐钛矿(101)面Ti24O48Fe 模型,基于第一性原理,采用原子尺度材料模拟的计算机程序包ViennaAb-initioSimulation package(VASP)对光热耦合反应路径能量变化进行计算,计算结果如图6(B)所示.Fe 掺杂的TiO2材料的光生氧空位形成能为1.84 eV,远低于原始TiO2的氧空位形成能(4.05 eV),表明Fe掺杂能够有效降低空位形成难度,增强光反应的氧空位产出,为热反应提供更多的“燃料”.整个过程中,对于上述材料,最大能量台阶均处于氧空位形成阶段,表明氧空位是决定光热耦合纯水分解产氢的关键因素.
对FTP,FTS和FTW材料也进行5组光热耦合制氢实验,平均氢气产量见图6(A).可见,FTP的氢气产量最高,约为9.73 μmol/g,FTW 的产量次之,为5.94 μmol/g,而FTS 的产氢量最低,仅有3.99 μmol/g.对照表征获得实际掺杂率FTP>FTW>FTS,进一步佐证了Fe 离子掺杂对光热耦合水分解产氢的促进作用.
2.3 材料的氧空位形成能力表征
图7(A)给出了所制得材料的UV-Vis DRS谱图.样品的颜色特征能够直接反映出可见光的吸收范围.与TP 相比,TS 和TW 紫外吸收能力较强,截止波长约为350 nm,因此宏观上表现为乳白色粉末;而TP由于富含体相的缺陷,吸收波长扩展至400 nm处,因而呈现淡灰色.通过Fe元素掺杂引入杂质能级,各材料的吸光能力获得增强.FTS样品相比于TS变化不明显,截止波长放宽至380 nm,呈现淡黄色.与TW相比,FTW在400~600 nm区间内的吸收强度增强,样品表现为淡红色粉末.而TP的变化最为明显,由于TP 的缺陷锚定作用,Fe 元素的掺杂率较高,材料改性显著,强吸光范围扩展至约500 nm,FTP整体呈现为深黄色.

Fig.7 UV-Vis DRS spectra of TiO2 and Fe-doped TiO2(A) and the transient photocurrent of TiO2 and Fe-doped TiO2 samples(B)
基于材料的光响应能力,对目标材料进行瞬态光电流测试,结果如图7(B)所示.单组内电流强度逐渐升高,这是由于材料内Ti3+的存在形成了吸引光生载流子的“深表面域”,而随着深表面域的逐渐饱和,单组内电流强度缓慢上升[24].对于原始TiO2,由于各材料差异较小且光生载流子复合率较高,因此TP,TS与TW的光电流大小相近.通过Fe掺杂改性,各种形貌TiO2的光电流均得到显著增强,且由于TP中掺杂的Fe含量更高,FTP材料的吸光性能和抑制复合能力提升更大,因此具备最高的瞬态电流,其次为FTW,而FTS缺乏有效掺杂,所能产生的电流强度最低.
为了验证Fe离子掺杂对光生载流子复合的抑制作用,图8给出了制得材料的瞬态及稳态荧光光谱测试结果.瞬态PL能够反映出光生载流子寿命,利用325 nm激光激发半导体材料,并对545 nm处的荧光强度进行监测,利用指数衰减函数对信号进行拟合,能够获得各样品中载流子寿命参数,其长短顺序为FTW=FTS>FTP>TP=TW>TS[图8(A)~(C)].对于光照产生的光生电子-空穴对,在光照过程中用来实现光生氧空位的生成,而寿命的延长有助于顺利形成更多的氧空位.对比掺杂前后,Fe元素能够被认为有效地延长了载流子寿命,进而增强了材料光反应效果.图8(D)给出了目标材料的稳态荧光光强对比,能够直接反映出光生电子-空穴对的复合强度.对于未经掺杂的TiO2材料,荧光强度顺序为TP>TW>TS,这是由于体相内的缺陷容易形成光生电子空穴的复合中心,使得复合加剧,不利于光反应的进行.而金属元素Fe的掺杂引入被认为导致了肖特基势垒的产生,从而阻碍了电子-空穴对的复合,延长了光生电子-空穴对的寿命.基于不同的实际掺杂率,各样品间的改性效果也有差异,掺杂后的荧光强度顺序为FTW>FTS>FTP.
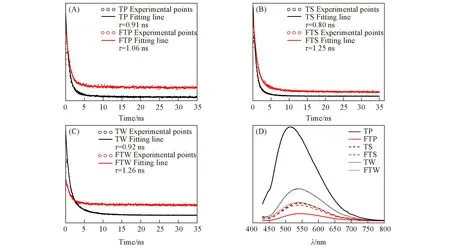
Fig.8 Time-resolved PL emission spectra of the TP/FTP(A),TS/FTS(B) and TW/FTW(C),PL emission spectra of theTiO2 and Fe-doped TiO2 samples(D)
结合图7与图8的性能表征结果,FTP具有较高的光生电流能力和较低的载流子复合率,因此有利于在光反应中实现光生氧空位的合成,而FTS被认为光反应效果最差.光反应的氧空位形成是光热耦合的关键步骤,也是决定热反应水分解制氢的重要前提,综合产氢性能[图6(A)]和光反应能力强弱,也证实了两者间的联系.
图9给出了电化学Mott-Schottky曲线和阻抗(EIS)的测试结果.Mott-Schottky曲线的切线斜率能够反映出载流子浓度大小.可见,载流子浓度ND与切线斜率d(1/C2)/dE成反比,即曲线越平缓载流子浓度越高[25].从图9(A)~(C)可见,在Fe掺杂后,不同形貌TiO2的Mott-Schottky曲线切线斜率均降低,计算获得的载流子浓度更高,这表明Fe原子的掺杂使得结构中活跃电子数增加,更利于光与热的化学反应.同时,图9(D)为制得材料的EIS图像.EIS曲线呈现半圆形,且更小的曲率半径表明了更小的电荷传输阻抗.可见,阻抗的数值大小顺序为TP=TS=TW>FTP>FTS=FTW.对于原始不同形貌TiO2无明显差异,经过Fe元素掺杂,阻抗显著下降,FTP的较大阻抗能够解释为体相内的各式缺陷,如Ti3+,Fe2+和VO,此类缺陷的存在提高了电子传输难度,增加了传输阻抗,同时也降低了电子寿命,与瞬态PL光谱结果相符.

Fig.9 Mott-Schottky curves of the TP/FTP(A),TS/FTS(B) and TW/FTW(C) and the electrochemical impedance spectra(EIS)of the TiO2 and Fe-doped TiO2 samples(D)
综上所述,Fe离子掺杂能够显著加强TiO2材料性能,更好地实现光热耦合纯水分解制氢反应.基于Fe掺杂对材料空位形成能力的促进,选用实际掺杂率最高的TP作为被修饰材料,通过制备质量分数分别为0.1%、0.5%和1.0%的Fe掺杂纳米颗粒材料(0.1 FTP,0.5 FTP和1.0 FTP),获得了各种Fe掺杂量对光热耦合水分解制氢的影响[见图10(A)].FTP的5组循环产氢实验效率基本稳定,0.1 FTP和1.0 FTP的平均产氢量分别为4.76和2.45 μmol/g,均低于0.5 FTP的产氢量(9.73 μmol/g).针对TP材料,Fe掺杂改性在稳态PL光谱强度上的优化最为显著,表明光反应光生电子复合率的降低是提高光致氧空位形成能力的关键.图10(B)为不同Fe掺杂量FTP材料的稳态PL光谱图.掺杂的Fe原子能够作为电子捕获陷阱,通过吸收电子,抑制了光生载流子的复合,促进了光生电子空穴的分离[26].0.1 FTP与0.5 FTP的荧光强度相近,表明微量的Fe掺杂已经能够实现复合强度的骤降.此外,过量的Fe掺杂易形成新的电子空穴复合中心[27],不利于光反应氧空位的形成,从而阻碍了光热耦合水分解制氢反应的进行.

Fig.10 Hydrogen production by 0.1 FTP,0.5 FTP and 1.0 FTP samples in the water splitting experiment(A)and PL emission spectra of 0.1 FTP,0.5 FTP and 1.0 FTP samples(B)
通过不同含量Fe 掺杂TP 样品的对比,发现Fe 元素掺杂量直接影响光热耦合制氢的效率.同时,光反应过程中光生载流子的分离可认为是光生氧空位形成的关键因素,也是进一步提高光热耦合制氢的重要研究对象.对于TP材料,0.1%的Fe掺杂使得产氢量提高至6.35倍,强于FTS和FTW的提升效果.可见,对于不同纳米结构的TiO2,Fe的掺杂改性既有相似性又有差异性.
3 结 论
光热耦合反应包含了光化学形成氧空位的过程,以及基于氧空位的强还原能力的热化学反应.本文制备了形貌各异的纳米颗粒TP,纳米片TS和纳米线TW.进一步制备了以不同形貌TiO2为基础的Fe掺杂改性材料FTP,FTS和FTW.溶胶-凝胶制备的TP样品中,缺陷较多,复合较强,实际产氢能力较低.另一方面,缺陷的锚定和促进作用使得FTP样品中Fe离子的实际负载率更高.通过实验和理论计算,光反应氧空位在完整的光热耦合过程中起到决定性作用.利用Fe离子掺杂实现了禁带中杂质能级的引入,提高TiO2材料光吸收能力,抑制光生电子-空穴对的复合,使得载流子寿命得以延长,载流子浓度得以增加,电子传输阻抗降低.基于以上改性,光反应过程中氧空位的形成得到促进.在相同Fe离子掺杂量条件下,富缺陷的TP材料能实现更高效地掺杂,FTP光热耦合制氢产量达到9.73 μmol/g,相比于TP性能提升达13倍.通过改变TP的Fe掺杂含量,合适的Fe掺杂量将是光热耦合产氢优化的关键.相近含量的Fe掺杂在不同纳米结构的TiO2优化中起到差异性的结果.对不同形貌的纳米TiO2进行对比,并对Fe掺杂前后的性能提升进行了分析,为掺杂量与纳米结构的正交优化设计奠定了基础,也为后续光热耦合制氢材料的设计指引了方向.
