农杆菌介导的玉米愈伤组织遗传转化研究
2021-06-29李海霞谢久凤孙金花
李海霞,谢久凤,孙金花
(河南农业大学,河南 郑州 450002)
玉米为重要的粮饲兼用作物,在国民经济中占有重要地位。利用分子生物学手段培育玉米新品种,对扩大玉米种植面积、提高玉米产量具有重要意义,因此,转基因玉米研究也越来越受到重视。通过转基因技术培育具有抗病、抗虫、抗逆、抗除草剂、高产、优质等优良性状的转基因玉米品种已经成为世界各国育种研究的主要任务[1]。1986年Fromm等[2]用电击法将抗除草剂基因pat转入玉米原生质体中,获得了转化细胞;1988年Rhodes等[3]用电击法获得了转基因玉米植株,为玉米转基因研究翻开了新篇章。从首例玉米转基因报道以来,人们不断优化玉米转基因体系,尽管转基因的方法多种多样,但多年实践表明,农杆菌介导的遗传转化以其独特的优点一直受到育种家和分子生物学家的重视。玉米幼胚是目前基因工程使用较多的外植体,已有报道将新鲜的幼胚(IE)或由幼胚[4,5]诱导形成的I型[6]和II型[7]愈伤组织作为玉米转基因的受体材料。
以玉米杂交种昌7-2×HiⅡA和郑22×87-1的幼胚诱导、继代筛选出的良好Ⅱ型胚性愈伤组织为材料,用农杆菌(LBA4404)介导法进行转化,利用携带的GUS报告基因的表达载体p3301对转化过程中抗菌素的抑制效果、农杆菌的侵染时间、共培养的处理方法等条件进行优化,旨为高效玉米转化体系建立提供依据。
1 材料与方法
1.1 试验材料
转化受体材料为郑22×87-1、昌7-2×HiⅡA的幼胚诱导后进行1次继代培养的胚性愈伤组织。
农杆菌菌株为LBA4404,携带双元质粒载体pCAMBIA3301,由河南农业大学小麦育种研究室提供,质粒Cre-Loxp和BJ40由河南农业大学作物遗传育种实验室保存。
1.2 试验方法
1.2.1 菌液制备 将-70℃保存下的农杆菌在含有50 mg/L Kan的LB培养基平板上画线培养2~3 d,从平板上挑取单菌落,接种于含50 mg/L Kan的600μL YEP液体培养基中,28℃下180 r/min振荡过夜。将菌液按1∶100的比例转接入40 mL YEP液体培养基中培养3~5 h,至OD600为0.3~0.5,然后4℃下5 000 r/min离心5 min,收集菌体。将菌体加入40 mL侵染液体培养基(YEP+100μmol/L As,pH值5.2)重新悬浮,至OD600约为0.3时备用。
1.2.2 受体材料准备 转化前3 d,挑选生长一致的优良愈伤组织继代培养的愈伤组织转接1次,进行转化前预培养。将预培养3 d的愈伤组织夹入三角瓶中,尽可能不带培养基,倒入已制备好的菌液,完全浸没愈伤组织。轻轻颠倒离心管15~20次,静止离心管5~10 min,侵染完成后弃去菌液,用滤纸吸干愈伤组织表面的多余菌液,转入继代培养基(N6+2.0 mg/L 2,4-D+700 mg/L脯氨酸+500 mg/L水解酪蛋白+30 g/L蔗糖)上,25℃暗培养3 d,然后用无菌水冲洗愈伤组织2~3次,再用含300 mg/L头孢霉素(Cef)的液体继代培养基清洗1次,置于滤纸上吸干,转入继代培养基(N6+2.0 mg/L 2,4-D+700 mg/L脯氨酸+500 mg/L水解酪蛋白+30 g/L蔗糖)中,25℃暗培养1周,再转入含200 mg/L Cef和50 mg/L Kan培养基(N6+2.0 mg/L 2,4-D+700 mg/L脯氨酸+500 mg/L水解酪蛋白+30 g/L蔗糖+200 mg/L Cef+50 mg/L Kan,pH值5.8)上避光筛选,每代15 d,连续筛选2代。
1.2.3 农杆菌转化部分条件的优化
1.2.3.1 Cef浓度对农杆菌的抑制效果。从新鲜的平板上挑取农杆菌单菌落,接种到含50 mg/L Kan的3 mL YEP培养基中,28℃下180 r/min振荡培养生长至OD600为0.5;按1∶100的比例均匀稀释培养液,每管分装5 mL,分别添加不同浓度的Cef,试验Cef浓度设0(CK)、100、200、300、400、500和600 mg/L计7个处理,3次重复,在波长600 nm下测定OD600;并在28℃下180 r/min振荡培养,培养24 h,测定其OD600。计算3个重复样品OD600的算术平均值。
1.2.3.2 影响玉米愈伤组织遗传转化的因素条件筛选。
(1)侵染液类型对转化的影响。以昌7-2×HiⅡA愈伤组织为转化受体,分别采用LB、N6、YEP培养基作为侵染液,28℃暗培养3 d后进行GUS染色,观察染色结果。
(2)As对转化的影响。以昌7-2×HiⅡA愈伤组织为转化受体,分别采用YEP和LB培养基作为侵染液,2种培养基均分别设侵染与共培养时不加As、侵染与共培养时加入100μmol/L As处理,28℃暗培养3 d后进行GUS染色,观察染色结果。
(3)侵染时间对转化的影响。分别以郑22×87-1和昌7-2×HiⅡA愈伤组织为转化受体,侵染时间设5、10、15、20、25和30 min共6个处理,每处理200块愈伤,侵染后25℃共培养3 d,2次继代筛选后统计抗性愈伤数量,计算抗性愈伤率(抗性愈伤数/转入筛选愈伤总数×100%)。
(4)共培养后处理方式对转化的影响。对郑22×87-1共培养的愈伤,进行5个不同的处理。对照(CK):共培养后直接转入延迟筛选培养基;A1处理:共培养后洗菌,用滤纸吸去多余水分,直接转入延迟筛选培养基;A2处理:共培养后洗菌,用滤纸吸去多余水分,在超净工作台上小风吹2 h后转入延迟筛选培养基;A3处理:共培养后洗菌,放在滤纸上吸水5 h,转入延迟筛选培养基;D1处理:培养基上加1层滤纸共培养,共培养后不洗菌,直接转入延迟筛选培养基;D2处理:培养基上加1层滤纸共培养,共培养后洗菌,滤纸吸去多余水分,转入延迟筛选培养基。每处理100块愈伤,25℃暗培养7 d,观察愈伤状态;然后转入筛选培养基,筛选培养2次,统计抗性愈伤数量,计算抗性愈伤率。
1.2.4 GUS组织化学染色 采用GUS组织化学染色法[8],将待检愈伤组织培养共培养后,置于X-Gluc染色液中染色,37℃恒温过夜,加等量70%酒精停止反应。可反复用70%或95%酒精浸泡,退掉组织绿色,使蓝色更清楚。用实体显微镜(ZOOM 2000)检测颜色反应,并计数。
2 结果与分析
2.1 Cef浓度对农杆菌的抑制效果
Cef对导入不同质粒的同一种农杆菌的抑制效果完全一致,均可以明显抑制农杆菌繁殖,其中100 mg/L Cef处理能够完全抑制农杆菌的生长(图1)。表明Cef对农杆菌的抑菌效果不因外来质粒的导入而有差异。

图1 头孢霉素对农杆菌的抑制效果Fig.1 Inhibitory effect of cephalosporin on A.tumefaciens
2.2 影响玉米愈伤组织遗传转化的因素条件筛选
2.2.1 侵染液类型对转化的影响 分别用加入AS的3种侵染液进行侵染转化,共培养后染色,结果(图2)显示,不同侵染液的区别不明显。表明侵染液类型不是影响转化率的决定因素。
2.2.2 As对转化的影响 侵染与共培养时加入As,GUS染色率明显提高,愈伤组织染色后呈蓝色的数量多,且蓝色较深(图3)。不加As的LB和YEP培养基,染色率分别为10.0%和23.8%;加入As后,2种培养基的染色率分别为50.0%和57.1%。表明在玉米愈伤组织的转化过程中加入As,可以明显提高转化效率。

图2 侵染液类型对玉米愈伤组织转化的影响Fig.2 Effects of different infection liquors on callus transformation of maize

图3 As对玉米愈伤组织转化效率的影响Fig.3 Effects of AS on callus transformation efficiency of maize
2.2.3 侵染时间对转化的影响 侵染时间是影响转化效率的重要因素。侵染时间过长,在以后的培养过程中农杆菌对愈伤组织伤害过大,对筛选抗性愈伤不利;侵染时间过短,农杆菌与愈伤组织接触不充分,也会导致转化效率降低。随着侵染时间的延长,抗性愈伤率呈先升高后降低的变化(图4)。对于郑22×87-1,侵染5、10、15 min经2次筛选后抗性愈伤率分别为5.5%、9.0%和3.0%;侵染20、25、30 min经2次筛选后愈伤逐渐褐化死亡,未得到抗性愈伤。对于昌7-2×HiⅡA,侵染5、10、15、20 min经2次筛选后抗性愈伤率分别为8.0%、11.0%、4.5%和4.0%;侵染25、30 min经2次筛选后未得到抗性愈伤。因此,侵染时间不宜超过15 min,以10 min最佳。
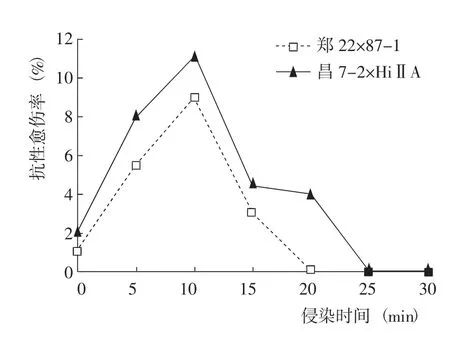
图4 侵染时间对转化的影响Fig.4 Effect of infection time on transformation
2.2.4 共培养后处理方式对转化的影响 共培养后经过不同处理,转入延迟筛选培养基,1周后观察结果(表1)显示,愈伤组织生长慢,颜色发暗,其中A3、D1和D2处理有少量鲜黄愈伤。出现这种状况的原因,除愈伤组织本身的差别外,农杆菌对愈伤的伤害作用较大,农杆菌在接触培养基的地方生长较快,D1和D2处理在共培养时加入了1层滤纸,这样大量繁殖的农杆菌被滤纸吸附,愈伤组织上未见有大量农杆菌,可见在后期培养过程中对愈伤的伤害较小,愈伤生长状态较好(图5);且这样处理后,洗菌与否转化效果差异不大。而A1、A2和A3处理的洗菌效果不理想,原因是愈伤过多受水分影响,在后期培养过程中,愈伤整体生长状态不好,有水渍化现象。因此,共培养时培养基上附加1层灭菌滤纸能减少农杆菌对愈伤组织的伤害,既能起到共培养的作用,又能得到生长质量好的抗性愈伤。

表1 郑22×87-1共培养后不同处理方式对转化的影响Table 1 Effect of different treatments after co-culture on transformation of Zheng 22×87-1
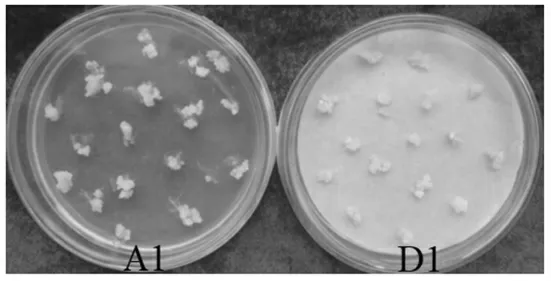
图5 共培养后不同处理方式对愈伤生长的影响Fig.5 Effects of treatments after co-culture on the growth of callus
3 结论与讨论
农杆菌介导的转化是一个复杂的体系,影响转化的因素较多,农杆菌菌株类型及载体、受体材料生长状态及基因型、培养基成分及附加物等都对转化效率有很大影响。菌株和载体也对转化起到很重要的作用,其中超双无载体Psb131和pTOK233一般用LBA4404进行转化[9,10]。
在农杆菌介导的转化过程中,要使转化最为有效,就要利用农杆菌快速繁殖期(即对数生长期)的菌液转化,这时农杆菌具有很高的活性。本研究中对所保存的菌株进行多次活化,以使农杆菌处于最好的侵染状态,提高转化成功率。受体材料保持旺盛分生状态是农杆菌侵染的必需条件[11]。研究表明,当植物细胞处于分裂旺盛期或DNA合成活跃时,转化率最高。只有愈伤组织处于旺盛的分生状态,才能提高农杆菌的转化效率。因此,本研究在侵染前将优良的胚性愈伤组织继代预培养3 d,以使愈伤组织细胞处于活跃的分裂增殖状态来接受外来基因的转入,同时也增强愈伤组织对农杆菌伤害的抵抗能力,确保转化成活率。
在农杆菌介导的遗传转化中,外植体与农杆菌共培养后,在表面及浅层组织中仍附着或共生有大量的农杆菌。本研究结果表明,Cef可以明显抑制农杆菌繁殖,Cef浓度≥100 mg/L时能够完全抑制农杆菌生长。由于抗菌素加入固体培养基抑菌效果不如加入液体培养基直接,所以可适当提高抗菌素的浓度。综合考虑,在农杆菌介导的玉米遗传转化中,为尽快消除农杆菌对愈伤组织的伤害,可在延迟筛选时选用200 mg/L的Cef快速抑菌;若在筛选时选用100 mg/L的Cef,根据抑菌情况,分化时可以进一步减少。做到既可以完全抑制农杆菌的生长,又可以最大程度地降低对愈伤的伤害。
农杆菌T-DNA转移及整合到植物中,主要由Ti质粒上的Vir基因编码的功能蛋白完成,Vir基因需要一些诱导因子才能被活化,而植物受伤细胞分泌酚类化合物如As、苯乙酮及结构类似物等是Vir基因的诱导因子。刘志明等[12]、Mathews等[13]和Godwin等[14]研究表明,农杆菌介导的遗传转化过程中,酚类化合物As和复合酚类化合物起到明显的促进作用。Stachel等[15]和刘建光等[16]认为,酚类化合物As对农杆菌Vir基因的诱导是必要的。因而酚类化合物被广泛用于促进农杆菌介导的遗传转化。As是双子叶植物细胞壁合成的前体,所以认为双子叶植物是农杆菌的天然受体。许多研究认为单子叶植物可能不产生酚类化合物或产生的量不足以作为信号诱导分子,因此添加一定量AS以促进根癌农杆菌感染单子叶植物。本研究结果表明,As在不同侵染液中所起的作用有差异,其中LB培养中加入As时效果明显,愈伤组织染色率较不加As处理明显提高。
侵染时间对农杆菌介导的转化有较大影响[17]。一定范围内,延长侵染时间可以提高GUS基因在愈伤组织中的表达水平,但是进一步提高侵染强度,GUS表达率未发生很大变化,可能是由于加大侵染强度会降低受体细胞活力,引起转化效率降低[18]。本研究结果也表明,侵染时间对转化后抗性愈伤的获得有较大影响,侵染时间超过15 min基本上筛选不到抗性愈伤组织。较长的侵染时间可能会提高农杆菌对受体材料的附着能力,在一定程度上提高转化效率,但是大量的农杆菌对受体材料产生了极大的伤害,即使基因转化进入,也很难筛选到抗性愈伤组织。
