糖尿病周围神经病变机械性痛觉超敏的比较性研究*
2021-06-29廖陈龙陈鸿锦钟文翔张文川
廖陈龙 周 晗 陈鸿锦 钟文翔 张文川△
(1上海交通大学医学院附属第九人民医院神经外科,上海200011;2上海交通大学医学院附属新华医院神经外科,上海200092)
糖尿病周围神经病变(diabetic peripheral neuropathy, DPN)并发的疼痛是指由糖尿病或糖尿病前期导致的周围神经病理性疼痛,其发病机制复杂,对标准化镇痛治疗效果差,严重影响病人生活质量,是疼痛临床控制的难题[1]。另有一部分DPN病人并不出现疼痛,而主要表现为感觉缺失。因此,DPN可根据临床表现分为痛性与非痛性DPN两类。两者的鉴别有助于推进痛性DPN发病机制的研究,在进一步探索其高危因素的基础上判别对相关治疗敏感的潜在人群[2,3]。既往大量研究致力于比较痛性与非痛性DPN之间的区别,但无论在临床特征(年龄、糖尿病病程、血糖水平、肥胖指标等)、基础神经病变(感觉运动神经功能障碍、各类纤维功能和形态学改变、自主神经病变等),还是在神经微循环障碍或相关病理机制(免疫反应、炎性机制、基因易感性等)等方面,均未能明确两者之间的差异[4,5]。因此我们推测,这可能与DPN疼痛性质的多样性相关。作为神经病理性疼痛,DPN疼痛可表现为自发性及诱发性疼痛,后者包括痛觉过敏及痛觉超敏[6],且根据刺激因素(如压力、针刺、温度)的不同,可有多种分类[7],因此痛性DPN并非单一的病变,而应视为一类异质性的病变,其与非痛性DPN的区别应建立在进一步疼痛模式分类的基础上。
鉴于机械性痛觉超敏是神经病理性疼痛的特征性表现,本研究创新性地将机械性痛觉超敏从神经病理性疼痛的诸多表现中抽提出来,通过比较机械性痛觉超敏阳性与阴性糖尿病大鼠的周围神经纤维损害情况及相关神经元的激活模式差异,以期探索DPN机械性痛觉超敏的发生发展机制,为比较不同表型的痛性DPN提供实验基础及理论依据。
方 法
1.实验动物
本实验动物进行的研究行为均严格遵守相关动物保护及使用规定,并已通过上海交通大学医学院附属新华医院伦理委员会批准(伦理号:XHEC-FNSFC-2018-017)。成年雄性SD大鼠(200~250 g)购自上海生命科学研究院实验动物中心,饲养于本单位实验动物中心。
2.分组与建模方案
根据本课题组前期建模数据及相关文献[8,9],采用链脲佐菌素 (Streptozotocin, STZ, 美国Sigma)腹腔注射组(60 mg/kg)建立糖尿病模型,后者高血糖可维持4周以上,单次注射建模成功率在95%以上,单次未成功模型可在1周后追加同剂量STZ。采用随机数字表法将大鼠随机非平均分为4组,一组通过链脲佐菌素腹腔注射组(60 mg/kg)建立糖尿病模型(n= 60),一组在此基础上结合坐骨神经乳胶管置入建立糖尿病模型(n= 20),其余2组分别作为对照组(溶媒腹腔注射及溶媒腹腔注射结合坐骨神经乳胶管置入,n= 8),见图1。右侧坐骨神经乳胶管置入法依据本课题组前期实验方案进行[10],即于坐骨结节近端1 cm至远端3 cm置入一段(长约1 cm)内径与该段坐骨神经直径相仿的长筒状乳胶管,达到仅接触但不压迫坐骨神经的程度;单纯注射STZ实验组大鼠行假手术切口。分别于建模后3天、1周对各组大鼠通过尾静脉采血检测空腹血糖,视血糖浓度> 16.7 mmol/L为糖尿病成功建模。分别于建模后3天及后续每周检测各组大鼠后爪机械缩足反射阈值 (mechanical withdrawal threshold, MWT)及热缩足反射潜伏期(thermal withdrawal latency, TWL)。前者采用vonFrey纤维丝、“up and down”法检测[10,11];后者采用热板仪检测:将透明有机玻璃箱将大鼠罩于热板仪上,适应20~30分钟后通过热辐射光源聚焦到顶部玻璃(初始温度维持在30℃),启动热板仪(升温速度为每秒1℃)后,记录开始照射至大鼠出现缩足、舔足的时间,重复测定3次,间隔10分钟,取平均值记为TWL,设置每次最长辐射时间为30 s,避免灼伤大鼠足底皮肤。建模4周后,去除热痛觉过敏阴性的大鼠,根据MWT,将2组实验组大鼠进一步分为机械性痛觉超敏阳性(MA +)与阴性(MA -)组,各实验亚组随机选择8只大鼠,处死后取材。
3.神经形态学检查
大鼠麻醉(2%戊巴比妥钠,50 mg/kg,腹腔注射)后,原切口暴露并截取长约1 cm的坐骨神经,分为三部分,两部分备用形态学检查:电镜检查及甲苯胺蓝(美国Sigma)染色后光镜检查[10],另一部分备用Western blot检测。使用Image Pro Plus软件进行测量、分析:测量有髓和无髓神经纤维、轴突的数量和直径,计算g比例(轴突面积/总神经纤维面积)及神经纤维密度[12]。
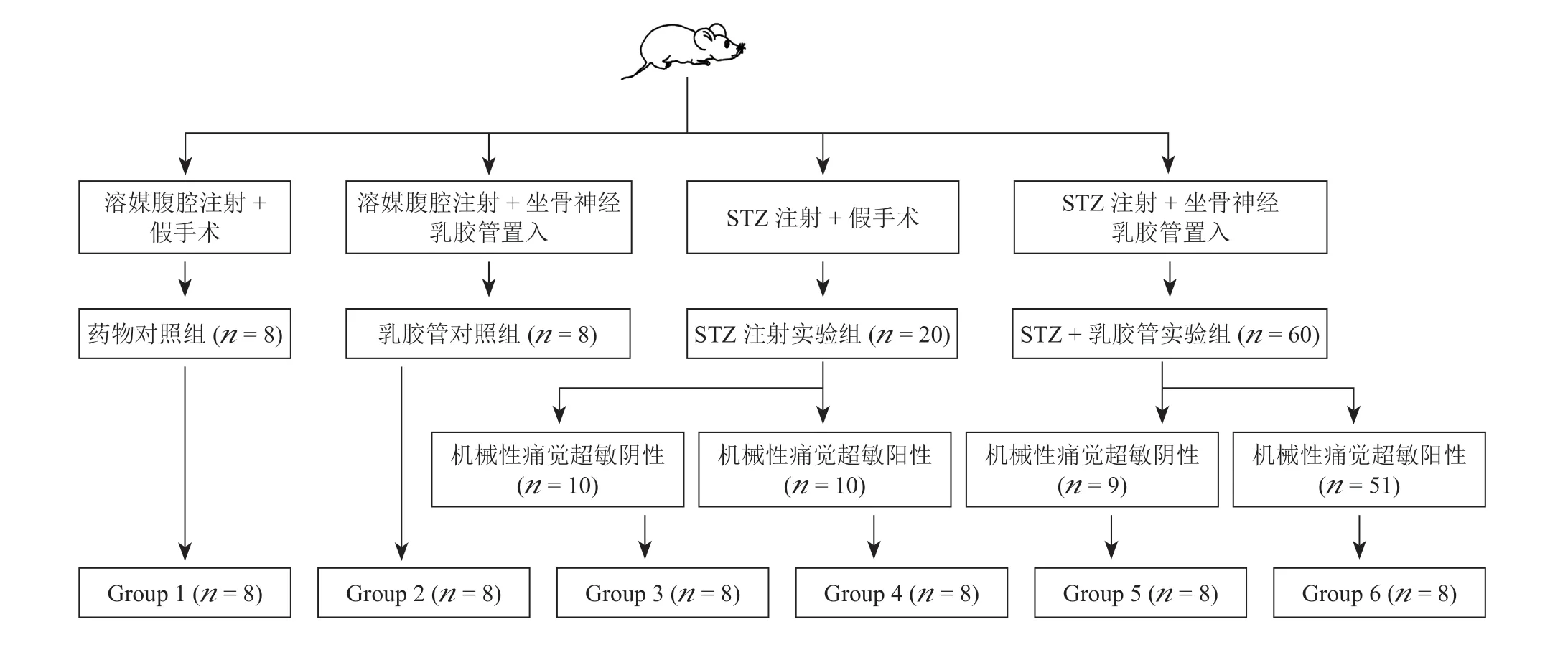
图1 实验动物分组及数量Fig. 1 Grouping and quantity of the rats
4. Western blot实验
坐骨神经组织经裂解、离心、转移上清等步骤后以BCA试剂盒(武汉谷歌生物科技有限公司)行总蛋白定量,电泳转膜后封闭,分别添加一抗:兔抗MBP抗体(1:500,武汉博士德生物工程有限公司),小鼠抗GAPDH(1:1,0000,武汉谷歌生物科技有限公司),后添加相应二抗,化学发光试剂进行显影,软件分析条带光密度值,以其相对于GADPH密度的比值进行统计分析。
5.免疫荧光及组化实验
大鼠心脏灌注后取右侧L4-6背根神经节(dorsal root ganglion, DRG)及L4-5节段的腰髓,包埋后对前者行矢状面切片(20 μm),对后者行横截面切片(4 μm)。DRG切片:取各组不同切片分别加入以下一抗:小鼠抗神经丝200 (NF-200)抗体(1:200,英国Abcam)和兔抗c-Fos抗体(1:2000,英国Abcam);小鼠抗降钙素基因相关肽(CGRP)抗体(1:100,英国Abcam)和兔抗c-Fos抗体(1:2000),相应二抗:Alexa Fluor 647标记的山羊抗兔IgG(1:50,美国Jackson)和FITC标记的山羊抗小鼠IgG(1:50,美国Jackson),随后滴加DAPI染液复染细胞核。腰髓切片:取各组切片添加一抗:兔抗c-Fos抗体(1:2000),相应二抗:生物素化羊抗兔抗体(1:200,美国Vector),洗片、孵育(ABC,1:200,美国Vector)、显色(DAB,丹麦DAKO)。
DRG切片:倒置荧光显微镜观察,Image Pro Plus软件计数NF-200与c-Fos、CGRP与c-Fos双标细胞及占比。
腰髓切片:光学显微镜下观察,Image Pro Plus软件计数脊髓背角中浅层(I-II)与深层(III-V)的c-Fos染色细胞。
6.统计学分析
统计学分析使用SPSS 18.0软件,分类变量采用百分比表示,组间比较采用Pearson'sX2检验;连续变量(符合正态分布)采用均数±标准差(±SD)表示,组间比较采用方差分析,两两比较采用t检验,P< 0.05为差异有统计学意义。
结 果
1.一般情况和行为学
建模后3天至1周,实验组大鼠均出现血糖升高(16.7 mmol/L),明显高于对照组。在第4周时,STZ +乳胶管实验组中机械性痛觉超敏阳性大鼠51只,机械性痛觉超敏阴性大鼠9只;STZ注射组中机械性痛觉超敏阳性大鼠10只,机械性痛觉超敏阴性大鼠10只。STZ +乳胶管实验组机械性痛觉超敏的发生率(51/60)显著大于单纯STZ注射组(10/20,Pearson'sX2= 10.147,P< 0.05)。两实验组中机械性痛觉超敏阳性组的平均MWT值均显著低于机械性痛觉超敏阴性组及相应对照组(P< 0.05),后两者的平均MWT值均未见明显差异(见图2A);各实验亚组的平均TWL值均低于相应对照组(P< 0.05),且各实验亚组间未见明显差异(见图2B)。
2. 坐骨神经MBP定量
如图2C, D所示,各实验亚组均较对照组出现显著的MBP表达水平升高(P< 0.05);各实验组中,机械性痛觉超敏阳性组的MBP表达量较阴性组显著升高(P< 0.05)。
3. 神经形态学
如图3所示,各实验组均出现不同程度的神经脱髓鞘病变及变性变化。神经纤维形态测定结果如表1所示,各实验亚组的有髓纤维g比例较相应对照组显著升高(P< 0.05),而有髓神经纤维区域及密度均较相应对照组减少(P< 0.05)。在各实验组中,机械性痛觉超敏阳性组的有髓纤维g比例较相应阴性组显著升高(P< 0.05),而有髓神经纤维区域及密度均较相应阴性组减少(P< 0.05)。神经形态学观察和神经形态测定结果均显示各实验组中存在无髓纤维的变性,与相应对照组对比,各实验组出现显著的无髓神经纤维区域及密度的减少(P< 0.05),但机械性痛觉超敏阳性组与阴性组未见显著性差异。
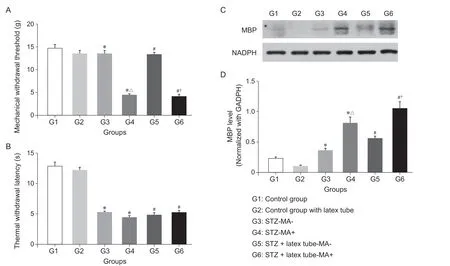
图2 第4周各组大鼠疼痛行为学结果及各组大鼠坐骨神经MBP的表达(A)后爪机械缩足反射阈值结果;(B)后爪热缩足反射潜伏期结果;(C, D)采用蛋白质免疫印迹实验检测各组大鼠坐骨神经MBP的表达情况;(C)电泳结果;(D)相对表达量统计结果。*P < 0.05,与1组相比;#P < 0.05,与2组相比;△ P < 0.05,与3组相比;†P < 0.05,与5组相比。Fig. 2 Nociceptive behavioral results and the expression of myelin basic protein (MBP) in sciatic nerve of each group at the 4th week(A) The mechanical withdrawal threshold; (B) The thermal withdrawal latency; (C, D) Western blot analysis of the expression of myelin basic protein (MBP) in sciatic nerve; (C) Electrophoresis bands; (D) Standardized MBP expression.*P < 0.05, compared with group 1; #P < 0.05, compared with group 2; △P < 0.05, compared with group 3; †P < 0.05, compared with group 5.
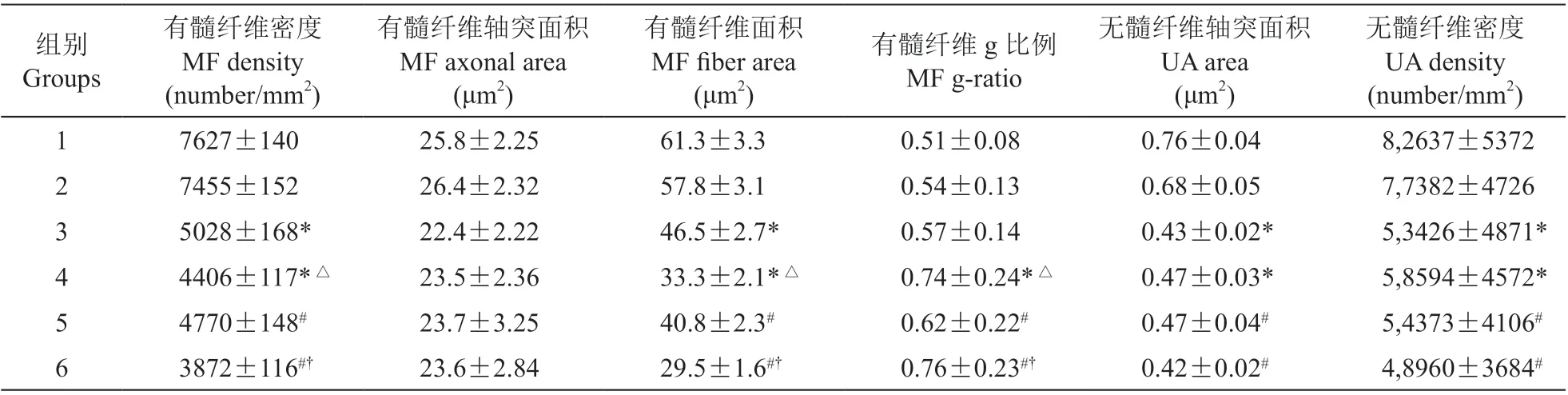
表1 各组周围神经纤维的形态计数学数据Table 1 Morphometric data of peripheral nerve fibers in all groups.
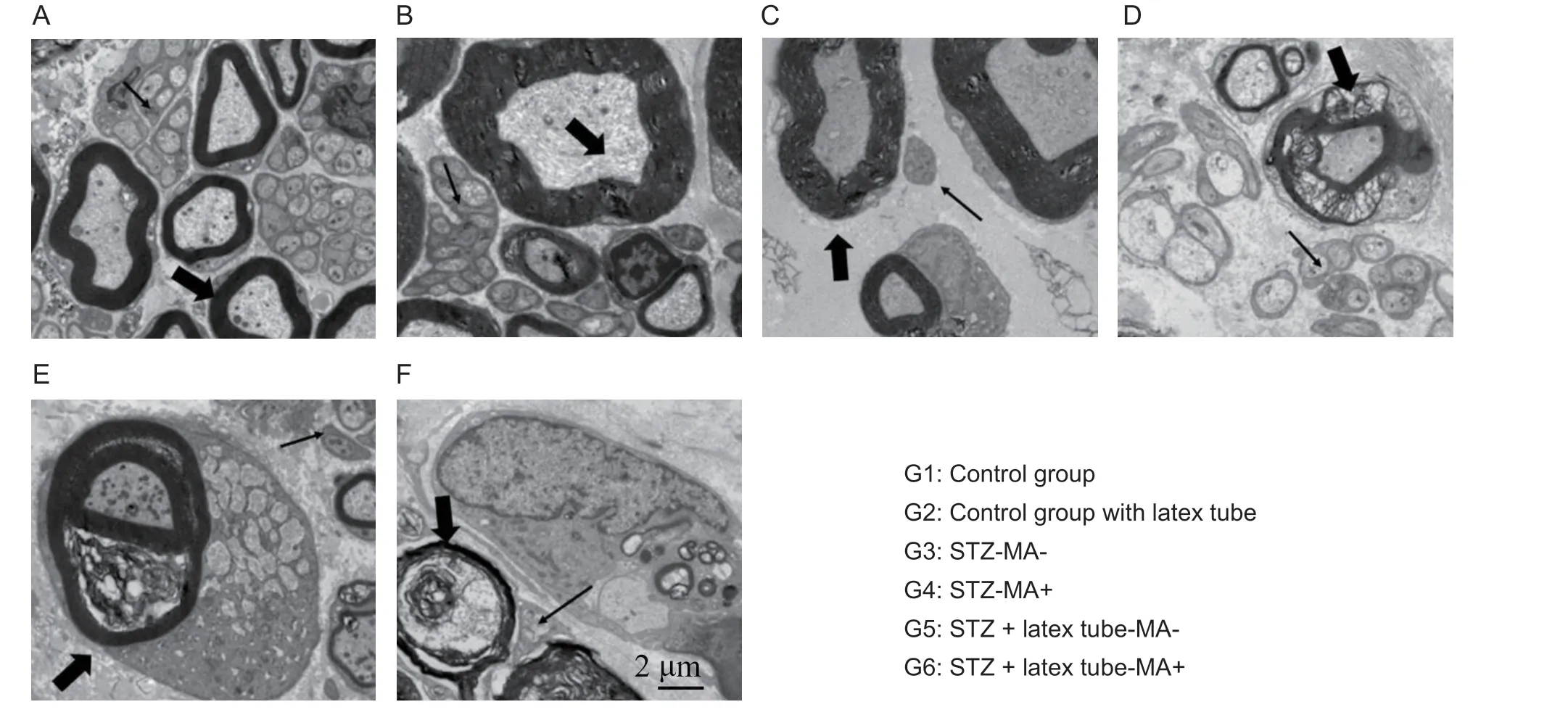
图3 电镜下观察各组大鼠坐骨神经(A-F)依次表示第1~6组。与两组对照组(A, B)相比,各组实验组(C-F)可见不同程度的脱髓鞘和神经变性病变。机械性痛觉超敏阳性组(D, F)比阴性组(C, E)出现更为显著的脱髓鞘病变,髓鞘板层出现明显紊乱、断裂、肿胀。粗箭头表示有髓纤维,细箭头表示无髓纤维。比例尺= 2微米Fig. 3 Electron micrographs of sciatic nerve in each group(A-F) Showed groups 1-6 in turn. The morphologies of sciatic nerves in two control groups (A, B) were almost intact and normal. Abnormal morphological structures of both myelinated (arrow head) and unmyelinated fibers (thin arrow),presenting as dense and collapse configuration and different degree of myelin impairments, could be noted in the experimental subgroups (C-F). More serious demyelination were found in MA + groups (D, F) than in MA-groups (C, E),accompanied by disorder, edema and disarray of myelin sheath. Scale bar = 2 μm
4. DRG神经元激活
如图4所示,与相应对照组相比,实验组中DRG内激活(c-Fos标记)的NF-200及CGRP阳性神经元数量均显著增多(P< 0.05)。在两对实验组中,机械性痛觉超敏阳性组DRG内激活(c-Fos标记)的NF-200阳性神经元数量较阴性组显著增多(P< 0.05,见图4A, C),而DRG内激活(c-Fos标记)的CGRP阳性神经元数量在机械性痛觉超敏阳性组与阴性组之间未见明显差异(见图4B, C)。
5.脊髓背角神经元激活
如图5A-F所示,与相应对照组相比,实验组中脊髓背角浅表(I-II)、较深(III-V)板层内激活(c-Fos标记)的神经元数量较相应对照组显著增多(P<0.05)。在两对实验组中,机械性痛觉超敏阳性组脊髓背角内激活(c-Fos标记)的神经元数量较阴性组显著增多(P< 0.05,见图5G)。

图4 采用免疫荧光实验分别检测各组大鼠DRG内c-Fos与NF-200或CGRP共表达情况(A)各组DRG内NF-200与c-Fos共染情况,可见各实验组中存在不同数量的NF-200与c-Fos共染神经元(白色箭头),以第4、6组居多;(B)各组DRG内CGRP与c-Fos共染情况,可见各实验组中存在不同数量的NF-200与CGRP共染神经元(白色箭头);(C)双染神经元统计结果。比例尺= 100微米*P < 0.05,与1组相比;#P < 0.05,与2组相比;△ P < 0.05,与3组相比;†P < 0.05,与5组相比。Fig. 4 Co-expression of c-Fos and NF-200 or CGRP in DRG by immunofluorescence double staining(A) In two control groups, almost no immunofluorescent labeling of c-Fos protein was noted in NF-200+ DRG neurons. In contrast, the immunofluorescent labeling of c-Fos protein could be seen in NF-200+ DRG neurons of the other four experimental groups, and more double labeled neurons were observed in MA + groups (group 4 and 6) than in MA- groups (group 3 and 5); (B) In the two control groups, there was almost no immunofluorescence labeling of c-Fos protein in CGRP+ DRG neurons, while in the other four experimental subgroups, there was a large number of immunofluorescence labeling of c-Fos protein in CGRP+ DRG neurons; (C) Statistical results of immunofluorescence double stained neurons. Scale bar = 100 μm*P < 0.05, compared with group 1; #P < 0.05, compared with group 2; △ P < 0.05, compared with group 3; †P < 0.05, compared with group 5.

图5 采用免疫组化实验检测各组大鼠脊髓背角浅表板层(I-II)及较深板层(III-V)内c-Fos阳性神经元(A-F)依次表示第1~6组。与对照组(A, B)相比,各实验组(C-F)的浅表、较深板层内均存在不同数量的c-Fos阳性神经元,以第4、6组(D, E)居多;(G)各组大鼠脊髓背角浅表、较深板层内c-Fos阳性神经元数量统计结果。比例尺= 100 微米*P < 0.05,与1组相比;#P < 0.05,与2组相比;△ P < 0.05,与3组相比;†P < 0.05,与5组相比。Fig. 5 c-Fos positive neurons in the superficial lamina (I-II) and deeper lamina (III-V) of spinal DH were detected by immunohistochemistry(A-F) showed groups 1-6 in turn. When compared with the control groups (A, B), various c-Fos positive neurons could be noted in both superficial and deeper laminae in all experimental groups (C-F), with larger number of c-Fos positive neurons in group 4 and group 6 (D, E); (G) Statistical results of the number of c-Fos positive neurons in the superficial and deeper layers of spinal DH in each group. Scale bar = 100 μm*P < 0.05, compared with group 1; #P < 0.05, compared with group 2; △ P < 0.05, compared with group 3; †P < 0.05, compared with group 5.
讨 论
糖尿病可导致周围神经因肿胀而易受解剖狭窄的卡压性损害,后者很大程度取决于神经肿胀程度及其与解剖狭窄的匹配情况[13,14],因此本研究采用既往报道的糖尿病大鼠神经卡压模型,通过在糖尿病大鼠周围神经行等管径的乳胶管置入来提高神经卡压的发生率[8],因乳胶管内径与坐骨神经相仿,初始置入时并不压迫神经,仅神经在高糖状态下发生肿胀后才出现受压,本研究发现与传统STZ诱导的DPN模型相比,神经压迫因素与DPN大鼠机械性痛觉超敏的发生率呈正相关。
MBP是中枢和周围神经系统髓鞘的重要组成部分,是检测脱髓鞘病变的重要指标之一[15],因此通过MBP的定量研究(见图2C, D),我们明确了机械性痛觉超敏阳性组比阴性组大鼠出现更为严重的周围神经脱髓鞘病变。且神经形态计数学结果也显示,机械性痛觉超敏阳性组比阴性组出现更为显著的有髓纤维损害(见表1),既往研究已证实有髓神经纤维比无髓神经纤维更容易受到机械压迫性损伤[16,17],因此,综合本研究发现,DPN机械性痛觉超敏与有髓神经纤维的压迫性损害密切相关。这也为临床上采用神经减压术可有效缓解疼痛,尤其是机械性痛觉超敏提供理论和实验依据[18]。
本研究进一步利用可显示神经元激活状态的c-Fos蛋白对机械性痛觉超敏阳性与阴性组大鼠进行DRG及脊髓背角神经元激活状态的对比研究,结合本研究所采用的疼痛行为学检查,分别采用NF-200和CGRP标记有髓纤维和肽能无髓纤维及其相关神经元,前者传导粗触觉传入,大部分投射至脊髓背角较深部板层(III-V);后者传导痛温觉传入,投射至脊髓背角浅表板层(I-II)。通过DRG的免疫荧光双标实验,发现机械性痛觉超敏与DRG内有髓神经纤维相关神经元(NF-200阳性)的激活密切相关(见图5A, C),而后者已被证实可由周围神经的脱髓鞘病变导致,其机制包括DRG神经元表型的改变(包括肽类及离子通道的表达变化等)、神经元的高兴奋性及异位冲动传导,这些改变通常伴有初级传入纤维的异常自发性电活动及脊髓背角水平的中枢重塑变化[19]。因此,结合以上研究结果,我们推测有髓神经纤维的损害(脱髓鞘病变)可通过以上途径导致DRG内相关神经元的激活,易化有髓纤维介导的非伤害性刺激(粗触觉)的传入,后者在某些病理状态下(如糖尿病)可被感知为伤害性感受,即表现为机械性痛觉超敏。虽然也存在不同的观点认为机械性痛觉超敏是由于外周神经损伤后有髓神经纤维传入信号减少引起,但有髓神经纤维受到易化后传入增强引起机械性痛觉超敏这一结论也得到了电生理研究的验证和支持[20]。Xu等在一项体内研究通过阻断有髓Aβ纤维成功抑制神经病理性疼痛中的机械性痛觉超敏的发生[21],也支持了这一观点。
本研究在证实糖尿病大鼠脊髓背角神经元激活的基础上[22,23],进一步发现机械性痛觉超敏阳性组大鼠的脊髓背角浅表(I-II)、较深(III-V)板层的激活神经元数量较阴性组显著增多,提示脊髓背角的神经元激活数量与机械性痛觉超敏的发生发展密切相关,该结果也支持了上述有髓神经纤维传入增强导致机械性痛觉超敏的论点。且根据疼痛门控理论,Aβ纤维与脊髓背角浅表板层(I-II)伤害性知觉感受区之间存在投射关系,而在高糖环境的病理作用下,Aβ纤维在生理状态下受到脊髓背角中间神经元的抑制作用被解除(去抑制效应),使得其介导的非伤害性触觉刺激由脊髓背角较深板层(III-V)传入浅表板层(I-II),引起伤害性感受[24]。结合该理论,本研究的结果也验证了脊髓背角的中枢重塑变化在机械性痛觉超敏发生发展中的作用。因此,本研究在周围神经(神经纤维、DRG)及中枢(脊髓背角)水平明确了机械性痛觉超敏阳性与阴性的差异。
除了机械性痛觉超敏,本研究观察到大部分糖尿病大鼠出现热痛觉过敏,相应地发现糖尿病周围神经普遍存在无髓纤维的退变(见图3和表1),DRG内无髓纤维相关的CGRP阳性神经元普遍受到激活,且在机械性痛觉超敏阳性与阴性组之间未见明显差异(见图4B, C),结合无髓纤维容易受到糖尿病炎性因素损害的特点[17,25],可认为无髓纤维的损害及DRG内CGRP阳性神经元的激活与糖尿病热痛觉过敏的发生发展关系密切。
本研究通过将DPN疼痛症状进一步分类,在周围神经系统和脊髓中枢水平发现机械性痛觉超敏阳性与阴性的糖尿病大鼠之间的差异,证实DPN神经病理性疼痛一类异质性的病变,为今后不同表型的痛性DPN的比较研究提供理论依据及思路。
