青海省青贮玉米链格孢叶枯病病原菌鉴定及其致病力分析
2021-06-28祁鹤兴芦光新李宗仁徐成体德科加周孝娟王英成马桂花
祁鹤兴,芦光新*,李宗仁,徐成体,德科加,周孝娟,王英成,马桂花
(1.青海大学农牧学院,青海 西宁810016;2.青海大学畜牧兽医科学院,青海 西宁810016)
青贮玉米(Zea mays)是指在适宜收获期内收获包括果穗在内的地上全部绿色植株,经切碎、加工,适宜用青贮发酵的方法来制作青贮饲料以饲喂牛、羊等草食牲畜的一种玉米[1-2]。它与一般普通(籽粒)玉米相比具有生物产量高、营养丰富、气味芳香、消化率较高、干物质和水分含量适宜等特点[3]。青海属于青藏高原玉米产区,玉米生产发展速度快、潜力大,特别是青贮玉米依其高产、高值、高质的优势,已成为青海玉米发展的一个优势趋向[4]。
但是,青贮玉米叶斑病的发生制约着青贮产业的健康发展。2018-2019年,本研究组在青海省海东市民和县、西宁市湟中县和大通县、黄南藏族自治州尖扎县青贮玉米种植区进行病害调查时发现链格孢叶枯病发生普遍,危害较大,而玉米常见病害大小斑病、灰斑病等偶有发生,对青贮玉米危害不大。链格孢属真菌种类多且寄主范围广泛,严重影响农作物的产量,长期以来给农业生产带来了巨大损失[5-8]。链格孢菌致病主要是通过产生多种致病毒素,引起寄主植物病变[6,9]。链格孢属真菌能产生结构各异的毒素化合物,使植物出现萎蔫、水浸状、褪绿、坏死等症状[10-12]。链格孢产生的毒素对哺乳动物也有一定毒性,对同一生态环境中的其他生物也有影响[13]。人及动物摄入被链格孢毒素污染的谷物及饲料,可导致急性或慢性中毒,且某些链格孢毒素还有致畸、致癌、致突变作用[14-17]。
青贮玉米作为家畜饲料,高产优质是生产目标。青贮玉米由于受到链格孢属真菌的侵染,在青贮过程中可能对有益乳酸菌、酵母和其他霉菌产生影响[18-24],并且在青贮过程中病原真菌也可能大量繁殖,进一步产生大量毒素化合物,对畜牧业生产造成影响。目前,国内对玉米链格孢叶枯病的研究还较少,仅对云南省[25]、黑龙江省[26]、甘肃省[27]和海南省[28]的玉米链格孢叶枯病有过报道。青海省青贮玉米链格孢叶枯病病原菌组成和致病力情况尚不清楚。因此为厘清青贮玉米链格孢叶枯病病原菌多样性,本研究分离培养了大量病原菌,对其进行形态学和分子生物学鉴定,并进行致病力分析,旨在为后续研究青贮玉米与链格孢互作,利用链格孢毒素进行青贮玉米抗病性鉴定和开展综合防治等奠定基础。
1 材料与方法
1.1 材料来源
于2018年8-9月在青海省西宁市大通县景阳镇甘树湾村和海东市民和县马场垣乡团结村青贮玉米种植区采集青贮玉米叶枯病病叶,于2019年9月在西宁市湟中县田家寨李家台村和黄南藏族自治州尖扎县康杨镇河滩村采集青贮玉米叶枯病病叶(表1)。在各采样区内,采用五点取样法采集青贮玉米叶枯病叶片,保持叶片干燥通风,及时带回实验室分离病原菌。青贮玉米品种:金皇828、铁研53号和中单2号由青海大学畜牧兽医科学院提供。目前市面上尚无抗链格孢叶枯病的玉米品种,因此选用的3个品种分别是感病、中抗、高抗玉米大、小斑病的品种。
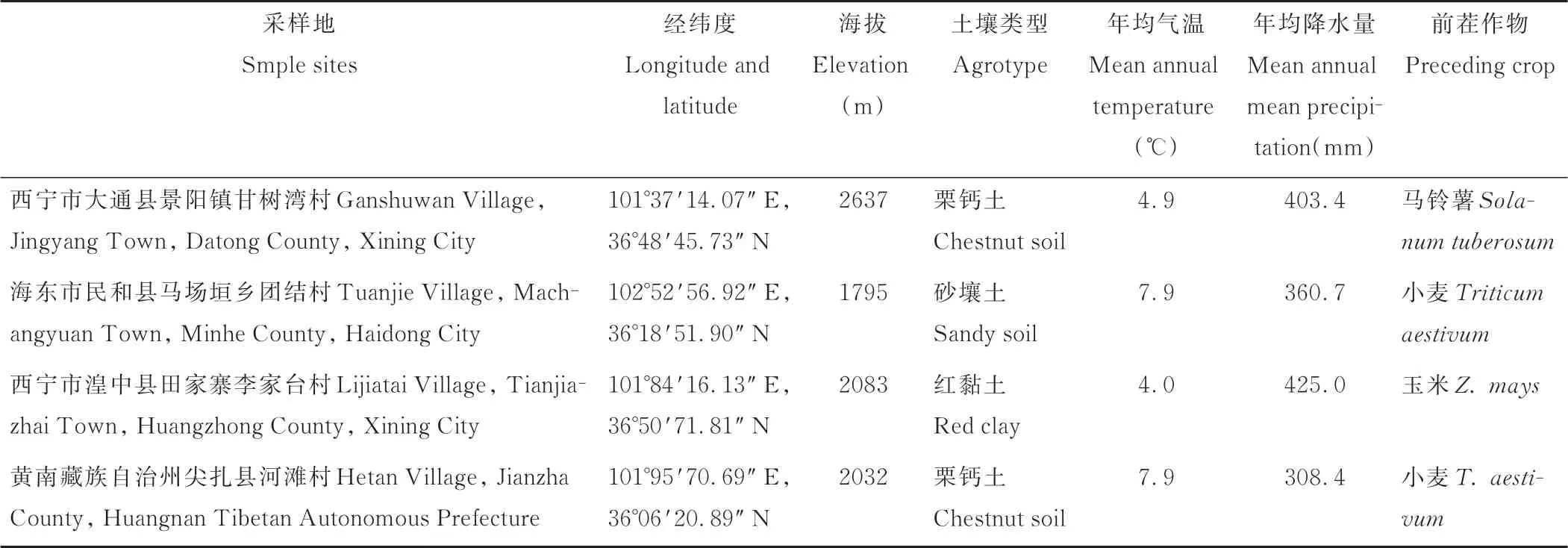
表1 采样地信息Table 1 Information of sample sites
1.2 培养基配制
病原菌的分离使用2%水琼脂培养基(2%WA):琼脂20 g,用蒸馏水定容至1 L;菌株培养使用马铃薯葡萄糖琼脂培养基(PDA):葡糖糖20 g,马铃薯200 g,琼脂18 g,用蒸馏水定容至1 L。121℃高压蒸汽灭菌20 min,备用。
1.3 病原菌的分离、纯化与保存
在病斑的病健交界处剪取0.5 cm×0.5 cm大小的组织,置于3.5%次氯酸钠溶液中消毒1 min,用无菌水冲洗3次,再用无菌滤纸吸干,放在含0.1%氨苄青霉素的水琼脂平板上,置于25℃培养箱中培养36 h。用无菌水将长出的分生孢子洗下配成浓度为2×104个·mL-1的孢子悬浮液,使用移液枪吸取约200μL孢子悬浮液于2%水琼脂平板上涂抹均匀,在超净工作台中晾干,于25℃培养箱中培养至孢子萌发,在体视显微镜下用挑针挑取萌发的单个分生孢子至PDA平板。将分离到的单孢菌株采用滤纸片保存法,置于-20℃冰箱长期保存[29]。
1.4 病原菌的分类鉴定
1.4.1 菌株形态学鉴定 将分离得到的单孢代表菌株接种于PDA平板上,置于25℃培养箱中光照培养7 d,挑取分生孢子制成临时玻片,在40×光学显微镜下观察分生孢子形态。菌株在PDA平板上生长5 d后,用直径0.5 mm的灭菌打孔器取菌饼放置在PDA平板中。每株菌株3次重复,并且每皿培养基的厚度要保持一致。放置于25℃培养箱培养6 d后,观察菌落形态。
1.4.2 菌株基因组DNA的提取 采用CATB法提取基因组DNA[30],步骤如下:1)刮取在PDA平板上培养了5 d的菌落气生菌丝,置于DNA提取离心管中,用细胞破碎仪(MP FastPrep®-24,美国)破碎细胞。2)在离心管中加入2×CTAB抽提液600μL,混合均匀,65℃孵育30 min,每隔10 min颠倒混匀1次。3)孵育完成后,取出离心管,待其冷却至室温后,加入等体积的酚∶氯仿∶异戊醇(25∶24∶1),充分混匀后,12000 r·min-1、4℃离心15 min。4)吸取500μL上清液于1.5 mL灭菌离心管中,加入等体积的酚:氯仿:异戊醇(25:24:1),充分混匀后12000 r·min-1、4℃、离心15 min。之后再吸取400μL上清液重复抽提1次。5)取上清液300μL,加入0.6倍体积的异丙醇,-20℃沉淀30 min。6)12000 r·min-1、4℃、离心15 min。7)弃上清液,用70%的乙醇洗沉淀2次,烘干,用25μL的TE/RNase溶解,-20℃保存。
1.4.3 菌株rDNA-ITS序列分析 扩增引物为ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。反应体系(25μL):2×PCR Mix(Takara)12.5μL;引物ITS1(25 pmol)1.0μL,引物ITS4(25 pmol)1.0μL;模板DNA(30μg.L-1)1.0μL;双蒸水补足至25μL。PCR反应程序:95℃5 min,95℃1 min,55℃1 min,72℃2 min,30个循环,72℃10 min。用0.8%的琼脂糖凝胶电泳检测产物,PCR扩增产物纯化后直接送北京擎科新业生物技术公司进行测序。双向测序,使用软件MAFFT对正反向序列进行拼接,拼接序列用MEGA V.6.0.6软件进行校正。使用PAUP*v.4.0 alpha软件构建系统发育树,采用启发式算法(heuristic searches)进行运算。以Mucor racemosus(GenBank登录号:MT 530270)作为外群,运算重复1000次。19株参照菌株序列下载自NCBI数据库。177株菌株GenBank登录号为MW008873-MW009049。
1.5 菌株致病力测定
将菌株接种至PDA培养基平板,25℃培养7 d,用0.025%吐温20溶液洗下分生孢子并制备浓度为1×105个·mL-1的孢子悬浮液。在直径为12 cm塑料花盆中加入营养土种植青贮玉米。后剪取4~6叶期青贮玉米心叶中下部,采用离体划伤法进行接种,用于接种的3种青贮玉米品种分别为金皇828、铁研53号和中单2号。每株菌重复接种3个叶片,每个叶片均匀划伤2处,在划伤处接种10μL孢子悬浮液,以接种无菌水为对照,重复3次。25℃黑暗保湿培养24 h,之后25℃光照培养5~7 d,观察青贮玉米叶片的发病情况。叶片发病严重度等级划分标准:0级:无可见病斑;1级:病斑<0.10 cm;3级:0.10 cm<病斑<0.25 cm;5级:0.25 cm<病斑<0.5 cm;7级:0.5 cm<病斑<1 cm;9级:1 cm<病斑。

致病力情况:病情指数为0,不致病;病情指数为0~45,弱致病力;病情指数为45~75,中等致病力;病情指数为75~100,强致病力。
2 结果与分析
2.1 青贮玉米链格孢叶枯病病原菌种类
从4个采样地共分离得到177株病原菌,其中从尖扎县、田家寨镇、民和县和大通县分别分离得到19、57、38和63株菌株。结合菌落形态特征、分生孢子形态特征和菌株rDNA-ITS序列比对和分析,177株病原菌均为链格孢属真菌。按序列相似性大于97%的菌株归于同一个种的规则[31],交链格孢(Alternaria alternata)、Alternaria sp、极细链格孢(A.tenuissima)和致密链格孢(A.compacta)个数最多,分别为50、38、31和27株,分离率分别为28.2%、21.5%、17.5%和15.2%。其次为芸薹链格孢(A.brassicae)、狭卵链格孢(A.angustiovoidea)、茄链格孢(A.solani)、A.tamaricis、香葱链格孢(A.porri),分别为9、7、5、5和2株,分离率分别为5.1%、4.0%、2.8%、2.8%和1.1%。乔木链格孢(A.arborescens)、A.quercicola和A.infectoria菌株个数最少,均为1株,分离率均为0.6%(图1)。不同种的菌落形态和分生孢子形态特征存在差异,如图2所示,菌株JZYM-2与A.infectoria的序列相似性为99.47%,该菌株菌丝较为发达,呈浅青黄色,分生孢子略呈黄色,横、纵格明显。菌株TJZYM-I与交链格孢的序列相似性为99.45%,该菌株菌丝发达,呈棕黑色,分生孢子横、纵格明显,孢体较大。菌株JZYM-14与茄链格孢的序列相似性为99.62%,该菌株菌丝淡青色,生长缓慢,分生孢子呈浅黄褐色且横、纵格明显,孢体较长。
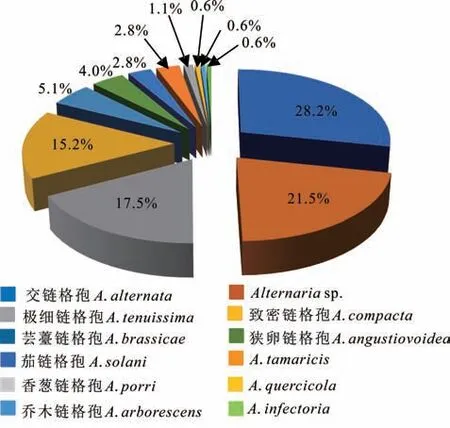
图1 青贮玉米链格孢叶枯病病菌的种类及其分离率Fig.1 Species and separation rate of the pathogens associated with Alternaria leaf blight in silage maize

图2 青贮玉米链格孢叶枯病病原菌代表菌株菌落形态和分生孢子形态Fig.2 Colony and conidium morphology of represent pathogens associated with Alternaria leaf blight in silage maize
2.2 青贮玉米链格孢叶枯病病原菌rDNA-ITS序列分析
根据形态特征和rDNA-ITS序列分析结果,合并形态和序列相同的菌株,选取52株代表菌株,将所测得代表菌株的rDNA-ITS序列在GenBank中与已知的rDNA-ITS序列进行BLASTs相似性比较分析,以已在NCBI公布rDNA-ITS序列的19株菌株作为参考菌株,构建系统发育树,以确定菌株的分类地位(图3)。从系统发育树可以看出,共计71株菌株以大于等于88.00%的支持率被分为11个分支。菌株JZYM-4、TJZYM-344、和JZYM-18等8株菌株与交链格孢(A.alternata)在同一个发育分支上,亲缘关系最近,rDNA-ITS序列相似性均大于99.00%;菌株JZYM-14和TJZYM-117等4株菌株与茄链格孢(A.solani)在同一发育分支上,亲缘关系最近;菌株JZYM-23、DT 18123-A和DT 1855-A与A.tamaricis在同一发育分支上,亲缘关系最近;菌株DT 1810-B和DT 18137-B与香葱链格孢(A.porri)在同一发育分支上,亲缘关系最近,rDNA-ITS序列相似性均大于99.00%;菌株JZYM-2、JZYM-3和DT 1824-B分别与A.infectoria、A.quercicola和乔木链格孢(A.arborescens)在同一个发育分支上,亲缘关系最近,rDNA-ITS序列相似性分别为99.47%、99.82%和99.07%。
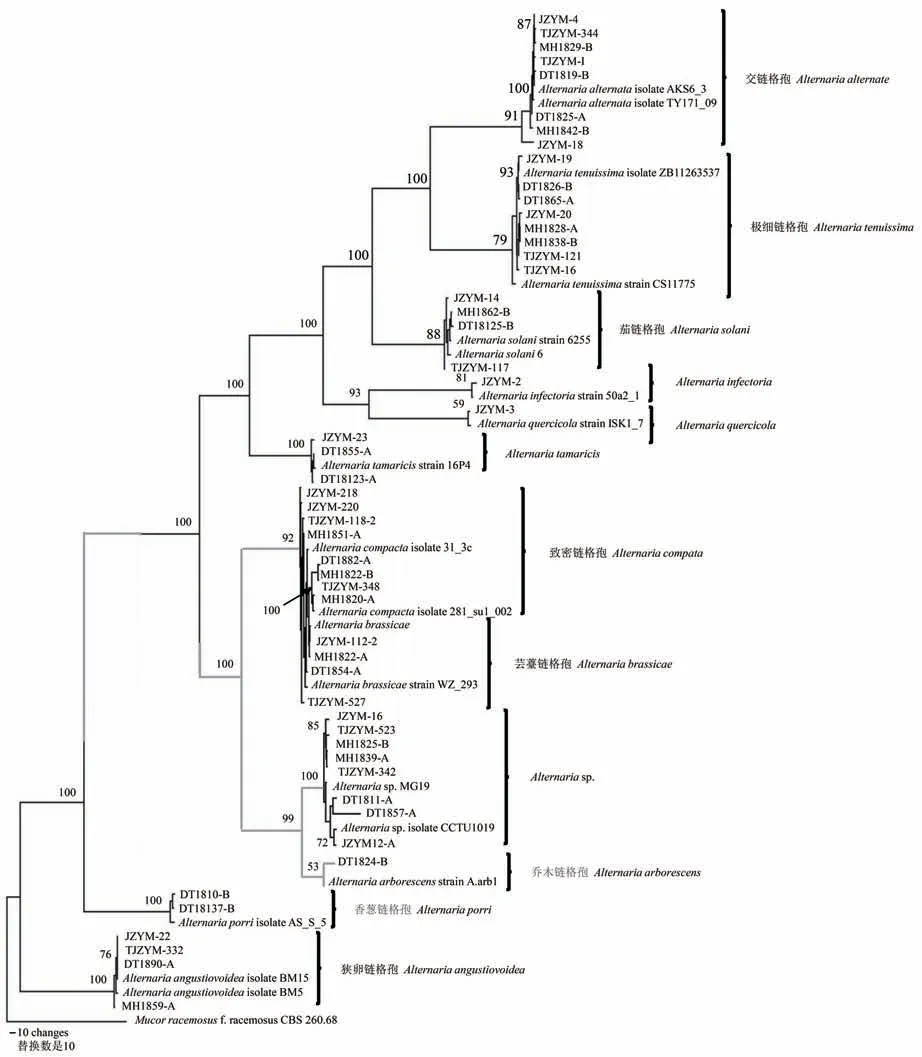
图3 52株青贮玉米链格孢叶枯病病原菌代表菌株基于r DNA-ITS序列构建的系统发育树Fig.3 The plylogenetic tree of represent pathogens associated with Alternaria leaf blight in silage maize was inferred from r DNAITSsequences
2.3 青贮玉米链格孢叶枯病病原菌致病力分析
采用离体叶片划伤接种法对155株链格孢叶枯病病菌致病力进行测定,共测定了这些菌株对金皇828、铁研53号和中单2号3种青贮玉米的致病力。接种后发病病斑与田间发病症状一致,呈椭圆形、近圆形水渍状病斑,病健交界明显。接种发病病斑经保湿培养36 h后,用10×光学显微镜能观察到分生孢子和菌丝形态,从发病病斑分离得到的菌株与野生型菌株菌落形态一致(图4)。
接种结果表明155株病原菌都可以侵染这3种青贮玉米,但是菌株致病力存在差异。如大通分离菌株DT 18131-B接种铁研53号、金皇828、中单2号后病情指数分别为85.19、97.53和82.72,该菌株致病力强;民和分离菌株MH 1862-B接种这3个品种后病情指数分别为62.96、65.43和63.10,该菌株致病力中等;尖扎分离菌株JZYM-218接种这3个品种后病情指数分别为40.74、23.46和24.07,该菌株为弱致病力。大部分菌株对这3种青贮玉米的致病力存在差异,如民和分离菌株MH 1829-B对铁研53号致病力很强(病情指数为82.72%),对金皇828和中单2号的致病力依次减弱(病情指数分别为67.90和37.78)(图4,表2)。155株菌株接种铁研53号、金皇828和中单2号后强致病力菌株分别有68、69和64株;中等致病力菌株分别有56、60和58株;弱致病力菌株分别有31、26和33株(图5)。
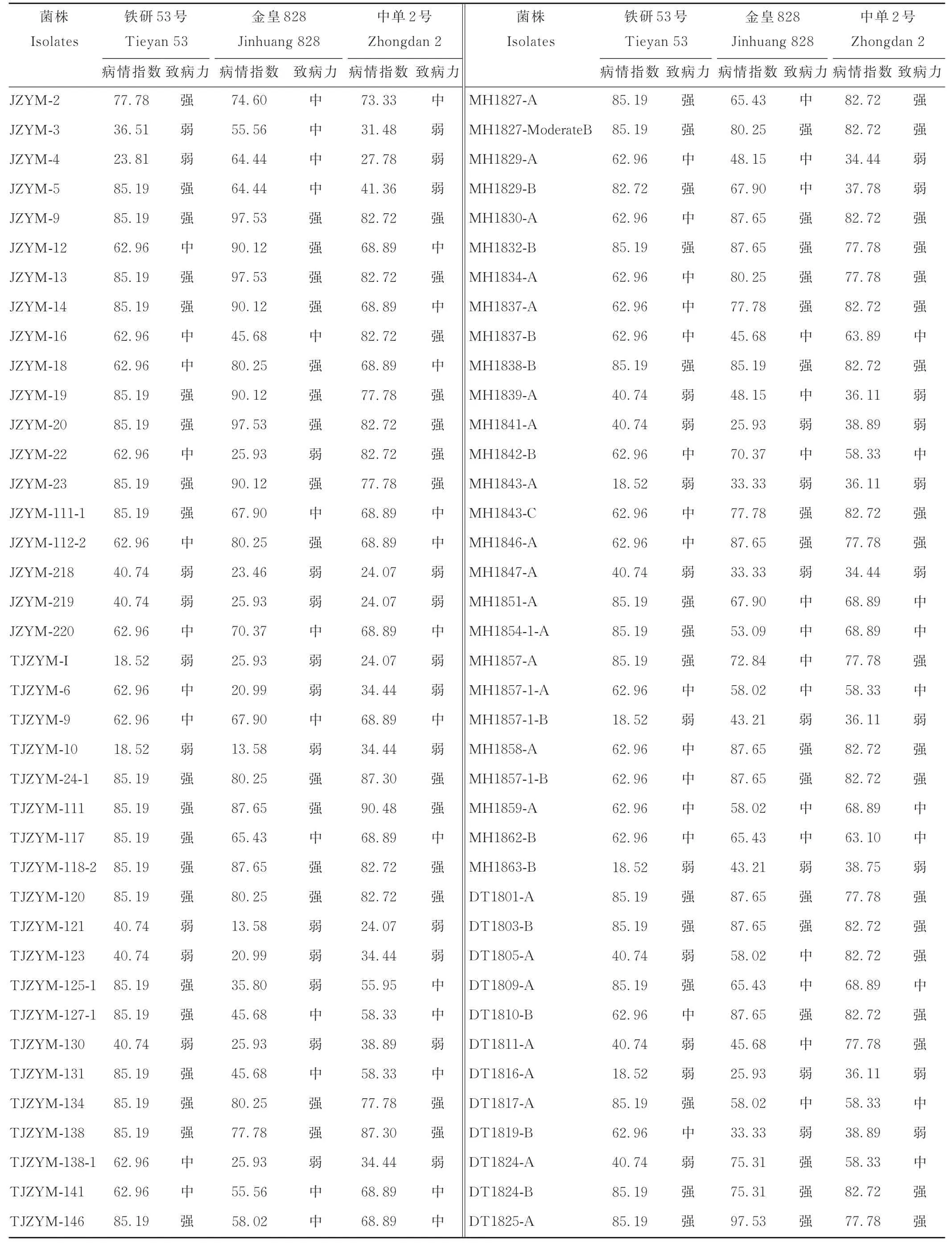
表2 病原菌接种青贮玉米病情指数和致病力分析Table 2 Pathogenicity analysis of pathogens associated with Alternaria leaf blight in silage maize
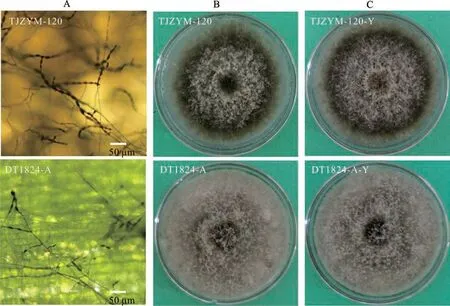
图4 青贮玉米链格孢叶枯病病原菌科赫氏法则验证Fig.4 Verification of Koch’s postulate of the pathogens associated with Alternaria leaf blight in silage maize
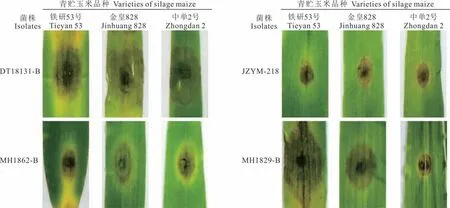
图5 青贮玉米链格孢叶枯病的代表病原菌接种Fig.5 Inoculation of r epresent pathogens associated with Alternaria leaf blight in silage maize

续表2 Continued Table2
3 讨论
已有研究表明近十年来,我国玉米病害除了大斑病、小斑病和灰斑病外,新发生的病害链格孢叶枯病也日趋严重[26]。本研究通过对分离得到的青贮玉米叶部病害病原菌的鉴定发现,链格孢属为病原菌优势属,而平脐蠕孢属(Bipolaris)和弯孢属(Curvularia)数量很少(数据未列出)。因此结合前期田间症状观察和后期对病原菌的分类鉴定,发现青海省青贮玉米叶部病害中链格孢叶枯病最为严重。4个采样点的海拔高度、土壤类型、平均气温、年均降水量和种植背景都存在差异,因此对177株菌株的研究结果可以反映青海省青贮玉米链格孢叶枯病病原菌的整体情况。
链格孢属真菌存在共同侵染现象,2019年,Rajarammohan等[32]报道2株交链格孢菌株(A.alternata)和1株芸薹链格孢菌株(A.brassicae)可以共同侵染油菜(Brassica napus)。2016年,Hou等[33]报道长柄链格孢(A.longipes)和交链格孢(A.alternata)可共同引起烟草(Nicotiana tabacum)褐斑病。2019年,Ayad等[34]报道,茄链格孢(A.solani),A.protenta,A.grandis和A.linariae可共同引起阿尔及利亚马铃薯(Solanum tuberosum)和番茄(Lycopersicon esculentum)早疫病。本研究也发现青贮玉米链格孢叶枯病是由多种链格孢属真菌共同侵染造成的,青贮玉米链格孢叶枯病病原菌菌落和孢子形态多样,交链格孢(A.alternata)、Alternaria sp、极细链格孢(A.tenuissima)和致密链格孢(A.compacta)为病原菌优势种。
对155株病原菌致病力的测定结果表明,病原菌存在致病力分化现象。已有研究报道表明链格孢属真菌存在致病力分化现象,如2010年郑寰宇[35]对马铃薯早疫病菌(A.solani)的研究和2013年邵旭平等[36]对甘肃省苹果(Malus domestica)链格孢叶斑病病原苹果链格孢(A.mali)进行研究时都发现了这一现象。青贮玉米叶片接种发病后病斑呈现萎蔫、水浸状、褪绿、坏死等症状,推测病原真菌毒素在致病过程中起到重要作用。
4 结论
2018-2019 年,通过2年的实地调查发现,青贮玉米链格孢叶枯病在青海本地普遍发生,本研究对177株病原菌进行了初步鉴定,为后续开展病害防治和流行学研究等提供了基础。用于致病力测定的3种青贮玉米品种铁研53号、金皇828和中单2号对链格孢叶枯病病原菌的抗性较差,因此后续进行抗性品种的选育工作对于防治该病害至关重要。
