AccuContour软件在头颈部危及器官自动勾画中的应用研究
2021-06-25李金凯王沛沛曹远东李彩虹昌志刚顾霄寰李丹明孙新臣
李金凯,王沛沛,曹远东,李彩虹,昌志刚,顾霄寰,李丹明,孙新臣
江苏省人民医院/南京医科大学第一附属医院 放疗科,江苏 南京 210029
引言
精确勾画肿瘤靶区和危及器官(Organs at Risk,OARs)是实现精准放射治疗的根本保障[1-2]。现阶段,肿瘤靶区和OARs的轮廓线勾画主要由经验丰富的临床医生手动完成,但人工勾画耗时较长效率较低,且极度依赖勾画医生的临床经验,在不同医生或不同患者之间勾画结果存在较大差异。因此,临床工作中特别期待有智能的、快速的自动分割算法来实现肿瘤靶区和OARs的自动勾画。目前,临床上应用较多的主要是基于图谱库(Atlas)的自动分割软件[3-4],其勾画精度主要取决于目标图像和Atlas之间的相似性。鉴于人体解剖多样性和形变配准精度的限制,基于Atlas自动分割的轮廓常常需要大量的人工修正。近年来,人工智能(Artificial Intelligence,AI)尤其是机器学习、深度学习等AI技术在医疗领域取得了巨大进步,在疾病诊断、病灶识别和分割等方面均表现出巨大的应用潜力[5-8]。
AccuContour精确自动勾画软件是由Manteia(中国)公司研发的一种基于多种神经网络结构和深度学习算法的自动勾画工具,用于在CT图像上绘制放射治疗计划所需的全身60多个OARs自动勾画,以及数个癌种的GTV自动勾画。本研究利用基于AI技术的自动勾画软件AccuContour对头颈部位的OARs进行智能勾画,评估其勾画的准确度及适用性,为正式投入临床应用提供理论参考。
1 材料与方法
1.1 一般资料
选取2019年6月至2020年1月在南京医科大学第一附属医院(江苏省人民医院)行放射治疗的10位鼻咽癌肿瘤患者,年龄28~71岁,中位年龄53岁;男性8例,女性2例;根据中国鼻咽癌分期2017版[9],其中T1-2期6例,T3期3例,T4期1例;卡氏评分≥80。所有患者均取仰卧位,双手自然下垂紧贴于身体两侧,利用CIVCO头颈肩板配合S型热塑面膜固定。大孔径CT模拟机(Siemens SOMATOM Sensation Open,德国)自由呼吸状态下行螺旋扫描,扫描范围自头顶至气管隆突水平,重建层厚和层间距均为3 mm。
1.2 自动勾画软件
AccuContour软件通过深度学习图像分割模型,对大量的专家勾画数据进行学习,实现对目标图像的自动分割和轮廓绘制;在模型训练中,采用多种网络结构模型、多种loss结构进行融合,以提高勾画精度;在模型训练之前,通过收集多数据源、多病种的医院临床数据,按照国内外靶区及OARs勾画标准,通过多名高年资医生进行标注,在通过检验达到临床一致性要求后,纳入标准库中。OARs勾画精度内部测试结果为:DSC[10]0.9~0.95;HD[10]≤3.5 mm。本研究选取头颈部OARs 18种,其中,左右对称结构8种,分别是眼球(Eye)、晶体(Lens)、视神经(Optic nerve)、颞颌关节(Temporomandibular Joints,TMJ)、颞叶(Temporal lobe)、中耳(Middle ear)、内耳(Inner ear)、腮腺(Parotid);独立结构10种,分别是脑(Brain)、脑干(Brain stem)、脊髓(Spinal cord)、视交叉(Optic chiasm)、垂体(Pituitary)、下颌骨(Mandible)、口腔(Oral cavity)、喉(Larynx)、气管(Trachea)、甲状腺(Thyroid)。
1.3 正常组织勾画
将模拟定位CT影像传输至AccuContour工作站勾画OARs,为方便后续描述,命名为RTs1,然后在多模态图像处理工作站MIM Maestro软件(Cleveland,美国)上由2名高年资医师根据CT-MR图像融合结果进行二次修改和确认,命名为RTs2,最后利用MIM Maestro自带的“比较勾画”工具评价自动勾画的准确度。其中,参考MR图像选择轴位T1、T2加权像,FOV 24 cm×24 cm,矩阵256×256,层厚5 mm,层间距0。勾画标准参考国际辐射防护与测量委员会第62号报告和中国鼻咽癌放射治疗协作组OARs勾画共识[11-12]。为评估勾画软件AccuContour自动勾画的稳定性和重复性,对10例患者的模拟CT进行OARs的二次勾画,命名为RTs3。
1.4 自动勾画质量评估
通过RTs2组评估RTs1组OARs自动勾画的准确度,通过RTs3组评估RTs1组OARs自动勾画的重复性。评价指标[10]包括:豪斯多夫距离(Hausdorff Distance,HD),平均最小距离(Mean Distance To Agreement,MDA),戴斯相似性系数(Dice Similarity Coefficient,DSC)。
1.4.1 HD
HD用来描述两个轮廓之间的距离,即参考轮廓中的每个体素到对照轮廓中最近点的最大距离,计算如公式(1)所示。
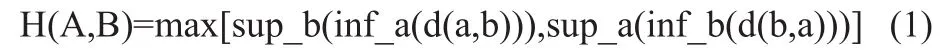
如公式(1)所示,A、B为空间中的两个点集,此处代表所勾画的轮廓,a∈A,b∈B,HD数值越接近于0,表明两个勾画轮廓之间的差别越小。
1.4.2 MDA
MDA与HD类似,用来描述两个轮廓之间的距离,具体含义是所考虑的轮廓中的所有外围点必须移动以实现与参考轮廓完全重叠一致所需的平均最小距离,计算如式(2)所示。

与公式(1)相同,A、B为空间中的两个点集,此处代表所勾画的轮廓,a∈A,b∈B,MDA数值越接近于0,表明两个勾画轮廓之间的差别越小。
1.4.3 DSC
DSC用于描述两个轮廓的相似性,计算如公式(3)所示。
如公式(3)所示,VA表示自动勾画轮廓的体积,VB表示医生修改确认后勾画轮廓的体积,DSC值越接近于1,表明两样本轮廓之间形状相似性越大。
1.5 统计学分析
采用SPSS 20.0对OARs勾画结果进行统计学分析,计量资料以(±s)表示。对RTs1组与RTs2组的HD、MDA及DSC结果与RTs2组的OARs体积行Spearman相关性分析,P<0.05表示具有统计学意义。
2 结果
2.1 自动勾画的准确度
10例患者共得到260个OARs的轮廓数据。如表1所示,RTs1组与RTs2组HD值最大的OARs是脑,均值为10.1 mm,其中小于5 mm的有19个,占73.1%(19/26)。MDA值最大的OARs是视交叉,均值为1.0 mm,其余均值都小于1 mm,占96.2%(25/26)。DSC最小的OARs是视交叉,均值为0.66,其余均值都大于0.85,占96.2%(25/26),其中大于0.9的OARs有脑、颞叶、眼球、晶体、颞颌关节、内耳、中耳、腮腺、脑干、脊髓、下颌骨、口腔、喉、气管、甲状腺等,占84.6%(22/26)。相关性分析显示,HD与RTs2组OARs体积大小存在中等程度正相关(r=0.191,P<0.01),MDA、DSC与OARs体积无明显相关性(r=0.065、0.029,P>0.05)。

表1 RTs1组与RTs2组OARs勾画准确度的比较评估
某一病例的OARs自动勾画与人工修改结果如图1所示。其中,HD值>5 mm的器官有颞叶、脑、口腔,>3 mm的器官有腮腺、脑干、视神经;MDA值均<0.5 mm,颞叶最大为0.348 mm;DSC值<0.9的器官有垂体、视神经和视交叉,余均 >0.9。
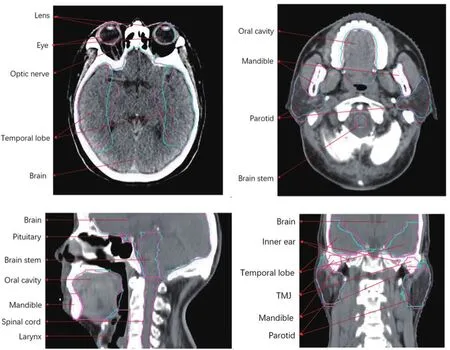
图1 某例鼻咽癌患者OARs自动勾画与人工修改CT图像示例
2.2 自动勾画的重复性
RTs1组与RTs3组每例患者每个OARs的勾画体积大小完全一致。RTs1组与RTs3组各OARs的HD值及MDA值均为0,DSC均为1。
3 讨论
随着精确放疗技术的发展,高剂量曲线与靶区形状高度一致,在不增加周围正常组织器官受照剂量的同时进一步提高了靶区剂量,为放疗疗效的提高奠定了物理基础[13]。患者的长期生存使得对生活质量的要求不断提高,正常组织器官的放疗并发症,如早期急性黏膜反应和晚期颅内神经损伤、颞叶坏死、下丘脑-垂体轴的毒副作用等神经系统症状,因严重影响患者的生存质量而越来越多地受到临床重视[14-15]。如何评估OARs的实际照射剂量,以及如何减少其受量,是当前临床实践中亟需解决的问题,也是当前研究的热点。
头颈部放疗中OARs受照剂量的评估存在不确定性,其中最主要的影响因素就是OARs勾画的差异性。具体分析,差异性主要来源于两个方面,首先是参考指南理解偏差[16],即操作人员对OARs勾画范围边界的理解不一致;其次是人为实践操作的差异,即同一操作者在不同时间或不同地点勾画同一病例OARs之间的偏差。针对第一方面的差异,最直接的办法是建立统一的OARs勾画指南。例如孙颖等[17]根据OARs解剖特点和放射损伤原理建议:颞叶勾画范围应该包括海马和海马旁回,除外脑岛和基底节区域;腮腺需要勾画完整的腮腺组织;脊髓需要勾画CT上实际的脊髓而非椎管等。关于第二方面的差异,属于手工操作误差,很难通过制定规范或加强训练得到完全改善。一些OARs勾画软件,如瑞典Elekta公司的ABAS、美国Varian公司的Velocity及美国MIM公司的Maestro等,试图通过机械设备取代手工操作以修正人为实践操作所引入的偏差。根据既往研究,基于Atlas的OARs自动勾画DSC指数大多数都与体积大小有相关性,针对较大体积的OARs,如脑干、脊髓、下颌骨等,DSC指数普遍相对较高,基本都大于0.85[18]。相反,针对一些小体积OARs,如晶体、视神经、垂体等,DSC指数都小于0.7。与Atlas方法相比,国内外很多文献报道基于深度学习的轮廓自动分割方法拥有更高的精确度和更短的耗时[19]。Tong等[20]将完全卷积神经网络(Convolutional Neural Networks,CNN)与形状表示模型相结合,提高了分割的准确性和鲁棒性,与现有方法相比,分割多器官的时间更短。Wu等[21]提出了自动解剖识别方法,结果表明在条纹伪影最小(<4层)及其他偏差的数据集上,总体识别精度达到2个体素,总体DSC值接近0.8,HD值在1个体素内。Men等[22]提出的CNN级联方法在每个OARs的勾画精度上都优于单一的CNN方法,平均DSC值可达0.90,平均HD<3 mm,同时,CNN级联将每个患者的平均分割时间分别减少了48%(FSU)和5%(U-Net)。本研究结果显示AccuContour软件对头颈部OARs自动勾画具有非常高的准确度和重复性,DSC值高于0.85的结构比例大于95%,基本避免了人为操作所引入的实践误差。与此同时,本研究还显示基于深度学习的轮廓自动分割方法其DSC、MDA与OARs体积大小无明显相关性,即对晶体这种小体积的OARs,DSC指数也都可以大于0.9,这非常好地体现了AI技术所带来的技术优势。
本研究的局限性在于OARs自动勾画结果基于CT图像取得,虽将MR图像作为标准参照,但不可避免会降低勾画的准确度,获取实体组织进行验证会更加可靠。同时,本研究患者样本量偏小,且研究结果在一个放疗中心取得,也会增加本研究的不确定性。需要强调的是,基于AI技术的OARs自动勾画也存在一些问题和安全隐患。例如本研究中视交叉的勾画,其与RTs2组的DSC指数均值低于0.7,究其原因是由于AccuContour软件的图像分割模型与我科现行的头颈部OARs勾画标准不同所致。综上可见,基于AI的自动勾画是当前放疗技术的发展趋势,AccuContour软件在头颈部OARs的自动勾画中具有较高的准确性和良好的重复性,可减少放疗医师工作量,提高OARs工作效率,有利于将医生从OARs勾画这项繁琐的工作中解放出来。
致谢
感谢MANTEIA公司祝永进、谢璐和MIM Software公司李杨杨工程师给予的技术支持。
