新辅助化疗后乳腺癌组织电阻抗特性测量方法及测量平台研究
2021-06-25王瑞青张伟徐帆史学涛刘本源季振宇
王瑞青,张伟,徐帆,史学涛,刘本源,季振宇
1.解放军陆军第82集团军医院 医学工程科,河北 保定 071000;2.空军军医大学 军事生物医学工程学系,陕西 西安 710032
引言
乳腺癌是全世界女性最为常见的恶性肿瘤,其发病率和死亡率呈逐年升高的态势[1]。乳腺癌新辅助化疗(Neoadjuvant Chemotherapy,NAC)是对乳腺癌患者手术前进行的一种系统性的化学药物治疗[2]。NAC不仅可以缩减肿瘤大小,降低肿瘤分期,更重要的是人们可以根据其实际疗效有望实现精准用药[3-4]。目前临床上用于NAC疗效评价的影像技术主要有乳腺X线钼靶、超声、MRI等,虽然它们在很大程度上提高了疗效评估的准确度,但也存在各自的局限性。乳腺电阻抗扫描(Electrical Impedance Scanning,EIS)成像技术是一种无创便捷、无辐射的功能成像技术,对乳腺癌组织功能状态信息和癌灶区供血状态变化信息具有检测敏感的优势[5-6],为乳腺癌NAC疗效评价提供了新思路。研究NAC作用后乳腺癌组织的电阻抗特性可为乳腺EIS成像技术应用于NAC疗效评价提供数据支持和生物物理学基础,具有重要的研究价值。
另外,生物组织电阻抗特性是组织在电磁场作用下的固有属性,携带了大量的生理和病理信息[7]。国内外各研究小组对于乳腺组织阻抗特性的研究已经较为深入:早在1926年,Fricke等[8]测量了乳腺癌组织及癌周组织的阻抗特性;此后,各研究小组对正常乳腺组织、良性肿瘤组织和恶性肿瘤组织进行了阻抗测量[9-10],结果表明:在各自的测量频段内,与正常乳腺组织(腺体除外)和良性肿瘤组织相比,癌组织一般具有更高的电导率和相对介电常数。然而,目前尚未见到NAC后乳腺癌组织阻抗特性的系统研究。而由于NAC的有效作用和微创手术的趋势会导致经手术获取的乳腺癌组织样本尺寸多数较小,可用于电阻抗测量的甚至是一些病理学检查余下的边角料[11];有一些学者建立了乳腺癌动物模型,并开展了NAC作用下癌灶区变化的研究[12-13],但因接种细胞的活性、化疗药物的作用等的综合影响,导致实验得到的乳腺癌组织样本的长径多数在5~10 mm之间。因此,若要对NAC作用后乳腺癌组织进行电阻抗测量,则需研究适用于小体积(长径介于5~10 mm)生物组织的电阻抗测量方法与测量装置。
本研究从搭建测量平台入手,建立了一套完善的适用于小体积生物组织的电阻抗测量研究方法,以期为实现对NAC作用后乳腺癌组织的电阻抗测量提供理论基础和平台基础。
1 小体积生物组织阻抗测量系统的建立
1.1 测量方法的选定
生物组织的阻抗特性具有频率依赖性,而100 Hz~100 MHz频段是生物组织发生α弛豫和β弛豫的频率范围,可显著地反映生物组织的结构和病生理特性[14]。因此研究此频段内的阻抗特性对于深入认识NAC作用后乳腺组织的生物物理学特性具有重要的意义。目前适用于此频段的阻抗测量方法主要有终端同轴测量[15]、二电极法[16]和四电极法[17]等,但各自又存在各自的优势与局限性。
终端同轴测量法能够实现超宽频段内的组织阻抗特性测量,在无创、在体测量上有着巨大的优势,但是其要求待测组织样本的尺寸在10 mm以上、厚度在5 mm以上。二电极法,即通过两个电极施加电流作用于待测组织样本,同时仍通过这两个电极获得电压差的测量方法。该方法测量原理简单,且能够用于测量长径在10 mm以下的组织样本,但由于其在较低频段(一般在kHz以下)产生的电极极化和电极与被测组织间的接触阻抗的影响,会产生难以避免的测量误差。四电极法包含两对电极,其中一对电极(激励电极)施加电流进入待测组织样本,同时另一对电极(测量电极)位于两激励电极之间,测量得到待测部位的电位差。该方法虽然能够较好地解决较低频段(kHz以下)的电极极化和接触阻抗等问题,但在较高频段(1~100 MHz)下分布在引线上的杂散电感和电容又会对测量结果产生较大的影响。
由此,本研究综合考虑测量的实际需求和各测量方法的优势与局限性,选取二电极法作为NAC作用后乳腺癌组织电阻抗特性的测量方法。
1.2 测量平台的建立
本研究所建立的阻抗测量平台主要由容量可调的圆筒形测量盒、阻抗分析仪和温度控制系统组成,总体框图如图1所示。

图1 阻抗测量平台框架图
1.2.1 容量可调的圆筒形测量盒
考虑到获得的NAC作用后乳腺癌组织样本的大小不一且长径多在5~10 mm之间,同时为了避免小体积组织样本因不必要剪裁而产生的损耗,我们自行设计了容量可调的生物组织电阻抗特性测量盒(以下简称测量盒)如图2所示。测量盒主体(图2a中II)采用有机玻璃制成,中间有一直径为3 mm、长度为12 mm的,用于放置待测组织的圆柱形空腔;测量盒两侧为测量盒盖(图2a中I),测量盒盖上镶嵌有银质圆片状电极(图2a中III),直径为10 mm,厚度为0.5 mm,其中一侧测量盒盖上的银质圆片状电极与一同为银质材料的圆柱形连接杆(图2a中IV),直径3 mm,长12 mm相连。当两侧测量盒盖扣紧于测量盒时,银质圆柱形连接杆与两侧的银质圆片状电极紧密接触。
实际测量过程中,将获得的组织样本适当修剪为直径3 mm的圆柱形长条,随后装入测量盒内,移动连接杆以推动组织样本向另一侧移动,直至组织样本与另一侧的银质圆片状电极紧密接触,此时利用游标卡尺测量得到测量盒盒体外侧到测量盒盖内侧的距离L,即为装入测量盒内的组织样本的测量长度,详见图2b。
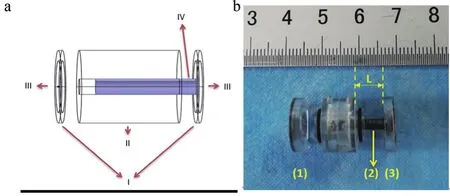
图2 测量盒示意图和实物图
1.2.2 阻抗分析仪
阻抗分析仪选用美国安捷伦公司的4294A型精密阻抗分析仪。该分析仪基于自动平衡电桥原理,可对待测组件进行高精度、高效率的阻抗测量和分析,其在100 Hz~110 MHz频段内的基本阻抗精度可达到±0.08%。在实际测量过程中,该分析仪通过配套的测量端子适配器和测试夹具16092A与装载待测组织样本的测量盒相连(图3),从而避免了高频下导线带来的测量误差。

图3 Agilent 4294A阻抗分析仪系统
1.2.3 温度控制系统
为了保持待测组织样本的生物活性、减小测量误差,本研究选用婴儿培养箱作为待测组织样本的温度控制装置如图4所示。

图4 温度控制系统
1.3 数据的分析与处理
生物组织的电阻抗特性参数主要包括电导率σ和相对介电常数εr。生物组织电阻抗可以写成公式(1)复阻抗形式[18]:

其中,Re和Im为实际测量得到的阻抗实部和虚部,也可以写成公式(2)的复导纳形式:

通过公式(1)~(2),可以得到生物组织的电导率和相对介电常数,见公式(3)~(4)。
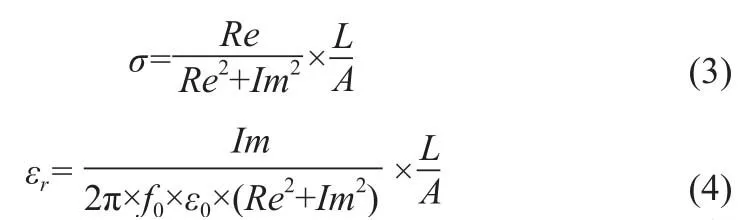
其中,f0为激励信号频率,ε0=8.85×10-12F/m为真空介电常数,L为待测组织测量长度,A为待测组织横截面积。
2 测量平台的测试
在阻抗测量领域,研究者一般使用NaCl溶液等对测量装置进行标定[19]。由此,本研究首先使用了不同浓度的NaCl溶液对测量平台的准确度和精度进行测试。然后利用该平台对离体后的乳腺癌组织与癌周组织进行电阻抗测量,以进一步验证测量平台的可行性。
2.1 梯度浓度的NaCl溶液测量
选用浓度分别为0.01、0.03、0.05、0.07、0.09、0.12、0.15和0.18 mol/L的NaCl溶液,这个浓度范围内的NaCl溶液的电导率与文献报道的乳腺癌组织的电导率[20-21]接近。准确度验证时,固定样品(NaCl溶液)长度为5 mm,测量不同浓度下NaCl溶液的电导率,并与Peyman等[22]研究提出的NaCl溶液的电导率理论值(表1)进行对比;测量精度验证时,固定NaCl溶液的浓度,通过改变样品长度L(4、6、8、10、12 mm),对系统的精度进行测试。每种条件下均测量5次,并取平均值作为每种条件下的测量值。最后根据测量值和理论值的相对误差,来分析验证测量方法的准确度和测量精度。

表1 不同浓度下NaCl溶液电导率的理论值
2.2 乳腺癌组织和癌周组织的电阻抗测量
研究对象:荷人乳腺癌的BALB/c裸鼠。其中,人乳腺癌细胞系选用T47D细胞,接种部位为裸鼠的腹股沟皮下。电阻抗测量:将裸鼠采用颈椎脱臼法逐一处死,迅速取出乳腺癌组织与癌周组织,并经简单裁剪后装入测量盒,随后使用前述测量平台测量得到不同频率下的组织样本的电阻值R和电抗值X(图5),最后根据1.3中介绍的方法计算得到对应的电导率和相对介电常数。

图5 裸鼠处死后取样
3 结果
3.1 梯度浓度的NaCl溶液测量结果
利用不同浓度的NaCl溶液对本研究建立起的测量方法准确性的验证结果如图6所示。从图6a中可以看出,在100 Hz~100 MHz频段内,测量NaCl溶液得到的电导率与理论值的相对误差(绝对值)最大出现在0.01 mol/L处(8.2%);相对误差(绝对值)随着NaCl溶液浓度的上升而快速下降;当NaCl浓度上升到0.09 mol/L时,相对误差(绝对值)降至1.7%,最后趋于平坦。NaCl溶液浓度较低(小于0.05 mol/L)时,测量结果的相对误差(绝对值)偏大,这可能是由于当NaCl溶液浓度较低时,溶液自身的电导率数值过小,所以即使是因浓度偏差、测量误差产生的数据浮动不大也会导致相对误差(绝对值)较大。从图6b中可以看出,当NaCl溶液浓度固定时,相对误差随着样品长度的增加而逐渐减小,但均在5%以内;当样品长度为6 mm时,随着NaCl溶液浓度从0.03 mol/L升至0.12 mol/L,相对误差从3.7%降至2.3%。
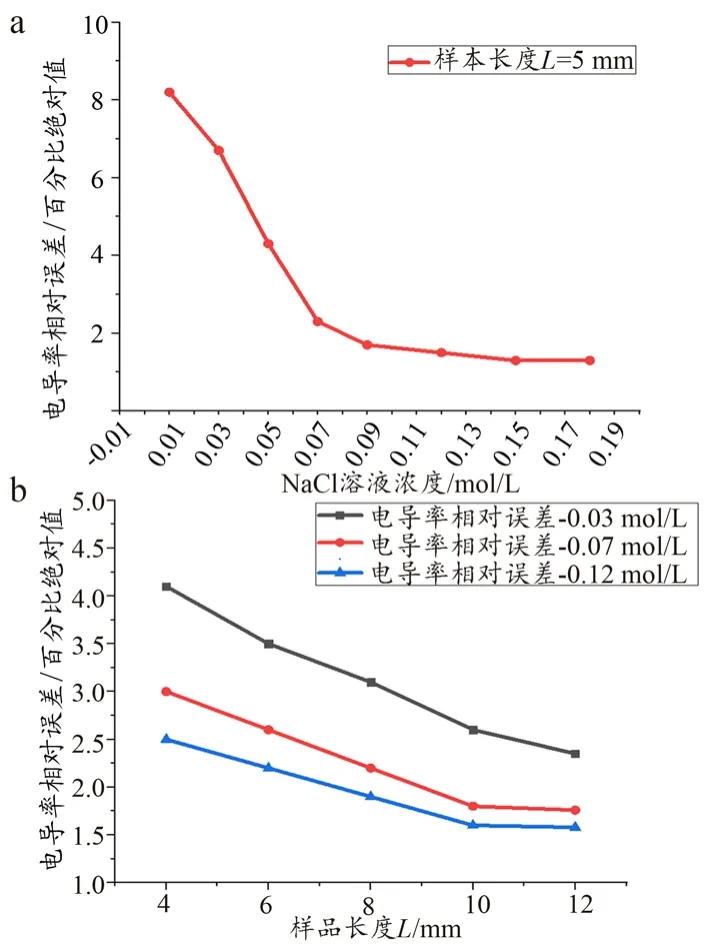
图6 测量方法准确性的验证结果
3.2 乳腺癌组织与癌周组织电阻抗测量结果
图7描述了乳腺癌组织与癌周组织的电阻抗特性随频率的变化。从图7a中可以看出,癌组织与癌周组织的电导率均随着频率的增加而增加;癌组织与癌周组织的电导率比值在 100 Hz~1 MHz 频段内为 4.3~9.4,而在 1 MHz~100 MHz频段内则为2.2~4.2。图7b表明,癌组织与癌周组织的相对介电常数均随着频率的增加而逐渐减少;在所测频段内,癌组织与癌周组织的相对介电常数的比值为3.0~6.3。

图7 乳腺癌组织与癌周组织的电阻抗特性随频率的变化曲线
4 讨论与结论
考虑到实验环境的温度和湿度会对生物组织的电阻抗特性产生影响[23-24],本研究通过温湿度控制系统将实验环境的温度控制在37 ℃,湿度控制在90%,最大程度上减少了温湿度对测量结果的影响。
NAC的有效作用和微创手术的趋势会导致经手术获取的乳腺癌组织样本尺寸多数较小,而100 Hz~100 MHz频段是生物组织发生α弛豫和β弛豫的频率范围,包含了大量的病生理信息。由此,针对小体积生物组织样本和宽频段的电阻抗测量这一问题,Hesabgar等[25]提出了一种用于在低频下(100 Hz~1 MHz)测量小鼠异种移植模型的体外组织样品阻抗特性的测量方法,并建立了相应的测量装置。但是,该装置的测量电极为铜质电极,相比于银质电极,其电极极化效应更加显著[26];此外,该装置包含一定长度的导线,而分布导线上的杂散电感和电容则限制了其在较高频段(1~100 MHz)的使用。本研究设计了可以装载小体积生物组织(长径介于5~10 mm)的容量可调的圆筒形测量盒,并基于二电极法搭建了测量平台。对比以上设计,本研究具有以下优势:测量盒采用滑竿式的设计,减少了小体积组织样本因不必要剪裁而产生的损耗;测量电极选用导电性能良好的银质电极,在一定程度上减少了电极极化效应对测量结果的影响;在实际的测量过程中,我们将测量盒经适配器和配套的夹具与阻抗分析仪直接相连,避免了导线的使用,从而在一定程度上减少了较高频段下导线上的分布电容和杂散电感对测量结果的影响。本研究对测量平台的精准性和可行性的测量结果表明,该平台可实现100 Hz~100 MHz频段内、长度为5~10 mm的小体积生物组织阻抗特性的准确测量,进而为后续进行NAC后乳腺癌组织电阻抗特性的测量和计算提供了平台和理论基础。
