副猪嗜血杆菌sodA基因的表达及其理化性质
2021-06-25胡基雄李国攀
胡基雄,王 席,李国攀,荣 俊
(1.长江大学生命科学学院,湖北 荆州 434025;2.荆州长新生物有限公司,湖北 荆州 434025)
副猪嗜血杆菌sodA基因编码的金属锰依赖的超氧化物歧化酶是一种防御蛋白质[1,2]。超氧化物歧化酶(SOD)广泛存在于动物、植物、微生物中。1938年,Keilin和Mann在血液中发现了一种蛋白质——血铜蛋白。1969年,Mc Cord和Fridovich发现该蛋白质具有酶活性,并正式命名其为超氧化物歧化酶[3]。超氧化物歧化酶根据其结合的金属离子不同主要分为Mn SOD、Fe SOD、Cu/Zn SOD以及Ni SOD 4类,分别由sodA、sodB、sodC以及sodN基因编码[4,5]。超氧阴离子自由基(O2-)是生物体生理反应的中间产物,具有极强的氧化能力,是生物氧毒害重要因素之一[6]。SOD是机体内天然存在的超氧自由基清除因子,对维持生物体内动态平衡具有重要作用。缺失SOD的嗜血杆菌菌株比野生型更容易被细胞外超氧化物杀死[7]。Yesilkaya等[8]通过突变肺炎链球菌sodA基因使其Mn SOD失活,突变株在有氧条件下生长速度低于野生型。SOD在细菌预防侵染过程中宿主免疫细胞的氧化杀伤中可能发挥重要作用[9]。本研究以副猪嗜血杆菌sodA基因为研究对象,通过大肠杆菌原核表达系统表达重组HPSSOD蛋白质,利用邻苯三酚自氧化法检测其活性,获得具有活性的重组HPSSOD蛋白质,为研究SOD在HPS细菌生理代谢中的作用奠定基础。
1 材料与方法
1.1 质粒与菌株
血清5型副猪嗜血杆菌、pET28a(+)载体以及E.coliBL21(DE3)菌种来源于长江大学生物医药研究所。
1.2 试剂与仪器
琼脂糖凝胶DNA回收试剂盒购自天根生化科技(北京)有限公司;快速质粒DNA小提试剂盒购自Sigma公司;BamHⅠ、XhoⅠ限制性内切酶购自NEB公司;金牌Mix(green)Golden Star T6 Super Mix购自北京擎科生物科技有限公司;邻苯三酚购自上海麦克林生化科技有限公司;Tris购自赛国生物科技有限公司;分析纯试剂磷酸氢二钠、磷酸二氢钠、氯化钠以及浓盐酸均购自国药集团化学试剂有限公司。
Gel Doc EZ凝胶成像仪、Trans-Blot Turbo转膜仪均购自Bio-Rad公司;UV 2450紫外可见分光光度计购自岛津公司;美国1200高效液相色谱仪购自安捷伦公司;TAS-990型火焰原子化法原子吸收光谱仪购自北京普析通用仪器有限责任公司。
1.3 HPS SOD重组表达载体的构建
根据GenBank上发布的HPSsodA基因序列(ACCESSION:CP041334),设计1对引物sod F和sod R(表1),以血清5型副猪嗜血杆菌煮沸法粗提的基因组DNA作为模板,PCR扩增一段长度为629 bp的SOD序列,PCR反应程序为:98℃预变性2 min;98℃变性10 s,58℃退火10 s,72℃延伸20 s,30个循环;72℃最终延伸3 min;4℃保存。PCR扩增产物经1.5%的琼脂糖凝胶电泳进行分析并切胶回收。将回收的PCR产物以及pET28a(+)载体用BamHⅠ和XhoⅠ限制性内切酶进行双酶切,用T4DNA连接酶将酶切后的PCR产物连接至pET28a(+)载体中。将连接的产物转化至E.coliBL21(DE3)化学感受态中,经PCR鉴定以及测序鉴定后,将测序正确的菌种保存,命名为E.coliBL21(DE3)/pET28a-HPS-SOD。

表1 引物序列
1.4 重组HPS SOD蛋白质的表达
将E.coliBL21(DE3)/pET28a-HPS-SOD工程菌种接种至含50μg/mL卡那霉素的LB培养基中37℃培养8 h,1∶100接种至含50μg/mL卡那霉素的LB培养基中37℃培养,至OD600nm为0.8,经终浓度30 mmol/Lα-乳糖在32℃诱导表达10 h。收集菌体沉淀,用磷酸盐缓冲液(20 mmol/L PB,15 mmol/L NaCl,pH 7.4)将菌体按照1∶10(m∶V)重悬,超声破碎后,12 000 r/min离心10 min,收集上清液进行SDSPAGE检测。
1.5 重组HPS SOD蛋白质的纯化
将上清液进行硫酸铵分级沉淀,收集饱和度40%~60%的沉淀蛋白质,用PB缓冲液重悬沉淀并利用0.22μm滤器过滤。用3倍柱体积的PB缓冲液(pH 7.4)平衡Sephacryl S-300层析柱及系统,将预处理的蛋白液注入纯化仪,流速3 mL/min,分管收集所有UV 280 nm出现吸收峰的溶液,电泳后将目的蛋白质含量较高的收集液进行混合。用5倍柱体积的缓冲液A(pH 7.4 PB)平衡DEAE Sepharose Fast Flow阴离子交换层析柱及系统,以1 mL/min的流速将上一步混合液注入纯化仪,上样完成后用缓冲液A淋洗层析柱5个柱体积,然后通过缓冲液A和缓冲液B(pH 7.4 PB,1 mol/L NaCl)调整比例以形成离子强度梯度,以3 mL/min流速进行梯度洗脱,分管收集所有UV 280 nm出现吸收峰的溶液,将纯化后的蛋白用SDS-PAGE进行检测,用Bio-Rad凝胶成像仪Image Lab软件进行纯度分析,同时采用Bradford法对纯化后蛋白质进行检测。
1.6 重组HPS SOD蛋白质的Western Blotting鉴定
将纯化后的目的蛋白质进行SDS-PAGE电泳,然后将目的蛋白质转移至NC纤维膜上,以5%脱脂奶粉在37℃孵育1 h,以6×His Tag Mouse Monoclonal antibody作为一抗(1∶8 000),37℃孵育1 h,用1×PBST洗涤NC膜3次,10 min/次。以HRP标记的羊抗小鼠二抗IgG(H+L)作为二抗(1∶20 000),37℃孵育1 h,用1×PBST洗涤NC膜3次,10 min/次。加入ECL超敏化学显色液(A液+B液)孵育30 s,用Gel Doc XRS凝胶成像仪进行化学发光成影拍照。
1.7 邻苯三酚自氧化法的建立
1.7.1 邻苯三酚自氧化最大波长的选择 依次加入25℃预热的100 mmol/L Tris-HCl(含1 mmol/L EDTA-2Na,pH 8.2)、20 mmol/L PB缓冲液(pH 7.4)和4.5 mmol/L邻苯三酚(表2),迅速摇匀,分光光度计扫描300~600 nm波长范围内邻苯三酚自氧化产物的吸收峰。

表2 邻苯三酚自氧化法测定
1.7.2 邻苯三酚自氧化速率的测定 依次加入25℃预 热的100 mmol/L Tris-HCl(pH 8.2)和20 mmol/L PB缓冲液(pH 7.4),4.5 mmol/L邻苯三酚,迅速摇匀,检测前3 min邻苯三酚自氧化产物在最大吸收峰处吸收值的变化。
1.7.3 酶活力的计算 调节待测样品至其对邻苯三酚氧化抑制率接近50%进行酶活测定最佳,
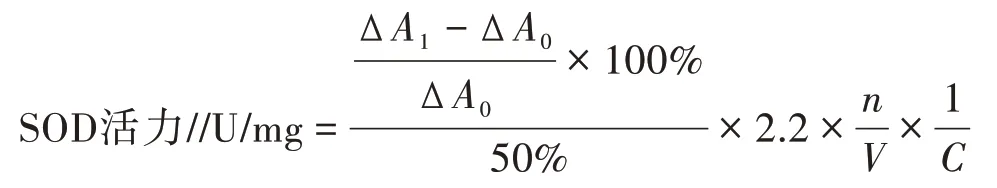
式中,∆A1为邻苯三酚自氧化速率;∆A0为样液抑制邻苯三酚自氧化速率;V为样液体积,单位为mL;n为样液稀释倍数;C为样品浓度,单位为mg/mL。
1.8 Mn元素含量的测定
用固体硫酸锰配制成锰的浓度为100 mg/mL的储存溶液,介质为2%的稀盐酸,然后将锰储存液稀释成系列梯度的标准品,标准品系列质量浓度见表3。用TAS-990原子吸收分光光度计进行Mn元素的检测,检测波长279.48 nm对应样品的吸光度,绘制Mn的标准工作曲线。同法测定浓缩后纯化的HPSSOD蛋白质中Mn原子吸收值,并根据标准曲线拟合的方程计算样品中Mn元素含量。
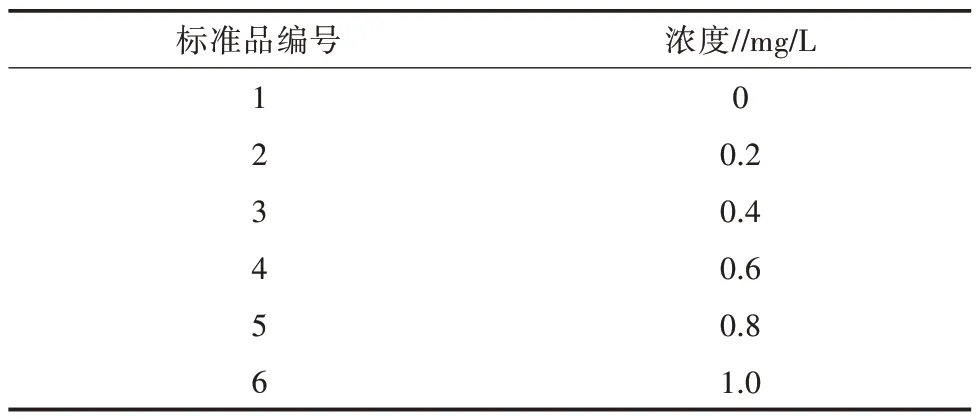
表3 Mn原子吸收标准系列质量浓度
1.9 HPS SOD聚合形式的初步鉴定
利用0.1μm滤膜过滤后的流动相(50 mmol/L PBS,pH 7.4)冲洗高效液相色谱系统,将纯化后的重组HPSSOD样品以及3个相对分子质量标准品:牛血清白蛋白二聚体(132.8 ku)、胰蛋白酶单体(23.8 ku)、猪尿酸氧化酶四聚体(132.0 ku)分别经0.1μm滤器过滤后上样至高效液相色谱柱(Agilent Bio SEC-5)中,以1 mL/min流速进行淋洗,检测280 nm处样品吸收峰,记录保留时间。以各标准品的log10(标准品分子质量)作为横坐标,保留时间作为纵坐标拟合线性回归方程,根据重组HPSSOD的保留时间,利用线性回归方程计算其分子质量。
2 结果与分析
2.1 HPS SOD重组表达载体的鉴定
对构建的重组表达菌株E.coliBL21(DE3)/pET 28a-HPS-SOD进行菌液PCR鉴定,经过1.5%的琼脂糖凝胶电泳检测鉴定,结果表明,在600 bp处扩增到了特异性条带(图1),与预期大小相符,表明E.coliBL21(DE3)/pET28a-HPS-SOD重组表达菌株构建成功。

图1 菌液PCR鉴定结果
2.2 HPS SOD重组蛋白质的表达与纯化
E.coliBL21(DE3)/pET28a-HPS-SOD工程菌诱导表达产物经SDS-PAGE检测。结果表明,表达的重组HPSSOD蛋白质分子质量为26.0 ku,与预期大小相同,表达产物主要以可溶性形式存在于上清中(图2)。表达的重组HPSSOD蛋白质经过硫酸铵分级沉淀,Sephacryl S-300过滤层析以及DEAESepha⁃rose Fast Flow阴离子交换层析等方法纯化后,经SDS-PAGE电泳分析,得到的纯度为95%的重组HPSSOD蛋白质(图2)。
2.3 HPS SOD重组蛋白质的鉴定
将纯化后的重组HPSSOD蛋白质进行Western Blotting检测,在26 ku处有明显特异性反应(图3),与重组的HPSSOD蛋白质分子质量大小一致,阴性对照与6×His Tag多克隆抗体无明显特异性反应,表明重组HPSSOD蛋白质表达成功。

图2 SDS-PAGE检测结果
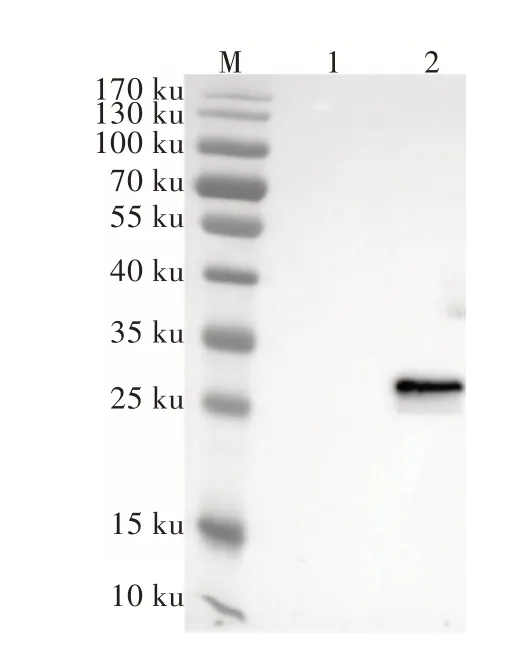
图3 Western Blotting检测结果
2.4 HPS SOD重组蛋白的酶活
2.4.1 邻苯三酚自氧化最大吸收波长选择 如图4所示,在波长300~600 nm,每隔3 min扫描1次,邻苯三酚自氧化产物最大吸收峰为318 nm,故选择318 nm进行酶活性测定。

图4 邻苯三酚自氧化产物在不同时间的吸收扫描光谱
2.4.2 重组HPSSOD酶活的测定 采用建立的邻苯三酚自氧化法来检测纯化的重组HPSSOD的酶活性,检测得到重组HPSSOD酶活性为215.9 U/mg,表明重组HPSSOD具有较好的活性。
2.5 重组HPS SOD蛋白质中Mn元素的含量
根据测定的锰标准品不同含量对应的吸收值,绘制出标准曲线(图5),得出计算方程C=0.568 7A2+2.847 6A+0.002 4(C为浓度mg/L,A为吸光度),相关系数为0.999 94,表明Mn质量浓度在0~1.0 mg/L内相关性较好。测得纯化的重组SOD样品对应的平均吸收值为0.24(SD为0.000 2,RSD为0.513%),对应纯化的重组SOD样品中Mn元素平均含量为0.71 mg/L,加标量为0.20 mg/L,测得总量为0.89 mg/L,回收率为90%,表明该方法所测的纯化后HPSSOD中Mn浓度具有较好的准确度。
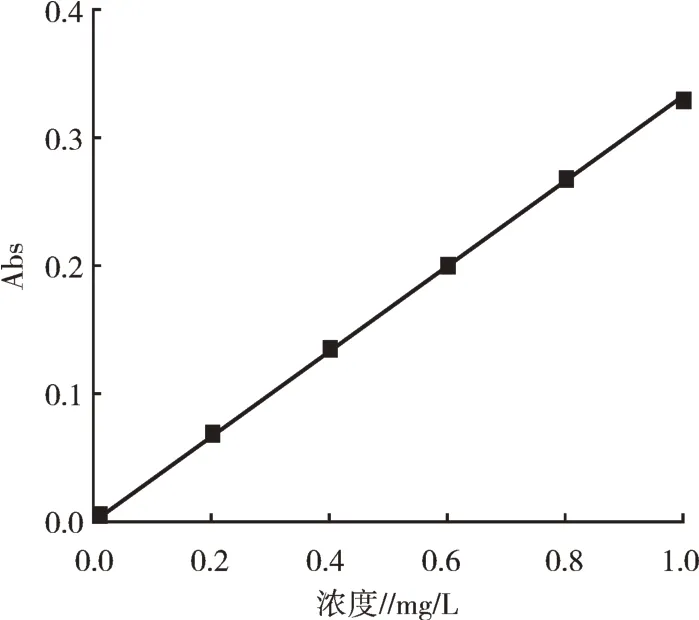
图5 Mn元素标准工作曲线
2.6 重组HPS SOD蛋白质表观分子质量的检测
经HPSEC检测,纯化后的HPSSOD保留时间为8.171 min。分子质量标准品保留时间见表4。根据标准品拟合的线性方程为保留时间(min)=-1.248 9×log1(0分子质量)+10.72,相关系数为0.989 3,将重组HPSSOD的保留时间代入方程计算得出纯化的重组HPSSOD蛋白质表观分子质量为109.8 ku。变性电泳显示重组HPSSOD单亚基的分子质量为26 ku,由此推测该重组蛋白质是4聚体蛋白质。

表4 HPSEC检测数据表
3 小结与讨论
副猪嗜血杆菌病又称格拉泽氏病,由副猪嗜血杆菌引起的猪全身性炎症反应[10]。超氧化物歧化酶作为治疗全身炎症性疾病的一个潜在靶点,有学者发现接种了副猪嗜血杆菌亚单位疫苗SOD的小鼠对HPSSH0165和MD0322具有较好的免疫保护作用,表明HPSSOD是潜在的具有高效免疫原性的重组蛋白之一[11,12]。目前,从鼠伤寒沙门菌、金黄色葡萄球菌、荧光假单胞菌等中均克隆并表达出了活性SOD[13-15]。但关于副猪嗜血杆菌sodA编码的Mn-SOD的酶活性以及相关理化性质的研究未见报道,本研究通过克隆副猪嗜血杆菌的sodA基因,表达出了具有活性的重组HPSSOD。
生物体内存在两类抗氧化系统,其中一类为酶抗氧化系统,包括过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)等[16]。超氧化物歧化酶在清除活性氧系统中作为第一道防线,是机体应激反应的重要监测指标[17,18]。目前获得超氧化物歧化酶的传统途径是从植物、动物、微生物等提取,动物血液中提取SOD存在交叉感染等风险已被国内外禁止,植物中SOD含量较少,提取纯化工艺复杂、生产成本较高,虽然微生物发酵法提取高产菌株的SOD产量较高成本较低但获得高产菌株的来源有限,微生物中SOD基因的表达与其生长阶段以及营养条件有关[19]。一般的动植物和微生物中提取的天然SOD稳定性较差。利用大肠杆菌原核表达系统表达异源蛋白,因其具有产出快、产量高的特点成为获取SOD的有效途径[20]。Shi等[21]通过克隆蚕的BmSOD3基因,利用原核表达系统获得Cu/Zn-SOD,在体外显示出对大肠杆菌的抗菌活性,还有克隆黄瓜Cu/Zn-SOD基因获取有活性的SOD[22]。而大多数采用的IPTG作为诱导剂进行诱导表达,IPTG具有毒性作用,在应用方面有较大限制[23],因此本研究通过α-乳糖作为诱导剂,诱导大肠杆菌工程菌进行表达,获得高表达量的可溶性异源HPSSOD蛋白质,测得纯化后的HPSSOD酶活力为215.9 U/mg,同样具有较好的活性。SOD在食品、临床、日化等方向应用广泛[24]。获得高纯度有活性的超氧化物歧化酶产物显得尤为重要,传统从动植物微生物中提取纯化天然SOD的方法是破碎提取法,然后经过有机溶剂、盐沉淀、层析柱分离出SOD[25,26]。本研究采用硫酸铵沉淀、过滤层析、离子交换层析等系列的方法得到纯度为95%较高纯度的重组HPSSOD蛋白质,在实际大规模生产用于人类医疗保健中具有较大的优势。
不同SOD其结合的金属离子不同。通过原子吸收分光光度法检测水样[27]、人血白蛋白[28]中金属含量已有报道。本研究采用火焰原子吸收光度法检测到浓缩后的纯化的HPSSOD样品中Mn元素含量为0.71 mg/L,回收率为90%,检测准确度较好。Mn-SOD主要以二聚体或四聚体的形式存在,不同来源的Mn-SOD亚基分子分子质量在20 ku左右,分子质量在40~80 ku[29,30],真核生物线粒体中的Mn-SOD是一种四聚体蛋白[31]。有学者通过测定双孢蘑菇SOD酶亚基分子质量以及全酶分子质量推测其聚合形式为二聚体[30]。目前,通过HPSEC法分析可有效获得蛋白表观分子质量[32,33],本研究通过HPSEC法检测计算得到重组的HPSSOD分子质量为109.8 ku,与其4个亚基形成的聚合体分子质量相近,推测重组HPSSOD可能是由4个相同亚基组成的多聚体。
综上所述,本研究成功地将副猪嗜血杆菌的sodA基因克隆到pET28a(+)表达载体中,通过大肠杆菌原核表达系统获得了重组HPSSOD蛋白质。重组HPSSOD蛋白质为可溶性蛋白质,为多聚体,酶活性较好,为研究HPSSOD的抗氧化机理以及开发利用提供了依据。
