基于指纹图谱和多成分含量测定的艾纳香药材质量评价
2021-06-24王鸿发于福来张影波陈振夏庞玉新
胡 璇,王鸿发,于福来*,元 超,黄 梅,张影波,陈振夏,王 丹,庞玉新
1.中国热带农业科学院热带作物品种资源研究所 海南省艾纳香工程技术研究中心,海南 海口 571101
2.广东药科大学中药资源学院,广东 云浮 527300
3.宁夏泰益欣生物科技有限公司,宁夏 银川 750001
艾纳香Blumea balsamifera(L.)DC.是菊科艾纳香属多年生草本植物,在黎族、苗族等少数民族药用历史悠久,具有祛风除湿、清热解毒、调经、镇痛等功效[1]。艾纳香含有丰富的挥发油成分,包括L-龙脑、β-石竹烯、樟脑、α-蒎烯、β-蒎烯、柠檬醇等[2],这些化学成分是艾纳香发挥修复皮肤黏膜损伤[3]、抗炎[4]、抑菌[5]等作用的主要物质基础;艾纳香中还含有大量黄酮类成分,包括黄酮醇类、二氢黄酮类、查耳酮类等化合物[6],是艾纳香抗氧化[7]、保肝[8]、止血凝血[8]、抗肿瘤[9]等作用的主要有效成分。
随着艾纳香在医药、日化用品等领域应用日益广泛,其需求量不断攀升,其药材从野生到栽培分布区域也日趋扩大分散,从主产区贵州辐射周边热带地区,包括海南、广东、广西、云南等地区均有艾纳香资源的分布[10],而因为土壤、光照、水分、CO2浓度等因素的不同造成的地域差异性也成为艾纳香整体质量评价需要考虑的因素。目前大部分的文献资料显示艾纳香多以挥发油类成分或黄酮类成分艾纳香素[11-12],或者以单一粗提物总黄酮或总挥发油进行药材的整体质量控制[13-14],缺乏多手段多指标成分的系统性研究。本研究采用高效液相色谱法,建立艾纳香的HPLC 指纹图谱获得化学数据,从艾纳香指纹图谱特征成分的角度,结合聚类分析(HCA)、主成分分析(PCA)和正交偏最小二乘法-判别分析(OPLS-DA)等化学模式识别方法分析比较不同产区艾纳香质量差异。在课题组前期提取分离得到的艾纳香单体成分基础上[15],指认并测定了5 个黄酮类成分的含量,通过多成分含量测定进一步寻找产区差异性成分,为全面、系统地评价艾纳香药材质量提供科学的理论依据。
1 材料与仪器
1.1 材料
34 批不同产区的艾纳香药材收集于广东、广西、贵州和海南4 个省份,经中国热带农业科学院热带作物品种资源研究所于福来副研究员鉴定为艾纳香Blumea balsamifera(L.)DC.,药材来源信息见表1。本研究所需5 个二氢黄酮对照品均来自作者所在课题组前期通过制备色谱从艾纳香中系统分离纯化获得的单体化合物[15],分别为3,3′,5,7-四羟基-4′-甲氧基二氢黄酮、圣草酚、3,3′,5-三羟基-4′,7-二甲氧基二氢黄酮、艾纳香素、sakuranrtin。乙腈、甲醇为色谱纯(赛默飞世尔科技有限公司),水为超纯水,其他试剂均为分析纯。

表1 艾纳香样品信息Table 1 Sources of 34 batches of B.balsamifera samples
1.2 仪器
Agilent1260 高效液相色谱仪(G1311C 四元泵,G1316A 柱温箱,G1329B 全自动进样器,G1315D二极管阵列检测器),Agilent ChemStation 工作站;SKQ-600DE 数控超声波清洗器(昆山市超声仪器有限公司);德国Merck Millipore/Direct-Q5 UVR 超纯水系统(广州市东方科苑进出口有限公司);ME54E电子天平(梅特勒-托利多仪器有限公司)。
2 方法与结果
2.1 指纹图谱及含量测定色谱条件
色谱柱:Agilent TC-C18柱(250 mm×4.6 mm,5 µm);流动相为乙腈(A)-0.5%磷酸溶液(B),梯度洗脱(0~15 min,15%~22% A;15~21 min,22%~24% A;21~30 min,24%~30% A;30~45min,30%~33% A;45~55 min,33%~38% A;55~70 min,38%~55% A);检测波长285 nm;柱温35 ℃;体积流量0.9 mL/min;进样量10 μL。
2.2 溶液的制备
2.2.1 对照品溶液的制备 精密称取对照品3,3′,5,7-四羟基-4′-甲氧基二氢黄酮、圣草酚、3,3′,5-三羟基-4′,7-二甲氧基二氢黄酮、艾纳香素、sakuranrtin 适量配制成质量浓度分别为1.02、0.241、0.203、0.205、0.016 mg/mL 的混合对照品储备液。
2.2.2 供试品溶液的制备 34 份不同产区艾纳香叶样品粉碎后过30 目筛,精密称取样品0.5 g 于具塞锥形瓶中,精密加入90%甲醇10 mL,称定质量,超声处理45 min,放至室温,再称定质量,用90%甲醇补足减失质量,摇匀,滤过,取续滤液,即得。
2.3 方法学考察
2.3.1 线性关系及定量限、检测限 精密量取3,3′,5,7-四羟基-4′-甲氧基二氢黄酮、圣草酚、3,3′,5-三羟基-4′,7-二甲氧基二氢黄酮、艾纳香素混合对照品储备液和sakuranrtin 对照品储备液用倍比稀释的方法以90%甲醇制成系列对照品溶液,在“2.1”项色谱条件下,所得溶液10 µL 进样测定其峰面积。以峰面积(Y)对质量浓度(X)进行线性回归,计算回归方程。按“2.2.1”项下方法配制混合对照品溶液用90%甲醇逐级稀释,按照信噪比(S/N)为3∶1 的对照品溶液质量浓度为检出限(LOD),以S/N为10∶1 的对照品溶液质量浓度确定为定量限(LOQ),结果见表2。
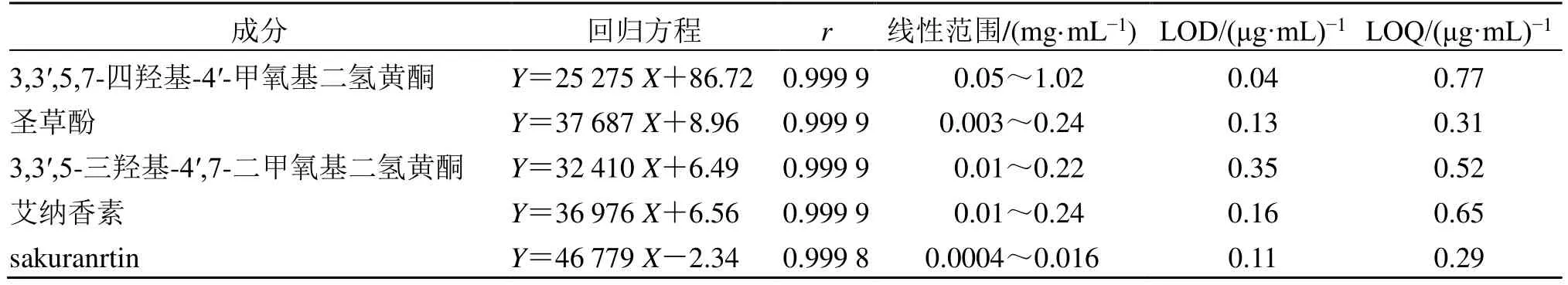
表2 5 种成分的回归方程、相关系数及线性范围、定量限和检测限Table 2 Calibration curves,correlation coefficients,linear ranges,limit of quantitation and detection of five constituents
2.3.2 精密度试验 精密称取艾纳香样品(GD-1)粉末0.5 g,依照“2.2.2”项下方法制备供试品溶液,按“2.1”项下的色谱条件进行测定,连续进样6 次,记录其指纹图谱,以3,3′,5,7-四羟基-4′-甲氧基二氢黄酮为参比峰,计算各共有峰的相对保留时间和相对峰面积,相对保留时间的RSD 在0.06%~0.29%,各共有峰的相对峰面积的RSD 在0.04%~1.50%。精密吸取混合对照品溶液,计算3,3′,5,7-四羟基-4′-甲氧基二氢黄酮、圣草酚、3,3′,5-三羟基-4′,7-二甲氧基二氢黄酮、艾纳香素、sakuranrtin 峰面积的RSD分别为0.11%、0.09%、0.11%、0.10%、0.20%,表明仪器精密度良好。
2.3.3 重复性试验 精密称取艾纳香样品(GD-1)粉末,依照“2.2.2”项下方法平行制备6 份供试品溶液,按“2.1”项下的色谱条件进行分析,记录其指纹图谱,以3,3′,5,7-四羟基-4′-甲氧基二氢黄酮为参比峰,计算各共有峰的相对保留时间和相对峰面积,相对保留时间的RSD 在0.03%~0.18%,各共有峰的相对峰面积的RSD 在0.27%~3.12%。计算3,3′,5,7-四羟基-4′-甲氧基二氢黄酮、圣草酚、3,3′,5-三羟基-4′,7-二甲氧基二氢黄酮、艾纳香素、sakuranrtin 峰面积的RSD 分别为2.98%、2.64%、2.52%、2.46%、2.59%,表明方法重复性良好。
2.3.4 稳定性试验 取艾纳香样品(GD-1)供试品溶液,分别于供试品溶液制备后0、2、4、8、12、24 h 按“2.1”项下的色谱条件进样,记录其指纹图谱,以3,3′,5,7-四羟基-4′-甲氧基二氢黄酮为参比峰,计算各共有峰的相对保留时间和相对峰面积,相对保留时间的RSD 在0.03%~0.18%,各共有峰的相对峰面积的RSD 在0.08%~2.75%。计算3,3′,5,7-四羟基-4′-甲氧基二氢黄酮、圣草酚、3,3′,5-三羟基-4′,7-二甲氧基二氢黄酮、艾纳香素、sakuranrtin 峰面积的RSD 分别为0.28%、0.33%、0.19%、0.21%、2.32%,表明供试品溶液在24 h 内稳定性良好。
2.3.5 加样回收率试验 精密称定已测定的艾纳香样品粉末约0.5 g,置10 mL 量瓶中,分别精密加入配制好适量质量浓度的3,3′,5,7-四羟基-4′-甲氧基二氢黄酮、圣草酚、3,3′,5-三羟基-4′,7-二甲氧基二氢黄酮、艾纳香素、sakuranrtin 各自0.5、1.0、1.5 mL,每个体积重复3 次,加入一定量90%甲醇定容至10 mL,按照“2.2.2”项下方法制备供试品溶液,按照“2.1”项色谱条件进行含量测定,计算平均加样回收率和RSD 值。结果显示3,3′,5,7-四羟基-4′-甲氧基二氢黄酮、圣草酚、3,3′,5-三羟基-4′,7-二甲氧基二氢黄酮、艾纳香素、sakuranrtin 平均加样回收率分别为101.1%、100.7%、100.4%、100.9%、99.6%,RSD 分别为1.21%、2.15%、2.44%、1.47%、2.21%。
2.4 指纹图谱的建立
2.4.1 指纹图谱共有模式的建立及相似度评价 将4 个产区34 批艾纳香样品在检测波长为285 nm 处的色谱图以AIA 格式导出并导入“中药色谱指纹图谱相似度评价系统”(2004 版)软件,以GD-1 编号样品的指纹图谱作为参照图谱,采用中位数法,时间宽度为0.5 进行多点校正和色谱峰匹配,得到艾纳香叠加指纹图谱(图1)。保留时间为20.78 min 的7 号色谱峰分离良好且为所有样品共有,故确定选取作为参照峰,其余特征峰以1、2、3……N 进行标定,共标定15 个共有特征峰,见图2-A。经与对照品对比,其中7、8、11、13、15 号共有峰分别对应3,3′,5,7-四羟基-4′-甲氧基二氢黄酮、圣草酚、3,3′,5-三羟基-4′,7-二甲氧基二氢黄酮、艾纳香素、sakuranrtin,艾纳香对照指纹图谱和混合对照液的对照色谱图分别见图2-A 和图2-B。

图1 34 批不同产区艾纳香样品的HPLC 叠加指纹图谱Fig.1 Superposition HPLC fingerprints of 34 batches of B.balsamifera samples from different regions
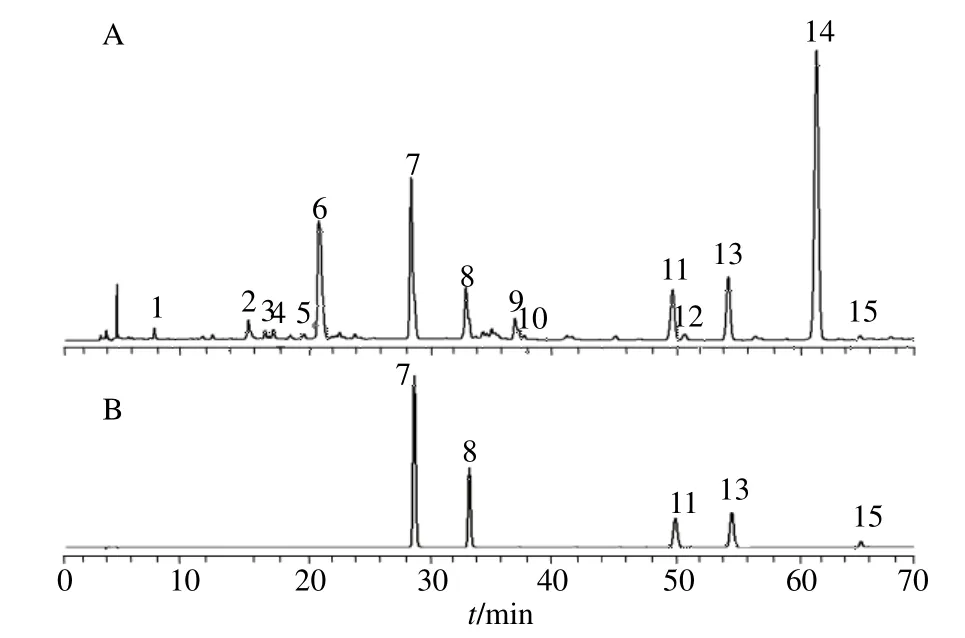
图2 艾纳香对照指纹图谱(A)和混合对照品溶液的HPLC图(B)Fig.2 HPLC comparison fingerprint(A)and mixed reference substances(B)of B.balsamifera
将4 个产区34 批不同产区艾纳香药材图谱与对照指纹图谱进行相似度评价,相似度结果见表3。与对照指纹图谱相比,广东和广西相似度比较高,除了样品GD-2、GX-2、GX-10 相似度低于0.90,其他样品相似度结果均大于0.90,而贵州和海南具有较低的相似度,除了样品GZ-1 和GZ-7 其他贵州产样品相似度结果均低于0.90,海南相似度在0.433~0.894。结果表明不同产区的艾纳香样品药材质量是存在一定地域差异性。广东和广西化学组分特征更为相似,贵州和海南的化学组分特征较为相似,这几个产区表现出的组分差异集中在21~29 min 和34~38 min,每个样品的图谱中贵州和海南0~40 min 段化学组分色谱峰信息量显著多于广东和广西,且不同产区色谱峰面积大小上也是存在差异,广东和广西在50~70 min 段化学组分14 号峰峰面积显著高于贵州和海南,而贵州和海南部分样品在20~30 min段化学组分7号(3,3′,5,7-四羟基-4′-甲氧基二氢黄酮)和8 号峰(圣草酚)峰面积显著高于广东和广西。
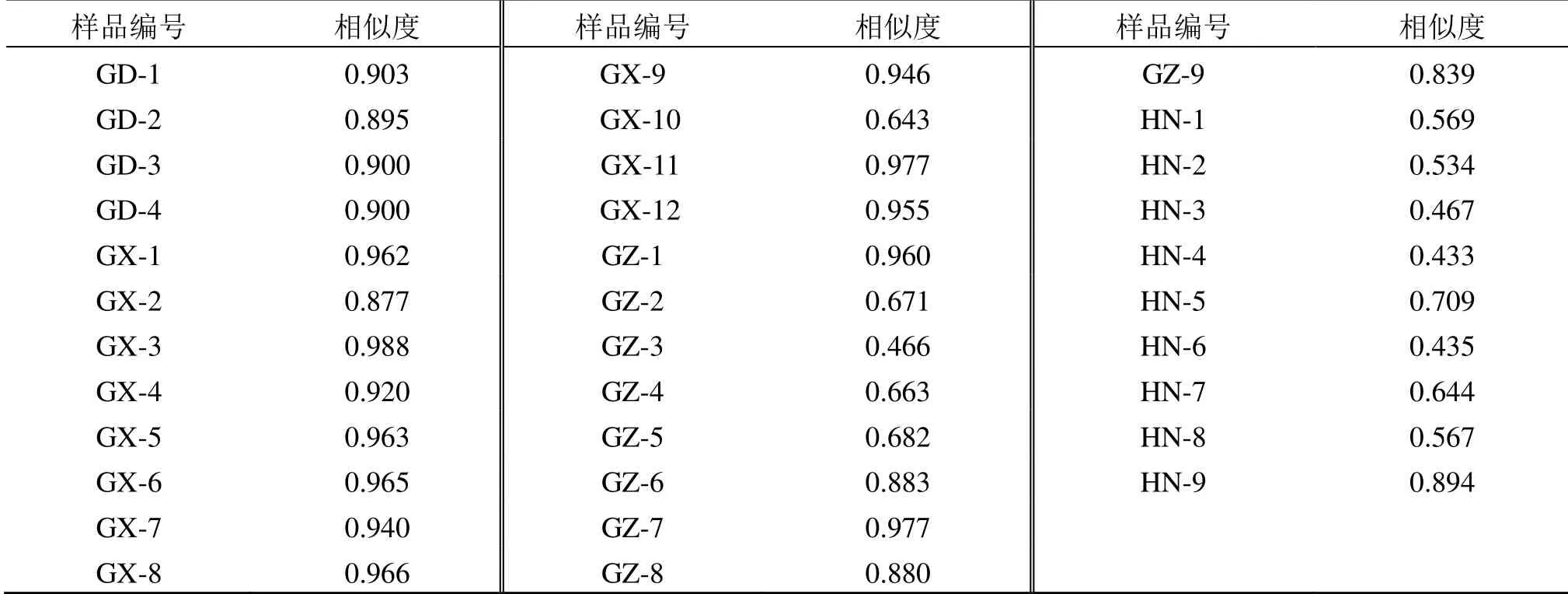
表3 34 批艾纳香样品指纹图谱相似度评价Table 3 Similarity evaluation of 34 batches of B.balsamifera samples
2.4.2 聚类分析(HCA) 将艾纳香各个共有峰的峰面积相对于参照峰7 号(3,3′,5,7-四羟基-4′-甲氧基二氢黄酮)峰面积进行量化,得到15×34 阶数据矩阵,导入IBM SPSS 19.0 软件中,数据标准化后进行聚类分析,采用Ward 联结法,欧式距离平方和作为样本测度,聚类树状图见图3。根据聚类结果可以看出,当判别距离为10 时,34 批艾纳香样品大致样品可以分成3 类,I 类(9 份广西、8 份贵州和6 份海南),II 类(4 份广东、3 份广西和1份贵州),III 类(3 份海南),这些产区依旧存在个体差异较大的样品。当聚类距离为5 时,34 批样品可以划分为5 大类,I 类(8 份贵州,7 份广西和1份海南样品),II 类(5 份海南和2 份广西),III 类(4 份广东,3 份广西和1 份贵州),Ⅳ类(2 份海南),V(1 份海南),4 个产区的艾纳香样品依旧比较分散,但是2 次结果的第I 类仍能将大部分的贵州和广西样品聚为一类,说明贵州和广西的大部分样品具有一定的相似性,相对于其他产区样品海南产样品自身存在较大差异。
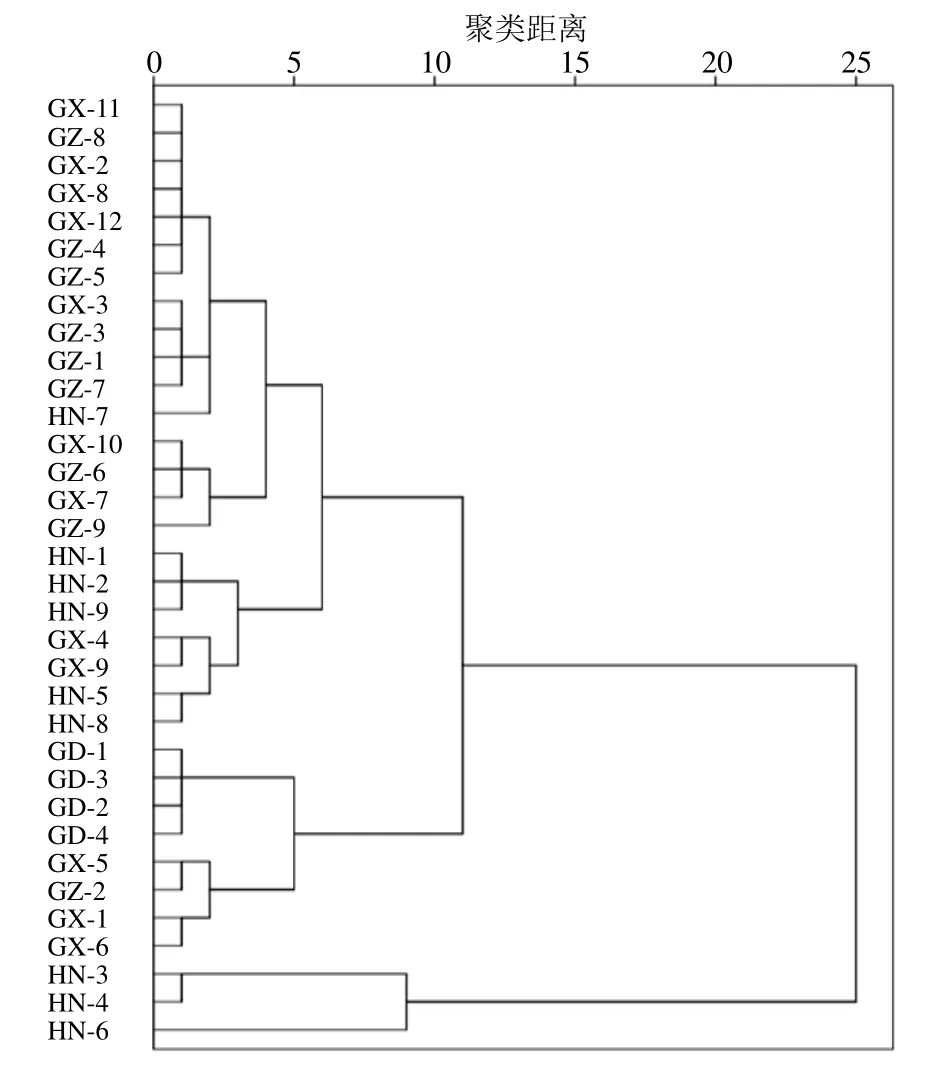
图3 艾纳香样品聚类分析树状图Fig.3 Custer analysis of B.balsamifera samples
2.4.3 主成分分析(PCA)[16]进一步探讨4 个产区艾纳香化学成分之间的差异,将上述15×34 阶矩阵导入SIMCA-P+14.1 软件中,以15 个共有色谱峰的相对峰面积值作为变量,采用非监督模式识别方法PCA 来观察不同产区34 份艾纳香样品的自然聚集。模型拟合选择4 个主成分,累计贡献率为82.90%,模型拟合能力良好,34 批艾纳香样品的三维PCA 矩阵图见图4。可以看出海南产区艾纳香样品化学成分的量上与其他产区样品具有明显差异,基本能与其他产区区分,海南样品的分散性与聚类的结果基本一致,其中HN-6 单独一类,HN-4 和HN-3 一类,HN-5、HN-1、HN-9、HN-2 一类,但是其他产区样品并不能很好的区分开来。除了GZ-9、GZ-2、GX-6、GX-1、GX-5,大部分贵州、广西以及广东样品具有交叉,化学成分含量上具有一定的相似性。
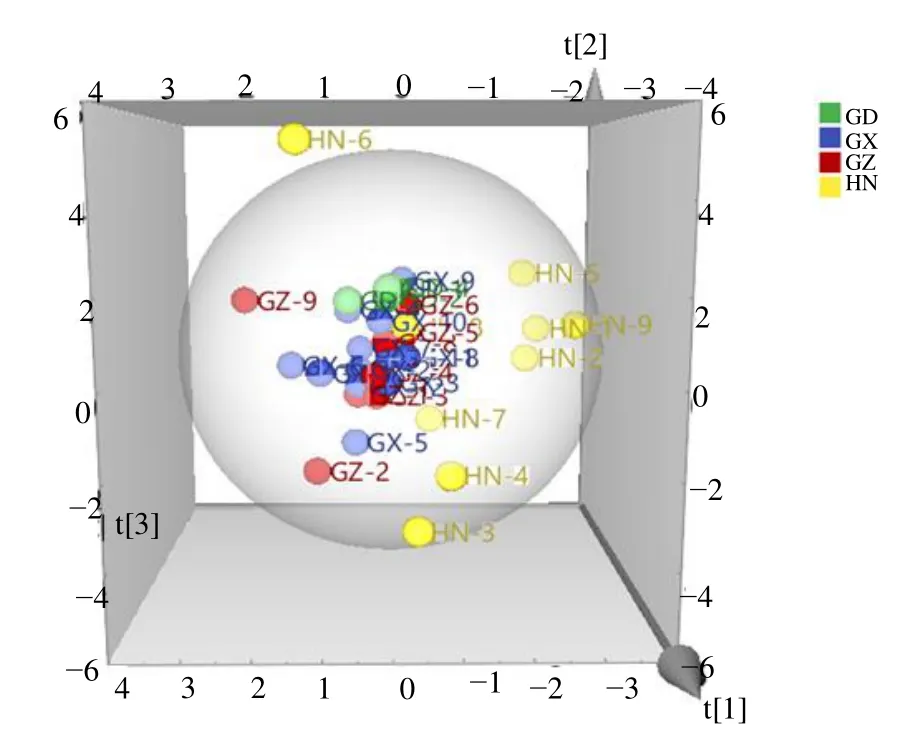
图4 34 批艾纳香样品的PCA 得分图Fig.4 PCA scores plots of B.balsamifera samples
2.4.4 偏最小二乘判别分析(OPLS-DA)[17]在PCA 的基础上进一步选择有监督模式的OPLS-DA对不同产区34 份艾纳香样品进行分析,筛选出对引起组间差异贡献率较大的成分。在建立的OPLS-DA 模型中,累计解释能力参数R2X和R2Y分别为0.893 和0.665,预测能力参数(Q2)为0.446,提示本实验所建立OPLS-DA 模型的稳定性及预测能力较好[18]。由OPLS-DA 得分图可知(图5),4个产区的艾纳香药材基本上可以分为4 类,8 份海南样品单独可以分为一类,4 份广东样品和1 份广西样品可聚为一类,9 份贵州样品、7 份广西样品和1 份海南样品聚为一类,3 份广西样品单独聚为一类。每个产区大部分样品各自分布于不同的象限,不同产区之间有交叉样品,主要表现在大部分的贵州和广西的样品可聚为一类,这与聚类分析的结果基本一致。每个产区样品之间的离散程度较大,结果提示每个产区的样品本身质量就存在较大差异,尤其是海南和广西样品。
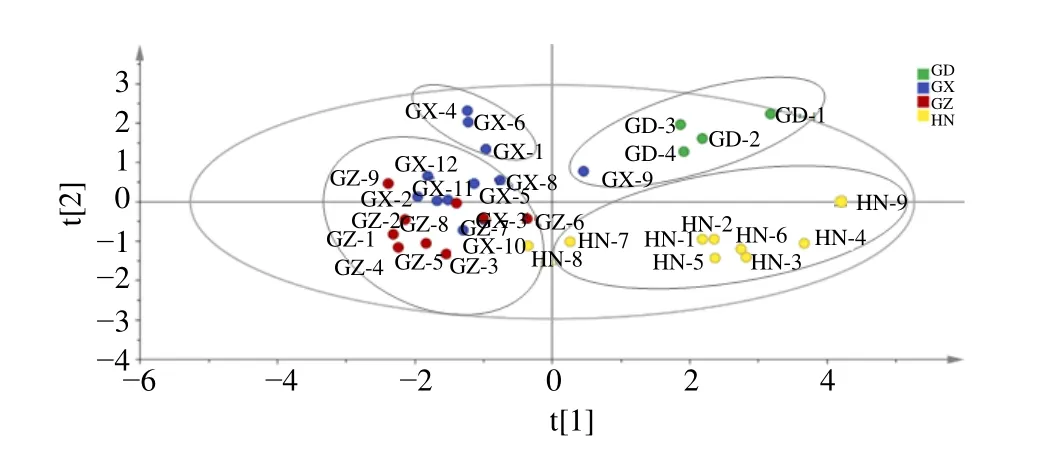
图5 34 批艾纳香样品的OPLS-DA 得分图Fig.5 OPLS-DA scores plots of B.balsamifera samples
对4 组数据的差异性进行整体分析,得到变量权重重要性排序(variable importance in projection,VIP)预测值,在0.95 的置信区间内。OPLS-DA模型中14 个色谱峰的VIP 见图6,VIP 越大,表明该色谱峰对于不同产区艾纳香的分类贡献越大,也即为最能导4 个产区艾纳香样品相区分的差异成分,选取VIP>1 的5 个化合物作为差异性标志物,按VIP 大小排序依次为14 号峰>8 号峰(圣草酚)>12 号峰>2 号峰>10 号峰,这些成分在区分不同产区间艾纳香起到重要作用,是其差异的主要标志。
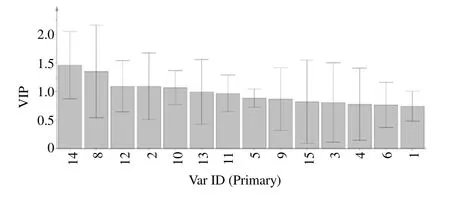
图6 艾纳香样品OPLS-DA 模型中14 个色谱峰的VIPFig.6 VIP of 14 chromatographic peak in OPLS-DA model of B.balsamifera samples
2.4.5 综合质量评分[19]以上述4 个主成分对不同产区34 批艾纳香样品质量进行综合评分,由15 个共有峰因子的载荷向量及特征值计算得到15 个因子的特征向量,以特征向量为系数构建4 个主成分的线性方程F1=0.286X1+0.314X2+0.291X3+0.301X4+0.350X5+0.290X6-0.090X7-0.005X8+0.254X9+0.283X10+0.290X11+0.268X12+0.268X13+0.017X14+0.237X15;F2=-0.320X1+0.01X2-0.312X3-0.294X4-0.136X5-0.316X6-0.163X7+0.264X8+0.366X9+0.104X10+0.246X11+0.059X12+0.365X13+0.151X14+0.366X15;F3=0.022X1-0.267X2-0.023X3-0.025X4-0.001X5+0.096X6+0.543X7-0.064X8+0.211X9-0.180X10+0.151X11-0.155X12+0.180X13-0.636X14+0.240X15;F4=0.154X1+0.147X2+0.030X3+0.090X4+0.161X5+0.190X6+0.028X7+0.503X8+0.120X9-0.395X10-0.234X11-0.540X12+0.028X13+0.258X14+0.211X15。X1~X15为指纹图谱共有峰相对峰面积,根据特征值λ1=6.769,λ2=2.939,λ3=1.397,λ4=1.330,得综合得分评价方程F=AF1+BF2+CF3+DF4=0.544F1+0.236F2+0.112F3+0.107F4,其中A=λ1/(λ1+λ2+λ3+λ4),B=λ2/(λ1+λ2+λ3+λ4),C=λ3/(λ1+λ2+λ3+λ4),D=λ4/(λ1+λ2+λ3+λ4)。综合得分越高表示单个药材样品整体质量越好,HN-6+海南省琼中县营根镇+,HN-4+海南琼中县中平镇+,HN-3+海南琼中县中平镇+是综合得分前3 的样品,也是HCA 和PCA 中成分含量差异比较大的样品,4 份广东产样品综合得分也比较高,列居前10位,具体综合质量评分情况见表4。
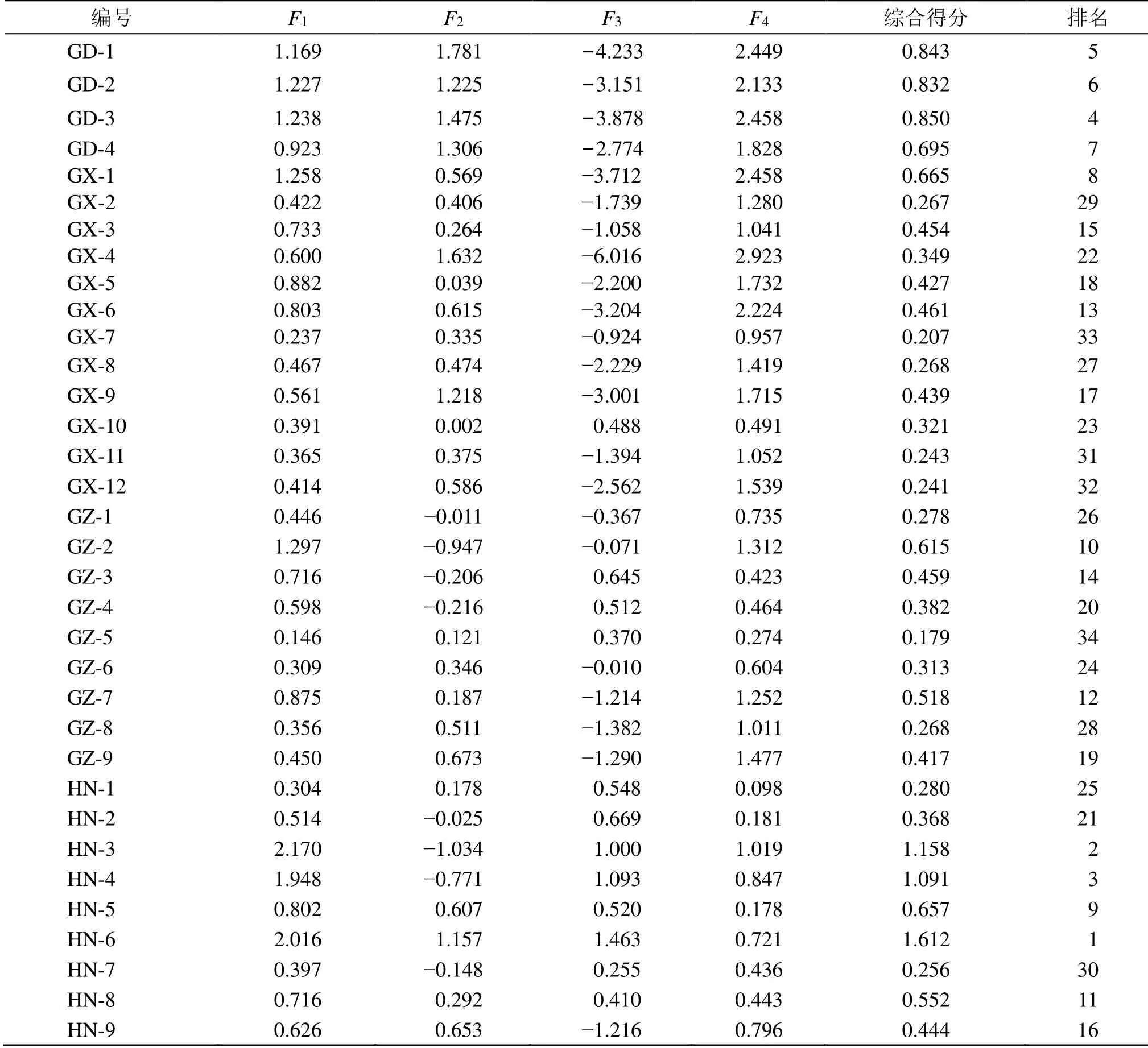
表4 34 批艾纳香样品主成分因子得分及排序Table 4 Main component factor score and ranking of 34 batches of B.balsamifera samples
2.5 不同产地样品含量测定
在艾纳香指纹图谱建立的基础上,发现经上述色谱条件进样检测,指认的5 个色谱峰3,3′,5,7-四羟基-4′-甲氧基二氢黄酮、圣草酚、3,3′,5-三羟基-4′,7-二甲氧基二氢黄酮、艾纳香素、sakuranrtin 色谱峰均能达到很好地分离效果。根据进样结果依次记录5 个指认峰峰面积,计算其含量。
利用IBM SPSS 19.0 统计软件对含量测定结果进行分析,发现4 个产区5 个成分样本量不满足正态性检验,故采用非参数独立样本Kruskal-Wallis检验进行不同产区含量差异分析,并借助GraphPadPrism7.0 软件数据绘图工具做差异分析箱式图(图7)。结果显示5 个成分中3,3′,5,7-四羟基-4′-甲氧基二氢黄酮、圣草酚、3,3′,5-三羟基-4′,7-二甲氧基二氢黄酮和sakuranrtin 均以贵州产整体含量较高,艾纳香素以海南产整体含量较高;3,3′,5,7-四羟基-4′-甲氧基二氢黄酮贵州产区与其他3 个产区具有一定差异(P<0.01,0.05),3,3′,5-三羟基-4′,7-二甲氧基二氢黄酮和艾纳香素贵州产区与广西产区具有显著性差异(P<0.01),sakuranrtin 在4 个产区中没有差异。由于在指纹图谱分析结果中3,3′,5,7-四羟基-4′-甲氧基二氢黄酮(7 号峰)作为特征峰,其相对峰面积值为1,在变量权重重要性排序没有得到体现[17]。根据4 个产区图谱峰面积以及含量测定结果可以看出该峰是区分4 个产区的一个重要成分之一。
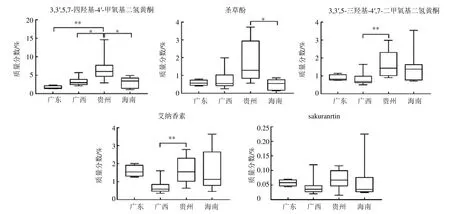
图7 4 个产区艾纳香样品中5 个成分的含量比较Fig.7 Content comparison of five components in B.balsamifera samples from different regions
3 讨论
本实验比较不同提取溶剂(乙醇、甲醇、90%甲醇、75%甲醇和50%甲醇)对艾纳香样品色谱峰的影响,结果显示甲醇作为溶剂的色谱峰信息量多于乙醇,不同比例的甲醇提取比甲醇提取部分色谱峰响应值更高,但因50%和75%提取的在同一方法下色谱图中32~34 min 时基线不稳定,最终选择90%甲醇作为提取溶剂。采用二极管阵列检测器对艾纳香样品进行全波长扫描,比较了不同波长下色谱图的峰数目与分离度,结果发现采用285 nm 作为检测波长选用样品色谱峰数目较多且分离度良好。同时对进样色谱条件包括梯度洗脱程序、柱温、进样量、流动相磷酸水的pH 值进行了考察,综合各种因素,最终梯度洗脱条件确定为:柱温35 ℃;体积流量0.9 mL/min;进样量10 μL,流动相为0.5%磷酸水-乙腈,梯度洗脱程序见“2.1”项。
本研究采用高效液相色谱法,建立了34 批4个产区的艾纳香药材HPLC 化学指纹图谱,结果显示4 个产区药材相似度在0.433~0.977,尤其海南相似度偏低,其次是贵州,广东和广西普遍具有较高相似度。4 个产区艾纳香药材在化学组分和含量上存在差异,如广东4 个样品在17~19 min 这个较短时间段完全没有色谱峰信息,但是其他3 个产区在这个时间段里明显的检测到了色谱峰信号,且表现出峰面积的不同。这种差异可能是由于产区因素导致,但也有可能是其他因素如采收时间、种植技术等导致某些化学成分含量过低无法达到仪器检测限而造成组分以及含量差异,或者这些因素直接导致某些产区样品缺失了某些成分,这都有待进一步的研究和探索,而差异和不稳定性的存在也说明艾纳香药材有待进一步加强质量控制和优良种质资源育种的必要性。
为了进一步寻找不同产区艾纳香样品的差异性成分,采用聚类分析、PCA 分析和OPLS-DA 分析等化学模式识别方法,对4 个产区艾纳香样品进行分析比较。结果表明,基于指纹图谱15 个共有峰相对峰面积数据,HCA 和PCA 分析发现4 个产区差异区分不是很明显,但海南产艾纳香样品自身质量存在较大差异。通过OPLS-DA 分析可以将海南、广东样品同贵州、广西进行一定的区分,不同产区样品偏向分布不同的象限,贵州和广西大部分样品可以聚为一类,这和HCA 结果一致。贵州和广西地区毗邻,环境气候条件具有更多的相似性,均属于亚热带气候区,广东和广西地区毗邻,广东是亚热带和热带混合气候,而海南则与其他3 个产区独立开来,完全属于热带气候,从分析结果也可以看出海南产区的样品存在更大的差异性。通过变量权重要性排序及多成分含量测定发现共有峰14、8(圣草酚)、12、2、10、7 号峰(3,3′,5,7-四羟基-4′-甲氧基二氢黄酮),这些成分可以作为区分和鉴别不同产区艾纳香药材质量的控制指标,4 个未知差异成分本课题组后续将利用Q-TOF/MS 对未知成分进行定性,从而明确可识别不同产区艾纳香药材的差异成分,以期为评价艾纳香药材的质量一致性提供更为全面地参考。虽然海南样品自身存在较大差异,但是其艾纳香单株样品表现出了较佳的质量评分,综合质量评分中前3 名为海南省琼中县的样品,具备了选育出优良艾纳香单株的可能性,可为艾纳香品种选育和分株扩繁提供依据。在前期课题组提取分离艾纳香单体成分的基础上通过对照品指认并定量测定了5 个二氢黄酮类单体成分,这5 个成分均是艾纳香中的重要活性成分,具有抑菌[15]、抗肿瘤[20]、抗氧化[21]等药理作用,在艾纳香整体药材质量评价中可考虑作为黄酮类指标性成分。
综上分析,艾纳香药材根据产区不同,在成分的组分上以及含量或比例关系上存在显著差异。指纹图谱作为一种有效的中药质量控制模式,在色谱峰未明确为何种成分的情况下,结合化学模式识别技术仍能给出充分、可靠的信息,再佐以多成分含量测定可用于中药材质量评价[22]。本研究所建立的HPLC 指纹图谱及多成分定量方法具有良好的精密度、重复性和稳定性,简便可靠,分析结果可为艾纳香药材质量控制和优良种质资源选育提供参考依据。
利益冲突所有作者均声明不存在利益冲突
