虎杖苷对高脂喂养的中年LDLr−/−小鼠非酒精性脂肪肝炎的作用及机制研究
2021-06-24吉秋霞许晓乐
吉秋霞,许晓乐
1.南通大学附属海安医院,江苏 南通 226001
2.南通大学药学院 药理系,江苏 南通 226001
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是世界最常见的肝脏疾病,肥胖、2 型糖尿病、高脂血症和高血压在NAFLD 患者中普遍存在,NAFLD 的危险因素与代谢综合征的构成几乎相同[1-2]。NAFLD 是一个复杂的肝病谱,从无症状的脂肪变性发展为具侵略性的坏死炎性反应形式即非酒精性脂肪肝炎(non-alcoholic steatohepatitis,NASH)。NASH 病理表现为不同程度的脂肪变性、细胞骨架损伤(肝细胞气球样变)、小叶炎性反应伴或不伴纤维化,目前尚无药物被批准用于NASH 的治疗。虎杖苷提取自蓼科植物虎杖Polygonum cuspidatumSieb.et Zucc.,是白藜芦醇的前体化合物。虎杖苷能够保护肝脏免受酒精、四氯化碳(CCl4)、半乳糖/果糖过载和蛋氨酸胆碱缺乏饲料喂养引起的肝损伤[3-7]。虎杖苷能够通过恢复溶酶体功能和自噬通量,从而改善蛋氨酸胆碱缺乏饲料喂养的db/db 小鼠模型NASH[8]。本研究旨在探讨虎杖苷对高脂饮食喂养中年(12月龄)低密度脂蛋白受体基因敲除(low-density lipoprotein receptor knockout,LDLr-/-)小鼠形成的代谢综合征模型中NASH 的保护作用及机制,为虎杖苷的临床应用提供依据。
1 材料
1.1 动物
SPF 级雄性LDLr-/-小鼠40 只,5 周龄,购自南京大学模式动物研究所,动物许可证号SCXK(苏)2018-0008。动物于室温(25±2)℃、相对湿度50%~60%、昼夜12 h 交替的环境中饲养,自由进食饮水。动物实验严格按照南通大学实验动物管理法规的规定和总则建议进行,伦理批准号20190105。
1.2 药品与试剂
虎杖苷(批号JZ17021204)、白藜芦醇(批号JZ17110701)购自南京狄尔格生物科技有限公司,质量分数均为98%;含21%脂肪、0.21%胆固醇的高脂饲料购自常州开源饲料有限公司;三酰甘油(triglycerides,TG)检测试剂盒、总胆固醇(total cholesterol,TC)检测试剂盒、游离脂肪酸(free fatty acid,FFA)检测试剂盒、苏木素-伊红(HE)染液、丙二醛(malonaldehyde,MDA)检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、过氧化氢酶(catalase,CAT)检测试剂盒、谷胱甘肽过氧化物酶(glutathion peroxidase,GSH)检测试剂盒、羟脯氨酸(hydroxyproline,HYP)检测试剂盒购自南京建成生物技术有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒、白细胞介素-6(interleukin 6,IL-6)检测试剂盒、组织总蛋白和核蛋白提取试剂盒、BCA 蛋白定量试剂盒、G/A beads 购自江苏海门碧云天生物技术研究所;小鼠胰岛素ELISA 试剂盒购自美国Millipore 公司;腺苷酸活化蛋白激酶(AMPactivated protein kinase,AMPK)抗体、磷酸化AMPK(p-AMPK)抗体、组蛋白H2A 抗体、核因子E2 相关因子(nuclear factor E2-related factor 2,Nrf2)抗体、乙酰化肝激酶B1(liver kinase B1,LKB1)抗体、硬脂酰辅酶 A 去饱和酶 1(stearoyl-CoA desaturase 1,SCD1)抗体购自美国CST 公司;脂肪酸合成酶(fatty acid synthase,FASN)抗体(批号 10624-2-AP)、肉毒碱棕榈酰基转移酶 1α(carnitine palmitoyltransferase 1α,CPT1α)抗体(批号15184-1-AP)、转化生长因子-β(transforming growth factor-β,TGF-β)抗体(批号21898-1-AP)、α 平滑肌动蛋白(α-smooth muscle actin,α-SMA)抗体(批号 55135-1-AP)、α-tublin 抗体(批号11224-1-AP)购自美国ProteinTech 公司;p65 抗体、乙酰化p65 抗体、过氧化物酶体增殖激活受体α(peroxisome proliferator-activated receptor α,PPARα)抗体、sirtuin 1(SIRT1)抗体购自美国Abcam公司;LKB1 抗体、p-LKB1 抗体购自美国Santa cruz公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自康成生物工程有限公司;山羊抗小鼠IgG 抗体购自美国LI-COR 公司。
1.3 仪器
冰冻切片机(美国Beckman Coulter 公司);电泳及转膜系统(美国Bio-Rad 公司);Synergy H1全功能微孔板检测仪(美国Bio-TEK 公司);显微镜(日本Olympus 公司)。
2 方法
2.1 分组、造模与给药
12月龄LDLr-/-小鼠随机分成对照组、模型组、白藜芦醇(200 mg/kg)组和虎杖苷低、高剂量(100、200 mg/kg)组[4-5,8],每组8 只。白藜芦醇溶于0.5%羧甲基纤维素钠配制成质量浓度为20 mg/mL 的溶液,虎杖苷溶于0.5%羧甲基纤维素钠分别配制成质量浓度为10、20 mg/mL 的溶液。对照组给予常规饲料喂养,其余各组给予高脂饲料喂养;各给药组ig 相应药物,对照组和模型组ig 0.5%羧甲基纤维素钠,1 次/d,连续12 周。
2.2 虎杖苷对高脂喂养的中年LDLr−/−小鼠代谢参数的影响
给药结束后,小鼠禁食12 h,自由饮水,称定质量。按试剂盒说明书检测胰岛素水平;采用全自动生化分析仪测定血糖水平;眼眶取血,按试剂盒说明书检测血清中TG、TC 和FFA 水平。
2.3 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织病理变化的影响
末次给药24 h 后,小鼠脱颈椎处死。取各组小鼠肝脏组织,以生理盐水洗涤,于4%多聚甲醛中固定,分别进行油红O 染色、HE 染色和Masson染色,于显微镜下观察并拍照。
2.4 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织脂质水平的影响
取各组小鼠肝脏组织,按试剂盒说明书检测肝脏组织中TG 和TC 水平。
2.5 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织TNF-α 和IL-6 水平的影响
取各组小鼠肝脏组织,按试剂盒说明书检测肝脏组织中TNF-α 和IL-6 水平。
2.6 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织SOD、CAT、GSH 活性以及MDA、HYP 水平的影响
取各组小鼠肝脏组织,按试剂盒说明书检测肝脏组织中SOD、CAT、GSH 活性以及MDA、HYP水平。
2.7 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织乙酰化LKB1 和LKB1 表达的影响
G/A beads 和LKB1 抗体于PBS 溶液(pH=8.2)中4 ℃孵育2 h,用dimethylpimelimidate-Cl 在三乙醇胺(pH 8.2)中悬浮,室温孵育30 min;G/A beads在Tris 缓冲液中悬浮15 min,用含5%聚山梨酯-20的Tris 缓冲液(pH 8.0)洗涤与LKB1 抗体交联的G/A 珠,洗涤3 次,10min/次,4 ℃用封闭溶液悬浮。免疫沉淀珠用裂解缓冲液洗涤4 次,用30 μL十二烷基磺酸钠样品缓冲液洗脱,用乙酰化LKB1和LKB1 抗体进行免疫印迹。
2.8 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织AMPK、p-AMPK、Nrf2、SCD1、FASN、CPT1A、TGF-β、α-SMA、p65、乙酰化p65、PPARα、SIRT1、LKB1 和p-LKB1 蛋白表达的影响
按试剂盒说明书提取肝脏组织总蛋白和核蛋白,按BCA 蛋白定量试剂盒测定蛋白质量浓度,蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,加入封闭液4 ℃孵育过夜;洗涤后,分别加入FASN、SCD1、PPARα、CPT1A、GAPDH、α-tublin、H2A、Nrf2、TGF-β、α-SMA、SIRT1、LKB1、p-LKB1、AMPK、p-AMPK、p65和乙酰化p65 抗体,4 ℃孵育过夜;洗涤后,加入山羊抗小鼠IgG 抗体,室温孵育2 h,洗涤后,采用ODYSEEY 扫描仪显影,并用图像分析系统进行灰度分析。
2.9 统计学分析
3 结果
3.1 虎杖苷对高脂喂养的中年LDLr−/−小鼠代谢参数的影响
如表1所示,与对照组比较,模型组小鼠体质量显著增加(P<0.05),血清中TC、TG 和FFA 水平显著升高(P<0.05),血糖和胰岛素水平均显著增高(P<0.05);与模型组比较,虎杖苷高剂量组和白藜芦醇组小鼠体质量明显降低(P<0.05),各给药组小鼠血清中TC、TG 和FFA 水平均显著降低(P<0.05),虎杖苷高剂量组和白藜芦醇组小鼠血糖和胰岛素水平显著降低(P<0.05)。
表1 虎杖苷对高脂喂养的中年LDLr−/−小鼠代谢参数的影响Table 1 Effect of polydatin on metabolic parameters in middle-aged LDLr−/− mice fed with high-fat

表1 虎杖苷对高脂喂养的中年LDLr−/−小鼠代谢参数的影响Table 1 Effect of polydatin on metabolic parameters in middle-aged LDLr−/− mice fed with high-fat
与对照组比较:#P<0.05;与模型组比较:*P<0.05,下表同#P <0.05 vs control group;*P <0.05 vs model group,same as below tables
组别 剂量/(mg·kg-1)体质量/g TC/(mmol·L-1)TG/(mmol·L-1)FFA/(mmol·L-1)血糖/(mmol·L-1)胰岛素/(ng·mL-1)对照 — 35.13±3.05 18.44±4.17 2.53±0.38 0.76±0.18 7.57±1.70 0.41±0.11模型 — 48.13±4.76# 48.80±6.28# 6.46±1.09# 1.97±0.38# 20.78±5.42# 0.92±0.17#虎杖苷 100 43.61±3.89 37.99±8.06* 4.36±0.69* 1.52±0.29* 18.97±4.03 0.82±0.23 200 38.45±5.57* 28.71±6.18* 3.32±0.50* 1.28±0.29* 12.05±2.70* 0.72±0.12*白藜芦醇 200 41.66±4.88* 36.10±6.16* 3.71±0.47* 1.25±0.27* 11.28±1.38* 0.66±0.16*
3.2 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织病理变化的影响
如图1所示,与对照组相比,模型组小鼠肝脏油红O 染色面积及颜色深度均增加,提示肝脏出现明显脂质聚积;各给药组小鼠肝脏油红O 染色面积及颜色深度均降低。HE 染色结果显示,对照组小鼠肝脏细胞排列整齐,细胞质均匀;模型组小鼠肝脏细胞胞质内存在大量大小不一的脂滴空泡,可见气球样变;各给药组小鼠肝脏病理表现均有所缓解。Masson 染色结果显示,与对照组相比,模型组小鼠肝脏表现出广泛的纤维化;各给药组小鼠肝纤维化明显减轻。
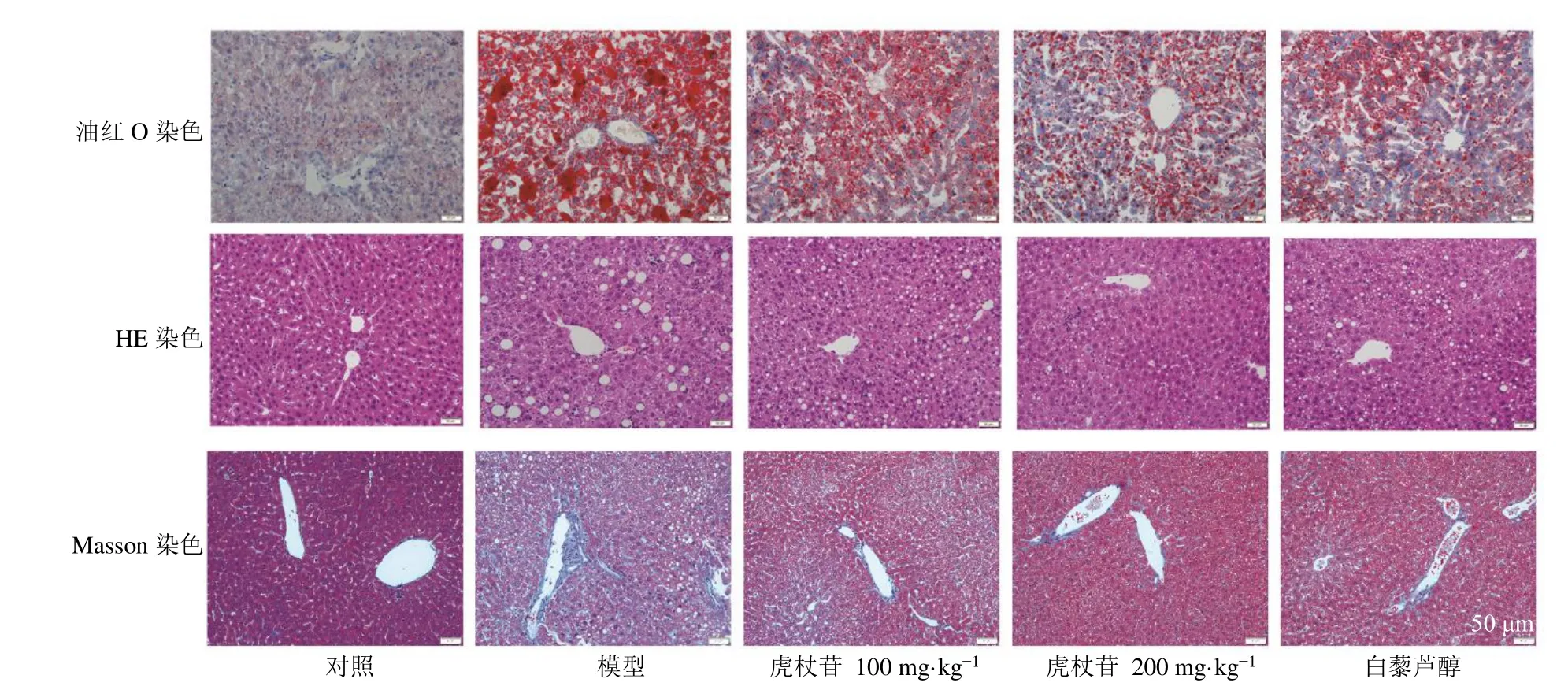
图1 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织病理变化的影响(×200)Fig.1 Effect of polydatin on pathological changes of liver tissue in middle-aged LDLr−/− mice fed with high-fat(× 200)
3.3 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织脂质水平的影响
如图2所示,与对照组比较,模型组小鼠肝脏中TC 和TG 水平显著升高(P<0.05);与模型组比较,各给药组小鼠肝脏中TC 和TG 水平显著降低(P<0.05)。

图2 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织脂质水平的影响Fig.2 Effect of polydatin on lipid levels in liver tissue in middle-aged LDLr−/− mice fed with high-fat
3.4 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织FASN、SCD1、PPARα 和CPT1α 蛋白表达的影响
如图3所示,与对照组比较,模型组小鼠肝脏中FASN 和SCD1 蛋白表达水平显著升高(P<0.05),PPARα 和CPT1α 蛋白表达水平均显著降低(P<0.05);与模型组比较,各给药组小鼠肝脏中FASN 和SCD1 蛋白表达水平显著降低(P<0.05),虎杖苷高剂量组和白藜芦醇组PPARα 和CPT1α 蛋白表达水平显著升高(P<0.05),虎杖苷低剂量组PPARα 蛋白表达水平显著升高(P<0.05)。
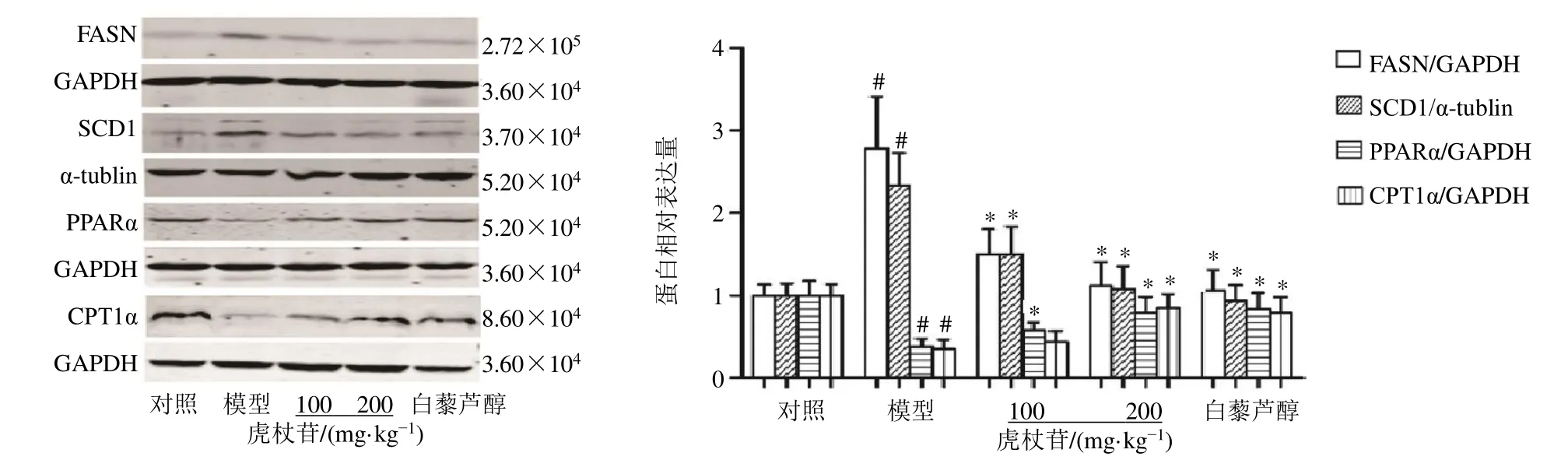
图3 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织FASN、SCD1、PPARα 和CPT1α 蛋白表达的影响Fig.3 Effect of polydatin on expressions of FASN,SCD1,PPARα and CPT1α in liver tissue in middle-aged LDLr−/− mice fed with high-fat
3.5 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织炎性反应、氧化应激和胶原沉积的影响
如表2所示,与对照组比较,模型组小鼠肝脏中TNF-α 和IL-6 水平显著升高(P<0.05),MDA水平显著升高(P<0.05),抗氧化物酶SOD、CAT和GSH 活性显著降低(P<0.05),胶原沉积标志物HYP 水平显著升高(P<0.05);与模型组比较,各给药组小鼠肝脏中TNF-α 和IL-6 水平均显著降低(P<0.05),MDA 水平显著降低(P<0.05),SOD和GSH 活性显著升高(P<0.05);虎杖苷高剂量组和白藜芦醇组小鼠肝脏中CAT 活性显著升高(P<0.05),HYP 水平显著降低(P<0.05)。
表2 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织炎性反应、氧化应激和胶原沉积的影响Table 2 Effect of polydatin on hepatic inflammation,oxidative stress and collagen deposition in liver tissue in middle-aged LDLr−/− mice fed with high-fat

表2 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织炎性反应、氧化应激和胶原沉积的影响Table 2 Effect of polydatin on hepatic inflammation,oxidative stress and collagen deposition in liver tissue in middle-aged LDLr−/− mice fed with high-fat
组别 剂量/(mg·kg-1)TNF-α/(pg·mL-1)IL-6/(pg·mL-1)MDA/(nmol·mg-1)SOD/(U·mg-1)GSH/(U·mg-1)CAT/(U·mg-1)HYP/(μg·mg-1)对照 — 569.25±144.38 1 042.00±226.49 2.10±0.40 142.33±28.56 43.66±8.70 257.36±55.97 0.21±0.05模型 — 1 249.75±229.71# 1 804.13±322.85# 7.55±1.30# 63.41±18.37# 15.11±3.88# 148.79±49.93# 0.54±0.08#虎杖苷 100 953.89±285.11* 1 511.00±350.57* 5.47±1.00* 98.37±19.92* 23.59±3.61* 169.75±30.27 0.40±0.10 200 866.50±170.61* 1 283.38±234.63* 3.68±1.09* 124.28±26.03* 30.15±6.94*# 222.94±37.61* 0.29±0.05*白藜芦醇 200 787.25±137.08* 1 332.25±251.71* 4.27±1.27* 107.43±15.20* 34.08±7.00* 210.52±53.48* 0.34±0.06*
3.6 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织Nrf2 蛋白表达的影响
如图4所示,与对照组比较,模型组小鼠肝脏Nrf2 入核表达显著减少(P<0.05);与模型组比较,各给药组小鼠肝脏Nrf2 入核表达显著增加(P<0.05)。
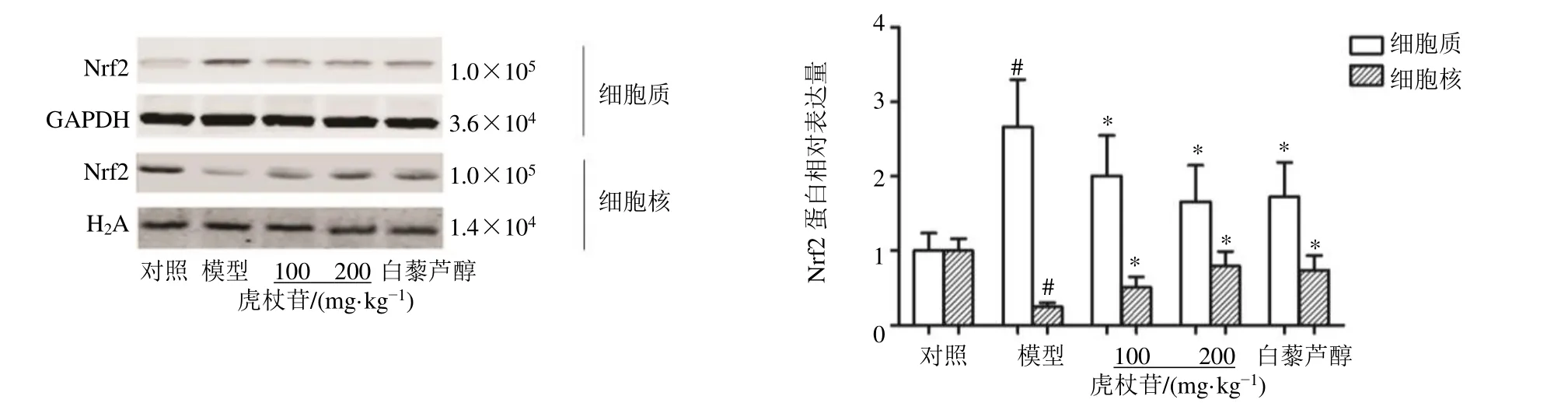
图4 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织Nrf2 蛋白表达的影响Fig.4 Effect of polydatin on Nrf2 expression in liver tissue in middle-aged LDLr−/− mice fed with high-fat
3.7 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织TGF-β 和α-SMA 蛋白表达的影响
如图5所示,与对照组比较,模型组小鼠肝脏中促纤维化关键因子TGF-β 和α-SMA 蛋白表达水平显著升高(P<0.05);与模型组比较,各给药组小鼠肝脏中TGF-β 和α-SMA 蛋白表达水平显著降低(P<0.05)。
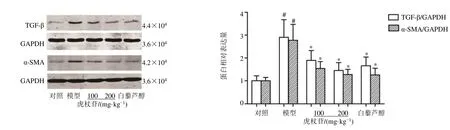
图5 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织TGF-β 和α-SMA 蛋白表达的影响Fig.5 Effect of polydatin on expressions of TGF-β and α-SMA in liver tissue in middle-aged LDLr−/− mice fed with high-fat
3.8 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织中SIRT1 信号通路相关蛋白表达的影响
如图6-A所示,与对照组比较,模型组小鼠肝脏中SIRT1 蛋白表达水平显著降低(P<0.05);与模型组比较,各给药组肝脏中SIRT1 蛋白表达水平显著升高(P<0.05)。SIRT1 主要通过对底物靶点去乙酰化产生作用,且LKB1 调控AMPK。如图6-B所示,与对照组比较,模型组小鼠肝脏LKB1 乙酰化水平显著升高(P<0.05),p-LKB1/LKB1 和p-AMPK/AMPK 蛋白表达水平均显著降低(P<0.05);与模型组比较,虎杖苷高剂量组和白藜芦醇组肝脏LKB1 乙酰化水平显著降低(P<0.05),p-LKB1/LKB1 和p-AMPK/AMPK 蛋白表达水平均显著升高(P<0.05)。如图6-C所示,与对照组比较,模型组p65 乙酰化水平和p65 入核表达均显著升高(P<0.05);与模型组比较,各给药组p65 乙酰化水平和p65 入核表达均显著降低(P<0.05)。
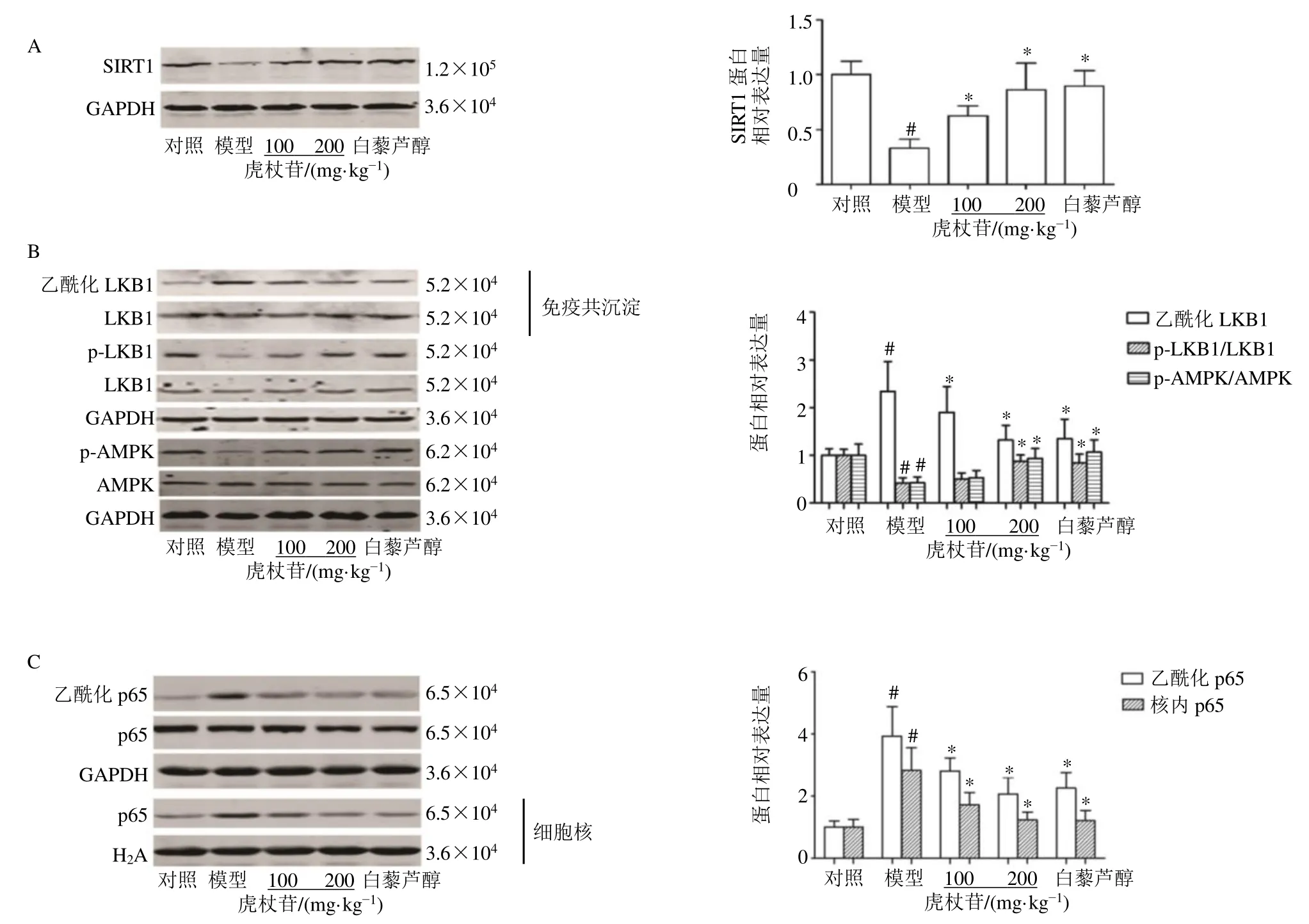
图6 虎杖苷对高脂喂养的中年LDLr−/−小鼠肝脏组织中SIRT1 信号通路相关蛋白表达的影响Fig.6 Effect of polydatin on expressions of SIRT1 signaling related proteins in liver tissue in middle-aged LDLr−/− mice fed with high-fat
4 讨论
NASH 是一种多方面的疾病,由于代谢并发症并存,其治疗复杂。由于大多数NAFLD/NASH 患者伴有代谢综合征,理想的NASH 动物模型应具有与人类NASH疾病发展相似的生理学变化如体质量增加、血脂紊乱、胰岛素抵抗、脂肪细胞因子的释放等,以及与人类NASH 相似的不同阶段中的病理学模式和组织学变化等。常见的NASH 模型为蛋氨酸胆碱缺乏饮食、肝脏化学毒素如CCl4等诱导的动物模型。蛋氨酸胆碱缺乏饮食会诱导动物高代谢和低吞咽,导致血浆TG 水平明显降低、体质量减轻、肝细胞气球状变小;肝脏化学毒素如CCl4也会导致小鼠体质量减轻,与NASH 的病因和病理表现不一致[9-10]。以上模型与以高脂血症、肥胖为主的代谢综合征或糖尿病患者的NASH 有很大不同,近年遗传模型在NASH 研究中被广泛应用,db/db 或ob/ob小鼠会出现代谢综合征和肝脂肪变性,但不会出现肝纤维化和炎性反应[1,9]。基于NASH 与动脉粥样硬化机制的相似性,脂蛋白功能受损的基因小鼠模型被应用于NASH 研究。研究发现,给予中年(12月龄)雄性LDLr-/-小鼠高脂饮食喂养,可以在代谢综合征的背景下发展为NASH,满足5 项人类代谢综合征标准中的4 项,并具有人类NASH 的关键特征如肝脂肪变性、炎性反应、氧化应激和纤维化,且呈年龄相关性[10]。因此,本研究采用高脂喂养的中年LDLr-/-小鼠形成的代谢综合征模型探究虎杖苷对NASH 的作用。
肥胖、血脂异常、空腹血糖升高和胰岛素升高是NASH 患者的主要代谢综合征特征。结果显示,虎杖苷明显抑制高脂饲料喂养的中年LDLr-/-小鼠血脂紊乱,减轻体质量,降低血糖和胰岛素水平,表明虎杖苷能够改善代谢综合征小鼠模型的代谢基础特征参数。NASH 的病理发展涉及多重打击,肝脏脂肪变性使肝细胞易受到其他刺激,从而导致肝脏炎性反应、损伤和纤维化[1,3]。结果显示,高脂饲料喂养的中年LDLr-/-小鼠肝脏出现明显脂肪变性,虎杖苷明显减少肝脏脂肪变性。脂肪酸的从头生成和β-氧化是脂质代谢的2 个关键作用。新生脂肪生成受一系列脂酶如FASN 和SCD1 的调控。PPARα和CPT1α 是脂肪酸β 氧化的2 个关键酶[11]。本研究结果显示,虎杖苷显著降低肝脏中FASN 和SCD1蛋白表达水平,提高PPARα 和CPT1α 蛋白表达水平,提示虎杖苷通过调节脂肪酸的新生脂肪生成和β-氧化,有助于减轻血脂异常和肝脂肪变性。
炎性反应可以通过激活肝星状细胞和纤维化,在NASH 发展中发挥主导作用,为NASH 与肝脏的单纯性脂肪变性的主要区别。结果显示,虎杖苷抑制肝脏炎性因子TNF-α 和IL-6 水平,表明虎杖苷可以改善肝脏炎性反应,有助于抑制NASH 进程。多种内源性和外源性损伤、线粒体呼吸链衰竭、抗氧化元素如SOD、CAT 活性或脂质过氧化水平升高的过度生成,能够导致持续性肝损伤、凋亡、炎性反应和纤维化。结果显示,虎杖苷抑制中年LDLr-/-小鼠肝脏脂质过氧化的最终产物MDA 水平,增强肝脏抗氧化应激的主要抗氧化酶SOD、GSH 和CAT活性。Nrf2 是抗氧化机制的关键调节器,作用于多种抗氧化物酶,为潜在的治疗NAFLD/NASH 的靶点[12]。结果显示,虎杖苷能够促进Nrf2 入核表达,从而增加抗氧化酶活性。在炎性反应和慢性肝损伤过程中,肝星状细胞通过产生异常数量的细胞外基质而被激活,并向肌纤维样细胞转化,从而导致肝纤维化。本研究结果显示,虎杖苷显著抑制肝脏胶原沉积和纤维化相关蛋白TGF-β 和α-SMA 表达,从而抑制肝脏纤维化。
SIRT1 是肝脏脂质代谢、氧化应激和炎性反应的重要调节因子,可以预防和改善NAFLD/NASH的特征[13]。SIRT1 激活剂白藜芦醇能够通过SIRT1介导的信号转导途径改善NAFLD[14]。结果显示,虎杖苷显著增强高脂喂养中年LDLr-/-小鼠肝脏中SIRT1 蛋白表达水平。SIRT1 作为1 种依赖于NAD+的脱乙酰化酶,催化组蛋白的脱乙酰化,也能够使非组蛋白底物去乙酰化。LKB1 和核因子-κB(nuclear factor-κB,NF-κB)是由SIRT1 介导的去乙酰化调节代谢和细胞应激反应的转录调节因子。SIRT1 通过在Lys48 处使LKB1 去乙酰而作用于AMPK 信号的上游,并激活LKB1,导致p-AMPK表达增加[13-14]。AMPK 是肝脏脂质代谢的重要调节因子,AMPK 的激活能够抑制下游靶点FASN 和SCD1,从而抑制脂肪的从头合成;AMPK 的激活可以增强CPT1 表达,增加肝脏脂肪酸β-氧化;AMPK 调节脂肪酸β-氧化的另 1 个重要分子PPARα[11]。因此,SIRT1/LKB1/AMPK 通路在肝细胞脂质代谢中起重要作用。结果显示,虎杖苷显著增强LKB1 去乙酰化水平和AMPK 磷酸化水平,从而抑制AMPK 靶基因FASN 和SCD1 参与脂肪的从头生成,促进PPARα 和CPT1α 参与脂肪酸β 氧化,改善肝脏脂肪代谢、减轻肝脏脂肪变性。NF-κB 是炎性反应的主要调节因子,RelA/p65 是NF-κB 最常见的杂二聚体。SIRT1 能够使RelA/p65 亚基的赖氨酸310 去乙酰,促进p65/p50 复合物结合,使NF-κB转录活性失活,抑制其促炎靶基因的表达[15]。结果显示,虎杖苷降低p65 乙酰化水平,即增加了p65的去乙酰化,从而抑制p65 入核表达,抑制炎性反应。Nrf2 与AMPK、NF-κB 信号通路相互影响[16-17],虎杖苷对Nrf2 的调控可能与其对AMPK 和NF-κB信号通路的调控密切相关。
综上所述,本研究发现虎杖苷能够减轻高脂喂养的中年LDLr-/-小鼠形成的代谢综合征模型中NASH,即改善代谢参数、脂肪变性、炎性反应、氧化应激和纤维化,以上作用可能与肝脏SIRT1 的激活有关。虎杖苷能够通过调控肝脏脂质代谢相关蛋白如p-AMPK、FASN、SCD1、PPARα、CPT1表达减轻肝脏脂肪变性,通过增强Nrf2 抗氧化信号通路减轻肝脏氧化应激,通过抑制转录因子p65 活化减轻肝脏炎性反应,通过抑制促纤维化关键蛋白TGF-β 和α-SMA 表达减轻肝脏纤维化。
利益冲突所有作者均声明不存在利益冲突
