TPGS修饰的地榆皂苷I长循环脂质体的制备及质量评价
2021-06-24宋婷婷蔡荣珊刘月伍振峰徐应淑熊永爱
宋婷婷,蔡荣珊,王 宏,刘月,伍振峰,杨 明,徐应淑*,熊永爱*
1.遵义医科大学药学院,贵州 遵义 563000
2.江西中医药大学 中药制剂教育部重点实验室,江西 南昌 330004
放化疗仍然是目前治疗癌症的主要手段,但其引起的骨髓抑制常导致患者造血功能下降、免疫力降低,阻碍放化疗的顺利进行[1]。地榆皂苷I是地榆预防和治疗骨髓抑制的关键成分[2-4],然而其溶解性差、体内半衰期短,限制了其药效的发挥[5]。聚乙二醇1000 维生素E 琥珀酸酯(D-α-tocopherol polyethylene glycol 1000 succinate,TPGS)具有增加疏水性药物溶解度和包封率、延长体内半衰期等功能[6]。TPGS 修饰的脂质体还能避免被网状内皮系统吞噬,延长脂质体循环时间[7]。本研究旨在制备TPGS 修饰的地榆皂苷I长循环脂质体,优化操作工艺条件,并对其形貌、粒径、药物释放特性等进行表征,以评价其稳定性和适用性。
1 仪器与材料
Agilent 1260 高效液相色谱仪,安捷伦科技有限公司;ME204E 电子天平,梅特勒-托利多仪器上海有限公司;90Plus PALS 激光粒度仪,美国布鲁克海文仪器公司;TL-650Y 超声波细胞破碎仪,江苏天翎仪器有限公司;RE-52AA 旋转蒸发器,上海亚荣生化仪器厂;JEM-1200EX 透射电镜,日本电子株式会社;TG18 微量高速离心机,长沙维尔康湘鹰离心机有限公司;SHZ-82A 数显恒温振荡器,金坛市朗博仪器制造有限公司;超滤离心管,美国Millipore 公司,截留相对分子质量为10 000;透析袋,截留相对分子质量为8000~14 000,北京索莱宝科技有限公司。
地榆皂苷I,实验室自制,质量分数91.76%;地榆皂苷I对照品,批号MUST-17022502,质量分数99.47%,成都曼思特生物科技有限公司;大豆磷脂S100,德国Lipoid 公司;聚乙二醇1000 维生素E 琥珀酸酯、DL-α-生育酚,上海阿拉丁试剂有限公司;胆固醇,上海阿达玛斯试剂有限公司;甲醇、乙腈,HPLC 级;纯化水;氯仿、聚山梨酯80 等均为分析纯。
2 方法与结果
2.1 地榆皂苷I 分析方法的建立
2.1.1 色谱条件 采用HPLC 法测定地榆皂苷I含量,Unitary C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水(35∶65);体积流量1.0 mL/min;柱温30 ℃;检测波长203 nm;进样量10 μL,采用外标法进行含量测定。
2.1.2 专属性考察 精密称定地榆皂苷I对照品12.5 mg 置于25 mL 量瓶中,加入适量甲醇超声溶解并稀释至刻度,配制成质量浓度为0.5 mg/mL 的对照品储备液。精密量取适量地榆皂苷I对照品储备液,加甲醇稀释至质量浓度为0.25 mg/mL,即得地榆皂苷I对照品溶液。取TPGS 修饰的地榆皂苷I长循环脂质体混悬液0.5 mL,加适量甲醇破乳,超声得到澄清透明溶液,表明已经破乳完全,经0.22 μm 滤膜滤过,即得供试品溶液。取空白脂质体,同法制备阴性对照溶液。以阴性对照溶液作为空白对照,分别对对照品溶液及供试品溶液按照“2.1.1”项色谱条件进样分析,记录色谱图(图1)。结果表明,溶剂和辅料对地榆皂苷I测定无干扰,对照品溶液与供试品溶液的峰形良好,出峰时间一致,表明该测定方法专属性良好。
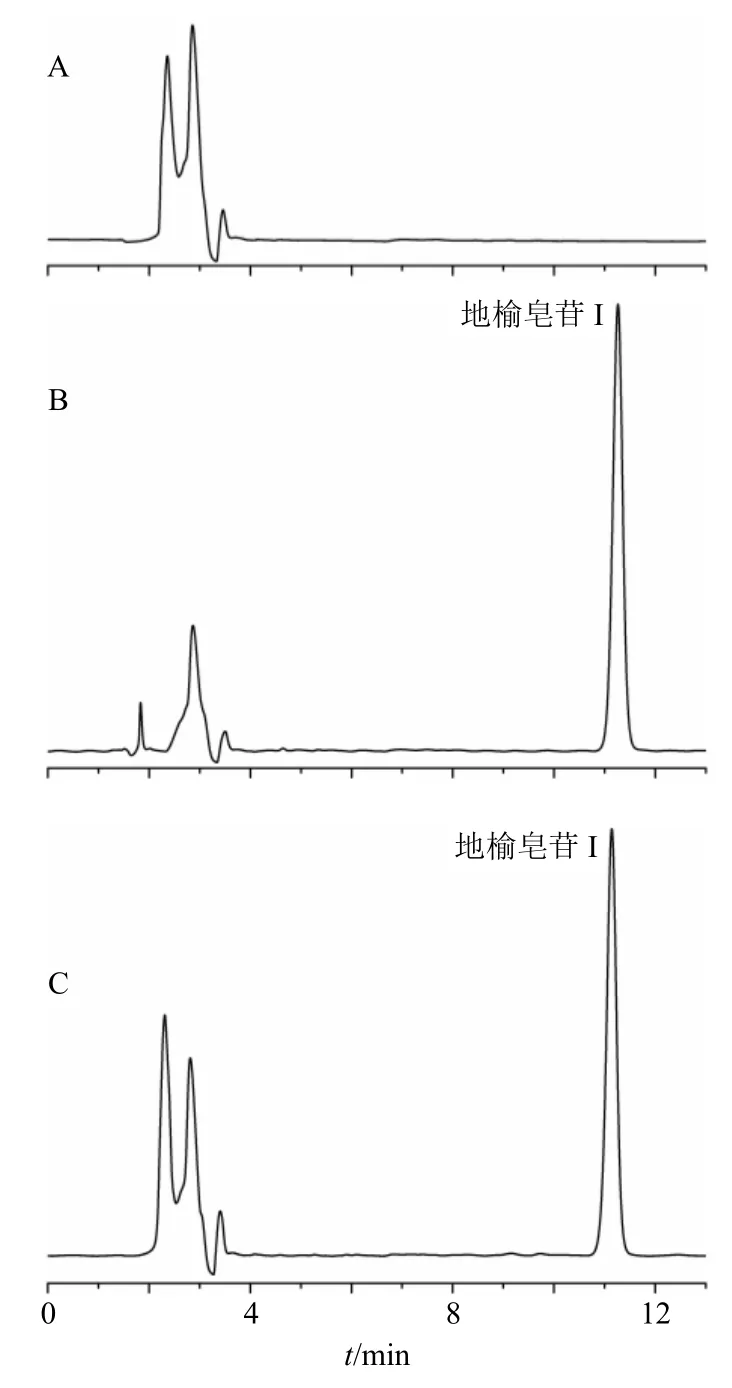
图1 阴性对照(A)、地榆皂苷I 对照品(B)和地榆皂苷I 长循环脂质体供试品(C)的HPLC 图Fig.1 HPLC spectrum of negative samples(A),ziyuglycoside I reference substances(B)and ziyuglycoside I long-circulating liposomes sample(C)
2.1.3 线性关系考察 分别精密量取适量地榆皂苷I对照品储备液,加甲醇稀释成质量浓度为5.0、10.0、25.0、50.0、75.0、100.0、250.0 μg/mL 的溶液。按“2.1.1”项色谱条件进样。以峰面积(Y)对地榆皂苷I质量浓度(X)进行线性回归,标准曲线为Y=1.329 2X+2.622 8,r=0.999 8。结果表明,地榆皂苷I在质量浓度5.0~250.0 μg/mL 呈良好的线性关系。
2.1.4 精密度考察 精密量取适量的地榆皂苷I对照品储备液,加适量甲醇配制低、中、高(5、50、250 μg/mL)3 个质量浓度的对照品溶液。按“2.1.1”项色谱条件,每日各进样5 次,连续测定5 d,考察日内、日间精密度。结果测得低、中、高3 个质量浓度对照品溶液的日内精密度分别为 0.83%、1.17%、0.92%,日间精密度分别为1.47%、1.13%、0.98%。
2.1.5 加样回收率考察 于0.5 mL 空白脂质体混悬液中分别精密加入适量地榆皂苷I对照品溶液,然后加甲醇破乳,配制成质量浓度为5、50、250 μg/mL 的供试品溶液,各供试品溶液平行制备3 份,进样分析,计算回收率。结果低、中、高3 个质量浓度的平均回收率分别为 101.14%、98.72%、99.82%,RSD 分别为1.34%、1.25%、0.58%。
2.2 地榆皂苷I 的提取及含量测定
采用3 步碱沉法[8]提取地榆皂苷I,将纯化得到的地榆皂苷I按“2.1.1”项下HPLC 色谱条件进样分析,测定其含量。结果提取得到的地榆皂苷I质量分数为91.76%。
2.3 地榆皂苷I 脂质体的制备
采用薄膜分散法[9]制备包载地榆皂苷I的普通脂质体和TPGS 包衣脂质体。将处方量的地榆皂苷I、大豆磷脂、胆固醇和维生素E(含或不含TPGS)溶解在氯仿-甲醇(2∶1)混合溶剂中,置于干燥茄形瓶中,超声溶解以获得澄清溶液,在37 ℃恒温水浴中减压旋蒸以完全除去有机溶剂,在瓶壁上形成均匀透明的脂质薄膜,然后加入pH 7.4 的磷酸盐缓冲液5 mL,37 ℃常压水合2 h,充分振摇至水合完全,经探头超声处理,以35%功率(总功率为650 W)超声2 min(超声3 s,间隔3 s,温度过高时可用冰浴降温),最终得到带淡蓝色乳光的脂质体,储存在4 ℃冰箱中。
2.4 超滤离心法测定包封率
2.4.1 超滤膜吸附回收率的测定 配制质量浓度分别为166.7、81.7、37.7 μg/mL 的地榆皂苷I溶液,从3种不同质量浓度溶液中各取400 μL至超滤离心管中,7 000×g离心20 min,收集滤液,不更换超滤单元,再分别同法超滤3 次。将超滤前后的药液按“2.1.1”项色谱条件进样分析,计算超滤膜吸附回收率。由结果(表1)可知,在各个质量浓度下第2 份滤液的回收率符合要求,因此,可选择饱和2 次后的超滤膜分离脂质体与游离药物。
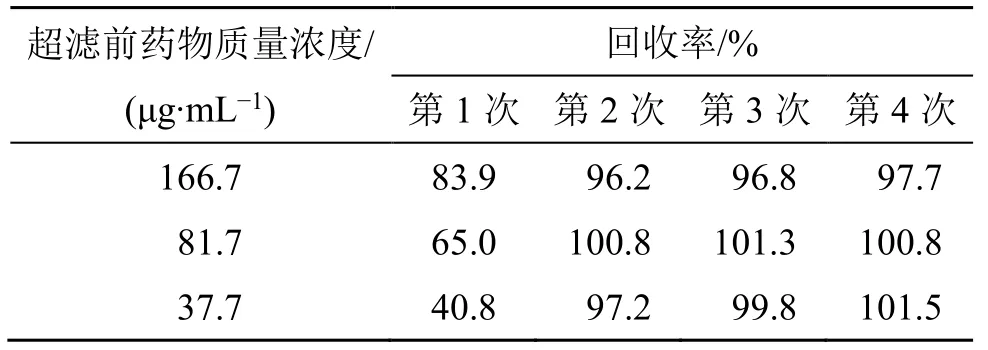
表1 超滤膜吸附回收率的测定Table 1 Determination of adsorption recovery of ultrafiltration membrane
2.4.2 包封率和载药量的测定 取过0.22 μm 滤膜的脂质体混悬液200 μL 至超滤离心管中,7 000×g离心20 min,将超滤液加甲醇稀释至1 mL,按“2.1.1”项色谱条件进样分析,计算游离药物含量(m2)。同时取未经超滤的地榆皂苷I脂质体混悬液,按“2.1.2”项下操作破乳,测定药物含量,计为总药量(m1)。脂质体中包载药物和投入脂质的总量为m3,按公式计算药物包封率和载药量。
包封率=(m1-m2)/m1
载药量=(m1-m2)/m3
2.5 地榆皂苷I 长循环脂质体处方优化
2.5.1 单因素实验 影响地榆皂苷I长循环脂质体制备过程的因素很多,本研究通过单因素实验初步考察了大豆磷脂与胆固醇质量比、TPGS 物质的量百分比、药物与大豆磷脂质量比和超声条件(超声功率与时间)对地榆皂苷I长循环脂质体粒径和包封率的影响。
(1)大豆磷脂与胆固醇质量比对地榆皂苷I长循环脂质体粒径和包封率的影响:固定处方中大豆磷脂S100 为30 mg,TPGS 物质的量百分比为6%,药物与大豆磷脂质量比为1∶4,30%超声功率,超声2 min。精密称取处方量的成膜材料,按“2.3”项下地榆皂苷I脂质体的制备方法制备脂质体,考察大豆磷脂与胆固醇质量比(6∶1、4∶1、3∶1、2∶1)对脂质体粒径和包封率的影响。结果(表2)表明,当大豆磷脂与胆固醇质量比为4∶1 时,包封率较高,粒径最小。胆固醇的加入可以提高脂质膜的稳定性,减少泡囊内包封药物的泄露,但过量的加入会使膜的形成变得困难。最终选择大豆磷脂与胆固醇质量比为4∶1 进行后续的单因素实验。
表2 大豆磷脂与胆固醇质量比对地榆皂苷I 长循环脂质体粒径和包封率的影响(,n=3)Table 2 Effects of mass ratio of soybean phospholipid to cholesterol on particle size and encapsulation efficiency of ziyuglycoside I long-circulating liposomes(,n=3)
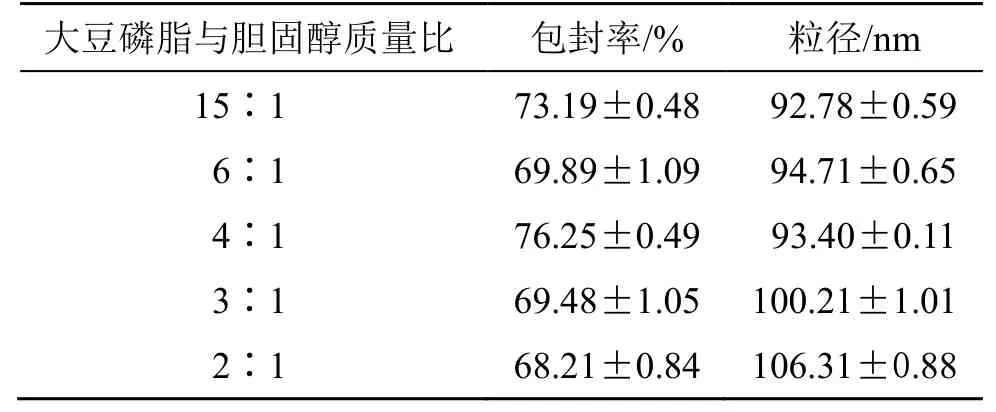
表2 大豆磷脂与胆固醇质量比对地榆皂苷I 长循环脂质体粒径和包封率的影响(,n=3)Table 2 Effects of mass ratio of soybean phospholipid to cholesterol on particle size and encapsulation efficiency of ziyuglycoside I long-circulating liposomes(,n=3)
大豆磷脂与胆固醇质量比 包封率/% 粒径/nm 15∶1 73.19±0.48 92.78±0.59 6∶1 69.89±1.09 94.71±0.65 4∶1 76.25±0.49 93.40±0.11 3∶1 69.48±1.05 100.21±1.01 2∶1 68.21±0.84 106.31±0.88
(2)TPGS 物质的量百分比对地榆皂苷I长循环脂质体粒径和包封率的影响:固定处方中其他辅料的用量和制备条件,精密称取处方量的成膜材料,按“2.3”项下地榆皂苷I脂质体的制备方法制备脂质体,考察TPGS 物质的量百分比(3%、6%、10%)对脂质体粒径和包封率的影响。结果(表3)表明,当TPGS 物质的量百分比为10%时,包封率较高,粒径较小。可能是因为TPGS 修饰脂质体后,会在脂质体表面形成一层水化层,减小脂质体表面张力,阻止了脂质体的聚集和融合,使粒子更稳定,从而提高药物包封率,减小脂质体的粒径[10]。因此,选择TPGS 物质的量百分比为10%进行单因素实验。
表3 TPGS 物质的量百分比对地榆皂苷I 长循环脂质体粒径和包封率的影响(,n=3)Table 3 Effects of molar percentage of TPGS on particle size and encapsulation efficiency of ziyuglycoside I longcirculating liposomes(,n=3)
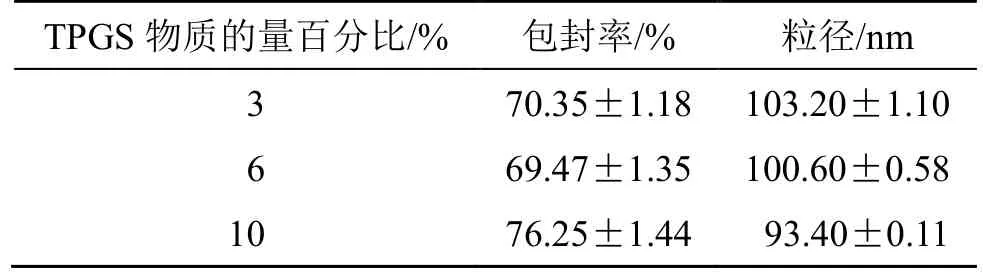
表3 TPGS 物质的量百分比对地榆皂苷I 长循环脂质体粒径和包封率的影响(,n=3)Table 3 Effects of molar percentage of TPGS on particle size and encapsulation efficiency of ziyuglycoside I longcirculating liposomes(,n=3)
TPGS 物质的量百分比/% 包封率/% 粒径/nm 3 70.35±1.18 103.20±1.10 6 69.47±1.35 100.60±0.58 10 76.25±1.44 93.40±0.11
(3)药物与大豆磷脂质量比对地榆皂苷I长循环脂质体粒径和包封率的影响:固定处方中其他辅料的用量和制备条件,精密称取处方量的成膜材料,按“2.3”项下地榆皂苷I脂质体的制备方法制备脂质体,考察药物与大豆磷脂质量比(1∶20、1∶6、1∶4、1∶3、1∶2)对脂质体粒径和包封率的影响。由表4 可知,药物与大豆磷脂质量比对脂质体的粒径和包封率的影响较大。当药物与大豆磷脂质量比从1∶20 变为1∶2 时,包封率降低,可通过包封地榆皂苷I的脂质体囊泡体积有限来解释。药物与大豆磷脂质量比的增加导致平均粒径的增加,可能是因为药物浓度越大,超声分散的机械力越大。当药物与大豆磷脂质量比为1∶20 时,包封率较高,但载药量较低,考虑到后续药动学以及药效学实验,选择1∶6~1∶2 进一步筛选,选择药物与大豆磷脂质量比为1∶4 进行单因素实验。
表4 药物与大豆磷脂质量比对地榆皂苷I 长循环脂质体粒径和包封率的影响(,n=3)Table 4 Effects of mass ratio of drug to soybean phospholipid on particle size and encapsulation efficiency of ziyuglycoside I long-circulating liposomes(,n=3)
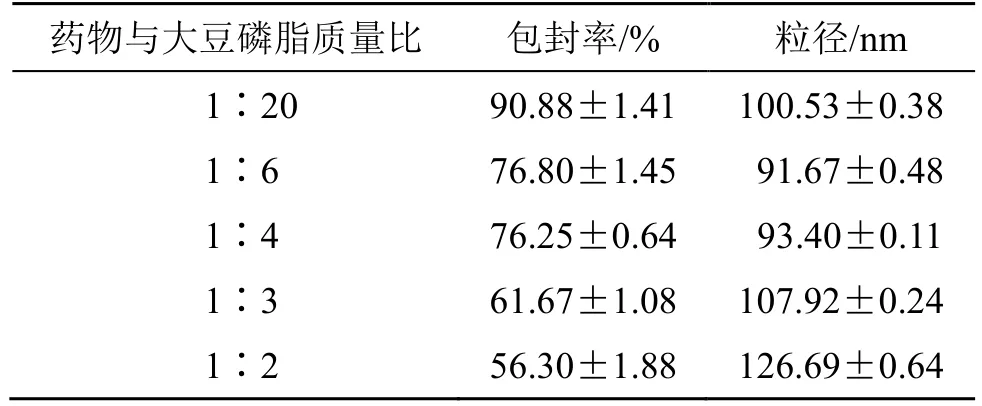
表4 药物与大豆磷脂质量比对地榆皂苷I 长循环脂质体粒径和包封率的影响(,n=3)Table 4 Effects of mass ratio of drug to soybean phospholipid on particle size and encapsulation efficiency of ziyuglycoside I long-circulating liposomes(,n=3)
药物与大豆磷脂质量比 包封率/% 粒径/nm 1∶20 90.88±1.41 100.53±0.38 1∶6 76.80±1.45 91.67±0.48 1∶4 76.25±0.64 93.40±0.11 1∶3 61.67±1.08 107.92±0.24 1∶2 56.30±1.88 126.69±0.64
(4)超声条件对地榆皂苷I长循环脂质体粒径和包封率的影响:固定处方中其他辅料的用量和制备条件,精密称取处方量的成膜材料,按“2.3”项下地榆皂苷I脂质体的制备方法制备脂质体,考察超声条件(30%功率、2 min,35%功率、2 min,30%功率、3 min,35%功率、3 min)对脂质体粒径和包封率的影响。由结果(表5)可知,当30%超声功率(总功率为650 W),超声时间从2 min 增加到3 min 时,平均粒径减小,包封率变化不大。当35%超声功率、超声时间为2 min 时,脂质体的包封率较高,粒径较小。最终结果表明,超声条件对脂质体的粒径和包封率影响不大,选择超声条件为超声功率35%,超声2 min 制备脂质体。
表5 超声条件对地榆皂苷I 长循环脂质体粒径和包封率的影响(,n=3)Table 5 Effects of ultrasonic conditions on particle size and encapsulation efficiency of ziyuglycoside I longcirculating liposomes(,n=3)
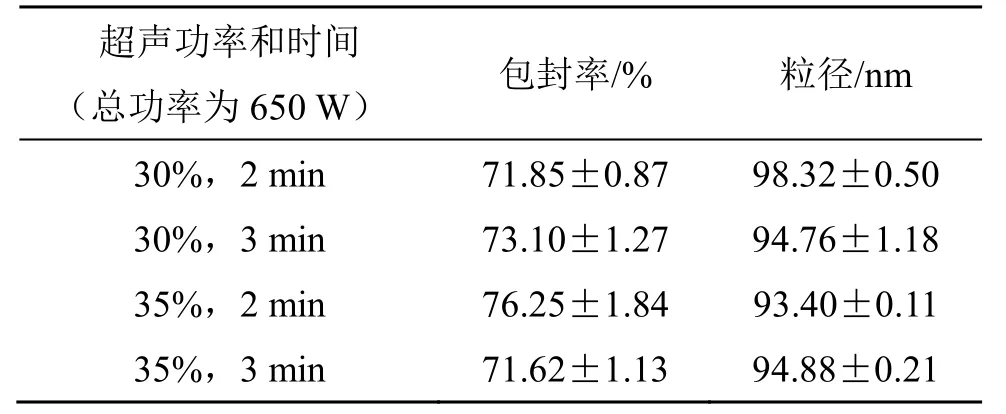
表5 超声条件对地榆皂苷I 长循环脂质体粒径和包封率的影响(,n=3)Table 5 Effects of ultrasonic conditions on particle size and encapsulation efficiency of ziyuglycoside I longcirculating liposomes(,n=3)
超声功率和时间(总功率为650 W) 包封率/% 粒径/nm 30%,2 min 71.85±0.87 98.32±0.50 30%,3 min 73.10±1.27 94.76±1.18 35%,2 min 76.25±1.84 93.40±0.11 35%,3 min 71.62±1.13 94.88±0.21
2.5.2 Box-Behnken 响应面分析 在单因素实验的基础上,确定了显著变量及其优选水平,因素水平见表6。通过Box-Behnken 响应面分析法对大豆磷脂与胆固醇质量比(X1)、药物与大豆磷脂质量比(X2)、TPGS 物质的量百分比(X3)3 个自变量进行处方优化,以地榆皂苷I长循环脂质体包封率(Y)为响应值进行考察。实验设计和结果见表6。
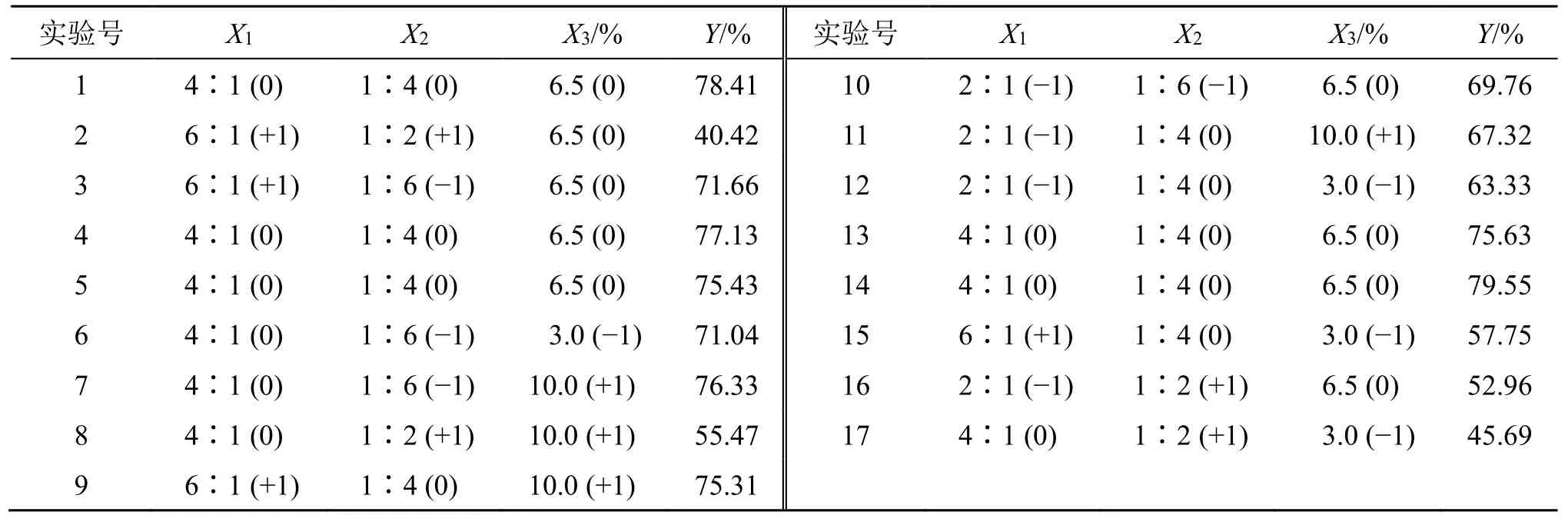
表6 Box-Behnken 实验设计和结果Table 6 Box-Behnken experiment design and results
结果通过Design expert 10.04 软件进行数据拟合分析。回归方程为Y=77.23-1.03X1-11.78X2+4.58X3-3.61X1X2+3.39X1X3+1.12X2X3-7.37X12-11.16X22-3.93X32,R2=0.983 0。P值表示因变量和自变量之间线性关系的显著性,回归方程的方差分析结果见表7。由显著性结果可知,X3、X1X2、X1X3、X12、X32对包封率影响显著,X2、X22对包封率的影响非常显著。自变量及其相互作用对包封率的影响见图2所示的响应面曲线。模型的概率P<0.000 1,表明模型极显著,方程的响应值与自变量间线性关系显著,且方程的失拟项F值为2.86(P>0.05)不显著,说明该回归方程在整个回归区域的拟合情况良好,回归模型具有良好的预测性。

表7 包封率回归方程的方差分析Table 7 Variance analysis of entrapment efficiency regression equation

图2 以包封率为指标的三维响应面曲线图Fig.2 Three-dimensional response surface curve with encapsulation efficiency as an indicator
根据分析结果得出地榆皂苷I长循环脂质体的最佳处方条件为大豆磷脂与胆固醇的质量比为4.6∶1;药物与大豆磷脂质量比为1∶5;TPGS 物质的量百分比为7.8%。根据最优条件进行处方验证,测得平均包封率为79.89%(n=3),接近理论包封率80.59%(n=3),平均载药量为10.48%(n=3)。
2.6 表征
2.6.1 微观形态 取少量TPGS 修饰的地榆皂苷I长循环脂质体混悬液,用蒸馏水稀释至一定浓度,并将1 滴脂质体样品滴至铜网表面,真空干燥,用1%磷钨酸溶液负染30 s,最后用透射电镜观察脂质体的微观形态。结果显示,TPGS 修饰的地榆皂苷I长循环脂质体呈球形或类球形双层结构,粒子间无聚集现象,分布较均匀(图3)。
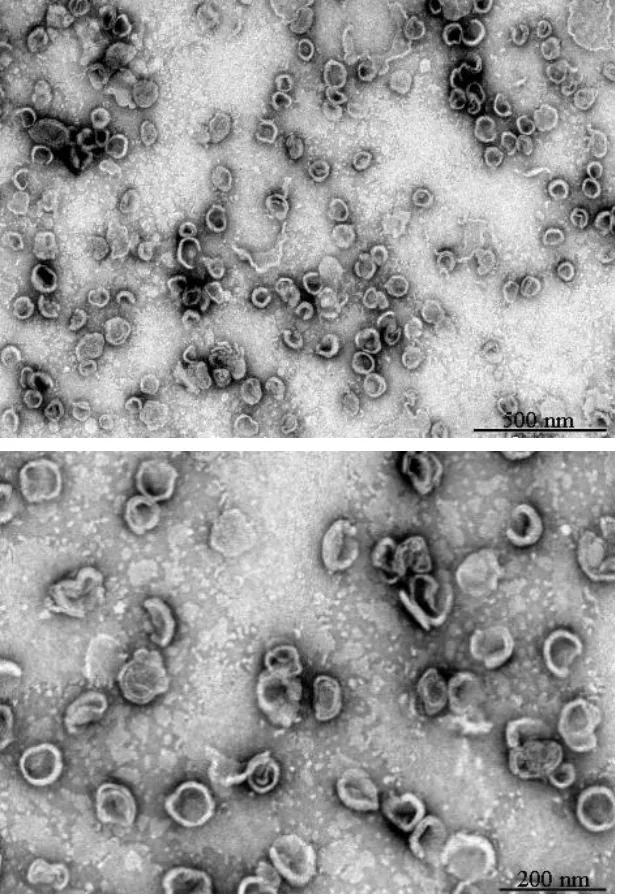
图3 TPGS修饰的地榆皂苷I长循环脂质体透射电镜图Fig.3 Micromorphology of TPGS modified ziyuglycoside I long-circulating liposomes
2.6.2 粒径及Zeta 电位测定 取脂质体样品,用去离子水稀释10 倍至计数率约为500 kcps,采用激光粒度仪测定脂质体粒径、多分散性和Zeta 电位。Zeta 电位是衡量电荷量的重要指标,通常较高的Zeta 电位(绝对值大于30 mV),表示系统更稳定[11]。结果测得TPGS 修饰的地榆皂苷I长循环脂质体的粒径为(95.79±0.81)nm,多分散系数(PDI)为0.048±0.007,说明脂质体的粒径分布比较均匀,可能是TPGS 所含有的PEG 链在脂质体表面形成了亲水性保护层,使脂质体更稳定,均一性提高[12](图4)。Zeta 电位为(-38.60±0.97)mV,说明TPGS修饰的地榆皂苷I长循环脂质体表面荷负电,带电脂质体可以减少聚集和融合,增加稳定性(图5)。脂质体的理化参数见表8。
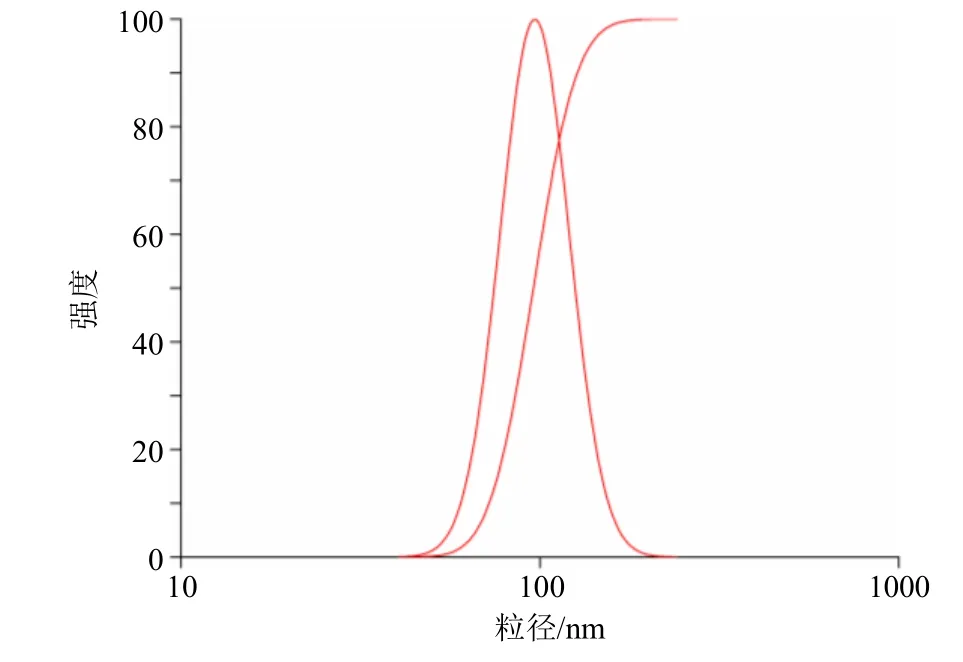
图4 TPGS修饰的地榆皂苷I长循环脂质体粒径分布Fig.4 Particle size distribution of TPGS modified ziyuglycoside I long-circulating liposomes

图5 TPGS修饰的地榆皂苷I长循环脂质体电位Fig.5 Potential of TPGS modified ziyuglycoside I long-circulating liposomes
表8 脂质体理化参数(,n=3)Table 8 Physical and chemical parameters of liposomes(,n=3)
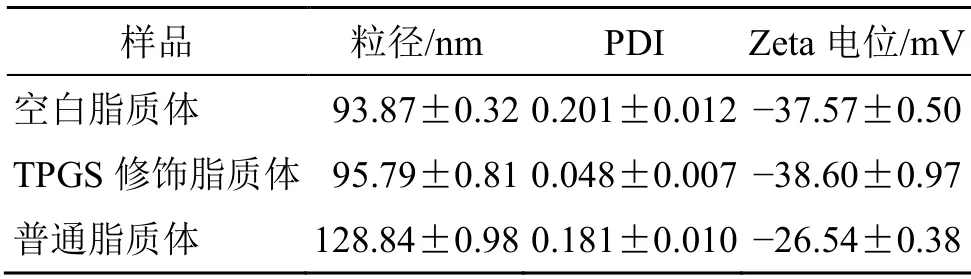
表8 脂质体理化参数(,n=3)Table 8 Physical and chemical parameters of liposomes(,n=3)
样品 粒径/nm PDI Zeta 电位/mV空白脂质体 93.87±0.32 0.201±0.012-37.57±0.50 TPGS 修饰脂质体 95.79±0.81 0.048±0.007-38.60±0.97普通脂质体 128.84±0.98 0.181±0.010-26.54±0.38
2.6.3 稳定性考察 将测定包封率后的脂质体储存在4 ℃冰箱中,分别于储存的第10、20、30 天取出,观察外观,并测定脂质体的包封率、粒径和Zeta电位,考察样品的稳定性。结果表明,TPGS 修饰的地榆皂苷I脂质体在4 ℃环境中放置30 d,脂质体外观性状无明显变化,溶液仍呈均一、稳定状态。平均粒径、PDI、Zeta 电位和药物包封率结果见表9,变化幅度较小,表明该脂质体样品在低温(4 ℃)条件下放置30 d 稳定性良好。
表9 脂质体稳定性考察结果(,n=3)Table 9 Results of liposome stability(,n=3)
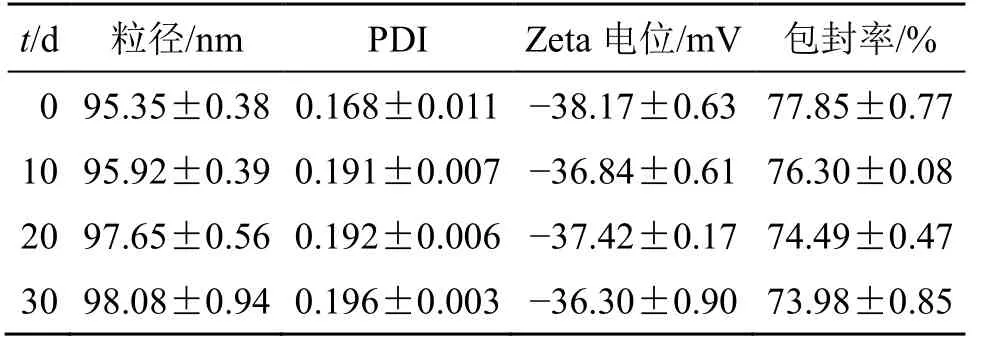
表9 脂质体稳定性考察结果(,n=3)Table 9 Results of liposome stability(,n=3)
t/d 粒径/nm PDI Zeta 电位/mV 包封率/%0 95.35±0.38 0.168±0.011-38.17±0.63 77.85±0.77 10 95.92±0.39 0.191±0.007-36.84±0.61 76.30±0.08 20 97.65±0.56 0.192±0.006-37.42±0.17 74.49±0.47 30 98.08±0.94 0.196±0.003-36.30±0.90 73.98±0.85
2.6.4 体外释放度 采用透析袋扩散法[13]考察地榆皂苷I脂质体的体外释放情况。精密移取质量浓度为1.5 mg/mL 的地榆皂苷I脂质体、TPGS 修饰的地榆皂苷I长循环脂质体、地榆皂苷I甲醇溶液各1 mL,分别装入经预处理的透析袋中。将透析袋密封并浸入30 mL 含0.5 mg/mL 聚山梨酯80 的PBS 溶液中(pH 7.4),温度为(37.0±0.5)℃,以100 r/min恒温振荡。分别于0.5、1、2、4、6、8、10、12、24、36、48 h 取出1 mL 释放介质,过0.22 μm 滤膜于进样小瓶中,同时补充等温等体积的释放介质。样品中药物质量浓度按上述HPLC 法测定,并按公式计算不同时间点的药物累积释放率(Q),绘制累积释放曲线。
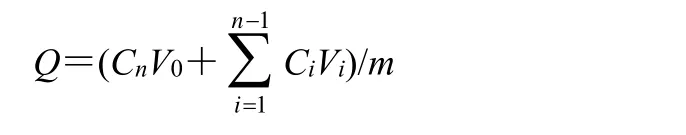
V0为释放介质总体积(mL),Ci和Cn为第i、n时间点取样时测得的药物质量浓度(mg/mL),V为取样体积(mL),m表示样品中地榆皂苷I的总质量
图6 显示了游离地榆皂苷I溶液、地榆皂苷I脂质体和TPGS 修饰的地榆皂苷I长循环脂质体在含0.5%聚山梨酯80 的PBS 溶液中的累积释放率。相比于游离地榆皂苷I溶液,2 种地榆皂苷I脂质体均表现出一定的缓释特性。24 h 后,地榆皂苷I脂质体和TPGS 修饰的地榆皂苷I脂质体的累积释放率分别为73.53%、75.89%,达到最大累积释放量,之后释放趋于平缓。而游离地榆皂苷I溶液在12 h后的累积释放率达到90%以上。两种脂质体显示出控制释放超过1 d,没有检测到药物的突释现象,这表明药物不位于脂质体表面,而是位于其核心。据报道,TPGS 影响纳米粒子药物释放系统的释放行为,药物的持续释放可归因于脂质体载体材料的延迟扩散。

图6 游离地榆皂苷I 溶液、地榆皂苷I 脂质体和TPGS修饰的地榆皂苷I长循环脂质体的体外释放曲线Fig.6 In vitro release curve of free ziyuglycoside I,ziyuglycoside I liposomes and TPGS modified ziyuglycoside I long-circulating liposomes
3 讨论
本实验采用薄膜分散法制备TPGS 修饰的地榆皂苷I长循环脂质体,操作简便,易获得形貌和粒径较好的样品。在薄膜分散法中,磷脂的水化是很关键的步骤,在分散过程中,干燥的磷脂膜之间发生了有规律的重排。加入水相后,有序的磷脂层从壁上脱离从而卷曲形成脂质体[14],其中水化温度和水化时间的控制对样品能否成功制备至关重要,水化温度必须高于磷脂的相转变温度。经过预实验,最终确定的水化温度为37 ℃,水化时间为2 h,结果表明该条件下磷脂水化很充分,所制备的样品粒度均匀,久置无沉淀产生。最终制得的TPGS 修饰的地榆皂苷I长循环脂质体稳定性良好,具有较高的包封率和载药量,同时也展现出良好的缓释效果。
地榆皂苷I可溶于甲醇、甲醇-氯仿混合溶剂、DMSO 等有机溶剂,而不溶于氯仿。而薄膜分散法通常选择氯仿或氯仿-甲醇混合溶剂溶解膜材,因此本实验选择甲醇-氯仿混合溶剂,成膜性较好。实验中发现,有机溶剂的残留会影响磷脂的聚集状态,如体系中残留较大量的氯仿,获得的产品中有可能存在乳滴,从而使得制备的脂质体不稳定,出现分层现象,因此须严格控制有机溶剂的残留量。磷脂双分子层构成脂质体的基本骨架,不饱和磷脂在脂质体制备和储存过程中易被氧化,体内循环中会导致药物快速泄露。查阅相关文献,得知可在制备过程中添加脂溶性抗氧剂维生素E,实验结果也表明,所制备的脂质体稳定性较好。
实验中测得地榆皂苷I在水中的溶解度为0.25 mg/mL,极微溶解,所以游离地榆皂苷I在脂质体制剂的外水介质中以2 种形式存在:即地榆皂苷I的游离未溶解形式和游离溶解形式,且游离溶解形式的地榆皂苷I不能忽略。包封率是脂质体处方筛选及质量评价的重要指标,文献报道[15]测定包封率的方法有凝胶过滤法、超速离心法、透析法等,但这几种方法仪器要求条件高、繁琐,本实验使用超滤离心法测定包封率,方便、快速,且重现性好,更适于生产中进行质量控制。在包封率的测定中,通过0.22 μm 微孔滤膜滤过,将游离的未溶解形式的地榆皂苷I从脂质体混悬液中除去。将滤液(由脂质体包封的地榆皂苷I和游离的溶解形式地榆皂苷I组成)置于超滤离心管中,离心进行分离。在离心的过程中,时间过长会产热,而温度升高会影响脂质体稳定性,因此,最终选择的离心时间为20 min。结果得到的超滤液均为澄清状态,说明分离完全,超滤离心法可用于地榆皂苷I脂质体包封率的测定。在体外释放实验中,为解决地榆皂苷I在PBS 介质中溶解度低的问题,通过在释放介质中加入0.5%聚山梨酯80 满足了漏槽条件。
利益冲突所有作者均声明不存在利益冲突
