Ba同位素分析方法综述
2021-06-24田兰兰于慧敏南晓云
田兰兰,于慧敏, ,南晓云,黄 方,
1.中国科学技术大学 地球和空间科学学院 中国科学院壳幔物质与环境重点实验室,合肥 230026;2.中国科学院 比较行星学卓越创新中心,合肥 230026
钡(Ba)是第六周期第二主族的碱土金属元素,原子序数为56,相对原子质量为137.327。由于化学性质非常活泼,Ba在自然界中不存在单质形式,自然界中最常见的钡矿物为重晶石(BaSO4)和毒重石(BaCO3),二者都难溶于水。Ba在球粒陨石和硅酸盐地球中的平均含量分别为2.41×10-6和 6.60×10-6(McDonough and Sun, 1995)。 由 于Ba是大离子亲石元素,在核幔分异过程绝大部分的Ba会进入地幔中,地核中的Ba含量几乎为零(McDonough et al., 2001; McDonough et al., 2003)。Ba在地幔部分熔融过程中高度不相容,会优先进入到熔体相,因此地幔中Ba的平均含量(~6.9×10-6)远远低于地壳(~628×10-6)和沉积物(~776×10-6) (Sun and McDonough, 1989;McDonough and Sun, 1995;Plank and Languir, 1998;Rudnick and Gao, 2003;Rudnick and Gao, 2014)。同时,Ba是流体活动性元素(Kessel et al., 2005),在俯冲过程中富含水的大洋沉积物和洋壳脱水释放出的流体带走大量的Ba进入地幔楔之中(Morris and Ryan,2003),当少量地表物质俯冲进入地幔时将会引起地幔中很明显的Ba含量变化。因此,Ba元素可以用来示踪与俯冲有关的活动(Elliott et al., 1997;Pearce and Stern, 2006)和地壳物质再循环过程(Murphy et al.,2002; Kuritani et al., 2011)。
Ba在反演古海洋生产力方面是一个非常敏感的元素。海洋中Ba的停留时间(~8000 a)长于海洋的混合时间(~1000 a),但由于循环过程与生物活动相关,其在海水中呈类营养元素分布,因此Ba在海洋中为非保守元素(Edmond et al., 1979)。在上层海水中,生物作用会促使硫酸钡在过饱和微环境中发生沉淀,所以上层海水中溶解态的Ba浓 度 较 低(~30 nmol·kg-1)(Horner et al., 2015;Cao et al., 2016; Bates et al., 2017; Bridgestock et al.,2018)。随着深度增加,重晶石发生部分溶解,使得Ba含量逐渐升高(~150 nmol·kg-1; Horner et al.,2015)。在沉积物中,由于生物重晶石的累积速率与有机碳输出通量呈良好的正相关关系,因此生物重晶石常用来反演古海洋生产力(Dehairs et al., 1980; Dymond et al., 1992; Eagle et al.2003;Paytan et al., 2007; Ma et al., 2015; Bridgestock et al., 2019)。
随着分析技术的发展,高精度的Ba同位素数据被用来示踪俯冲物质再循环和反演古海洋生产力。越来越多的工作将Ba同位素应用于相关过程的研究中(Horner et al., 2015; Nielsen et al.,2018; Bridgestock et al., 2019; Crockford et al., 2019;Hodgskiss et al., 2019; Nielsen et al., 2020)。Ba有七个稳定同位素,130Ba、132Ba、134Ba、135Ba、136Ba、137Ba和138Ba,相对丰度分别为0.106%、0.101%、2.417%、6.592%、7.854%、11.232% 和 71.698%(Eugster et al., 1969;表1)。在早期阶段,Ba同位素组成主要通过热电离质谱(TIMS)测得。但由于仪器和分析技术的局限,分析精度不高,也只有核裂变反应堆和陨石这类分馏明显的样品才能被观测到。Nier(1938)首次用TIMS确定了Ba的稳定同位素组成。Eugster等(1969)采用双稀释剂法(DS,134Ba-137Ba)在TIMS上测量了六个陨石、两个铁陨石的硅酸盐包体以及地球辉绿岩标样(W-1)的Ba同位素组成,将Ba同位素分析精度提升至 1‰ 级别。但在 1‰ 的测试精度下,仍无法识别大部分天体和地球样品之间存在的Ba同位素分馏(Eugster et al., 1969)。
直到2010年,von Allmen 等 采用双稀释剂法(130Ba-135Ba)在多接收电感耦合等离子体质谱仪(MC-ICP-MS)上测量Ba同位素,首次将分析精度提为 0.14‰ (δ137/134Ba, 2SD),开启了高精度的Ba同位素测试。随着MC-ICP-MS和TIMS的广泛应用,高精度的Ba同位素分析方法逐渐建立并趋于成熟。针对硅酸盐岩石学样品,Miyazaki 等(2014)通过严格计算,使双稀释剂与样品达到最佳稀释比,同时校正了 Ar 中混有的 Xe 对 Ba 的同质异位素的干扰,将 Ba 同位素在MC-ICP-MS上的测量精度提升到了 0.03‰(δ137/134Ba, 2SD)。Nan等(2015)在MC-ICP-MS上建立了样品—标样间插法(SSB),并检测了基质效应对SSB法的影响,测试精度达 0.05‰(δ137/134Ba, 2SD)。van Zuilen等(2016b)在MC-ICP-MS上和TIMS上分别采用130Ba-135Ba 和132Ba-136Ba 两种双稀释剂测量了十二种标准物质(包括硅酸盐岩、碳酸盐岩和硫酸盐岩,见附表1)的Ba同位素组成,精度为 0.05‰(δ137/134Ba, 2SD),并在MC-ICP-MS上进一步检测了基质效应对双稀释剂法测量Ba同位素的影响。Nan 等(2018)同时采用Ce元素添加法和双稀释剂法(135Ba-136Ba)两种校正方法测量Ba同位素组成,测量结果在误差范围内完全一致,精度好于 0.05‰(δ137/134Ba, 2SD)(Nan et al., 2018)。
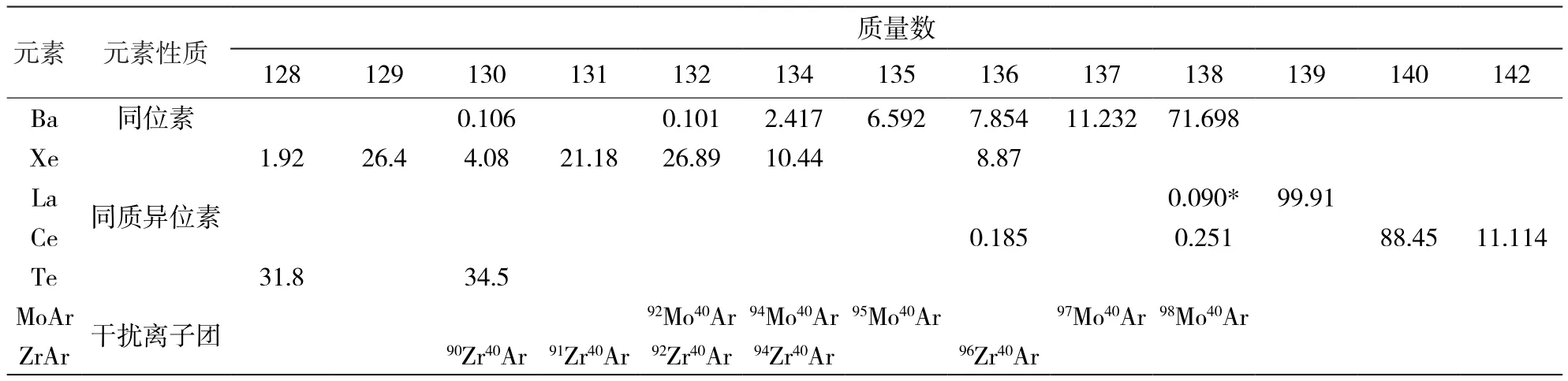
表1 Ba同位素丰度及质谱分析过程中可能的同质异位素、离子团的干扰Table 1 Isotope abundance, potential interference of isobars and ion complex for barium isotope
除了测量上述硅酸盐岩石样品以外,针对低Ba含量的海水、碳酸盐岩(如珊瑚)以及硫酸盐岩样品(如难溶的重晶石)的 Ba 同位素测量方法,国内外多个课题组也相继开展研究,利用双稀释剂法在MC-ICP-MS上建立了高精度的Ba同位素分析方法(Horner et al., 2015; Pretet et al., 2016; Cao et al., 2016, 2020a; Bates et al., 2017; Tian et al., 2019;Zeng et al., 2019; Yu et al., 2020)和TIMS (Hsieh and Henderson, 2017; Lin et al., 2020)。对于海水样品与河水样品大多数研究采用双稀释剂法(135Ba-137Ba或130Ba-135Ba)进行测量(Horner et al., 2015; Cao et al., 2016; Bates et al., 2017; Hsieh and Henderson,2017; Hemsing et al., 2018; Bridgestock et al., 2018),精度可达 0.03‰ (δ138/134Ba, 2SD)。少部分研究采用样品—标样间插法测量河水Ba同位素的分析方法,外部精度好于 0.09‰ (δ138/134Ba, 2SD)(Gou and Li,2019; Gou et al., 2019, Charbonnier et al., 2020)。对于碳酸盐样品一般采用双稀释剂法(135Ba-137Ba、135Ba-136Ba、130Ba-135Ba)测量,近年来珊瑚、石笋以及碳酸盐岩中各相(水溶相、交换相、碳酸盐相、可氧化相)的Ba同位素分析方法均已逐渐建成,精度可达 0.03‰ (δ138/134Ba, 2SD)(Pretet et al.,2016; Hemsing et al., 2018; Zeng et al., 2019; Lin et al.,2019)。对于重晶石样品,一般采用碳酸钠置换法溶解重晶石,双稀释剂法测量Ba同位素组成,精度可达 0.03‰ (δ138/134Ba, 2SD)(van Zuilen et al.,2016; Bridgestock et al., 2018; Crockford et al., 2019;Tian et al., 2019)。在碳酸钠置换法的基础上,Tian等(2020)进一步建立了快速测量重晶石Ba同位素的水提取法,精度可达 0.05‰ (δ138/134Ba, 2SD)(Tian et al., 2020)。
本文主要回顾了近些年国内外关于Ba同位素分析方法的研究成果,主要包括硅酸盐岩、碳酸盐岩、硫酸盐岩、海水等类型样品的分析方法、国内外各个实验室之间的数据对比以及标准样品的Ba同位素组成的统计(附表1)。期望与国内同行一起对这个新兴同位素体系进行更深入的研究,并共同推进 Ba同位素海洋体系、表生环境、古环境以及在俯冲带等领域的应用。
1 钡同位素的表示方法和标准物质
Ba同位素组成一般采用δ值表示:δX/134Ba(δX/134Ba=[(X/134Ba)样品/ (X/134Ba)标样-1] ×1000,X 为137或138)。其中(X/134Ba)样品表示样品的同位素比值,(X/134Ba)标样表示标样的同位素比值。之前的研究中,δ137/134Ba和δ138/134Ba均被用来报道Ba同位素数据。为了不同实验室间测量的数据可以方便的比较,在2017年的戈德施密特国际地球化学年会之后,国际同行建议统一用δ138/134Ba来报道数据。对于同一标准物质下的数据,可通过质量分馏关系(δ138/134Ba≈1.33×δ137/134Ba)换算得到。
近几年国际上采用的Ba同位素标准物质有四个(附表1):(1)Fluka Aldrich公司的 Ba(NO3)2ICP-OES标准溶液(von Allmen et al., 2010; Miyazaki et al., 2014; Pretet et al., 2016);(2)来自 SCP Scienc,Plasma Cal.的 Ba标准溶液(Moynier et al., 2015);(3)美国国家标准技术研究所研制的SRM3104a(Horner et al., 2015; Nan et al., 2015; Bullen et al.,2016; van Zuilen et al., 2016a, b; Mavromatis et al., 2016;Bates et al., 2017; Hsieh et al., 2017;Nan et al., 2018;Bridgestock et al., 2018, 2019; Li et al., 2019; Nielsen et al., 2018; Crocford et al., 2019; Cao et al., 2020a, b; Yu et al., 2020);(4) 来 自 Inorganic Ventures的 Ba(NO3)2标准溶液(Cao et al., 2016)。其中,SCPScienc, Plasma Cal的Ba标准溶液被用来测量陨石的Ba同位素组成,它与其他三个标样之间的换算关系不明确。其余三个标准溶液之间的换算关系为:Δ137/134BaFluka-SRM3104a=0.02±0.07‰(van Zuilen et al., 2016b),Δ137/134BaInorganic-SRM3104a=0.02±0.07‰(Cao et al., 2016)。
由于不同的标准物质的使用给各个实验室之间进行数据对比造成不便,并且有些标准物质储量并不多,不易获得。根据惯例,标准物质应当具备储量足够多并且容易获得,国际同行在2017年的戈德施密特国际地球化学年会上推荐自然样品的Ba同位素数据都用相对于SRM3104a的偏差来报道。对于2017年之前采用的不同的标准物质数据,可以通过关系式+(δ138/134Ba样品-x×δ138/134BaSRM3104a-x)/1000(X 为 另 一个Ba同位素标准)换算得到。除此之外,很多实验室有自己的内标,用来监测实验室的长期精度,以及评估实验结果的准确性。如van Zuilen 等(2016)采用的BaBe12 和 BaBe27作为实验室内标;中国科学技术大学金属稳定同位素实验室常用USTC-Ba和ICP-US作为实验室内标(Nan et al., 2015, 2018; Li et al., 2019; Zeng et al., 2019, Tian et al., 2019, 2020; An et al., 2020; Gong et al., 2019,2020; Deng et al., 2021);南京大学采用NJU-Ba为实验室内标(Lin et al., 2019)。
2 不同地球样品的消解
一般来说,在样品采集之后、实验室分析前,需要先进行样品粉碎、研磨、消解等过程。岩石学样品通常研磨至粒径过200目筛(74.162 μm)。不同样品的消解方法不同(图1),与具体的样品性质相关(如硅酸盐岩、碳酸盐岩、硫酸盐岩、水样等)。
2.1 硅酸盐岩样品的消解
对于硅酸盐岩石样品一般通过高纯HF、HCl和HNO3三种酸进行完全溶解(Nan et al., 2018;Zeng et al., 2019; Lin et al., 2019),溶样原理在于HF破坏硅酸盐结构,形成SiF4气体和氟化金属化合物。氟化金属化合物再通过王水(HCl :HNO3=3:1)以及稀盐酸或稀硝酸进一步溶解。具体步骤:称取约50 mg (具体以样品中Ba含量而定),加入3:1的浓HNO3与浓HF,加热并蒸干后,加入王水进一步溶解难溶物质,之后再加入3 mol/L的HCl去除氟化物,最后将样品溶于1 mL 3 mol/L的HCl中,为化学纯化做准备。对于一些难溶的硅酸盐样品,部分实验室也使用HClO4溶解(Bridgestock et al.,2018),或者采用高温高压闷罐溶样弹或微波消解仪。
2.2 碳酸盐岩样品的消解
对于纯碳酸盐岩石样品一般通过醋酸(HAC)进行溶解。对于自然界中含有各相杂质的碳酸盐岩,Lin 等(2019)采用连续提取法研究了碳酸盐岩中各相之间的Ba同位素分馏,包括水溶相、交换相、碳酸盐相、以及可氧化相(Phan et al., 2018;Lin et al., 2019)。连续提取法的简要步骤及原理如下:(1)使用超纯水提取水溶相(可溶性盐)。首先称取500 mg的样品,样品粉末与超纯水的以质量为1:20的比例混合,在室温下摇晃2 h,随后离心并分离上清液,残余固体再用5 mL超纯水清洗、离心、分离上清液;(2)使用20 mL 1.0 moL/L的醋酸铵溶液(pH~8)提取交换相。原理在于在高离子强度溶液中,铵离子会取代与有机物表面和矿物表面结合较弱的阳离子,如吸附在粘土胶体上的阳离子。而碳酸盐晶格中的Ba不会被提取(Liu et al., 2014)。第一步中的残余固体与醋酸铵溶液混合后在室温条件下摇晃4 h,随后离心、分离上清液,残余固体再用10 mL超纯水清洗以充分去除残余的溶解态离子。(3)在去除了水溶相和交换相后,用25 mL 1.0 moL/L的醋酸溶解碳酸盐相。第二步中的残余固体与醋酸混合之后在室温下超声1 h,再摇晃4 h,随后分离上清液。为了监控硅酸盐相和铁锰氧化物中的Ba是否淋出,在这一步骤中分别用Al或Ti含量和Mn含量进行监测。(4)可氧化相中的Ba主要与有机质结合或伴生,采用6.0 moL/L H2O2+0.02 moL/L HNO3(pH~2)提取残余固体中可氧化相中的Ba。向上述三步后的残余固体中缓慢加入15 mL 6.0 moL/L H2O2(避免剧烈冒泡),用0.02 moL/L HNO3调节pH至2,静置后按上述方法分离上清液。

图1 硅酸盐岩、碳酸盐岩、重晶石的溶解流程图(改自Nan et al., 2015; Lin et al., 2019; Tian et al., 2020)Fig.1 The procedure of the silicate, carbonate, and barite (modified from Nan et al., 2015; Lin et al., 2019; Tian et al., 2020)
2.3 硫酸盐岩样品的消解
对于硫酸盐岩样品,如重晶石(BaSO4),由于其在水和无机酸(如HCl和HNO3)中超低的溶解度(ca Ksp=10-9.96at 25℃, 1 atm),样品消解是这类样品进行同位素测试时最大的难点。之前主要的消解方法有三种:碳酸钠置换法(Breit et al.,1985),络合法(Griffith et al., 2008)和HI溶解法(Takano and Watanuki, 1972)。碳酸钠置换法原理在于:通过过量的CO32-与硫酸钡中的SO42-进行置换,将BaSO4转换成可溶于酸的BaCO3和SO42-(Breit et al., 1985; von Aallmen et al., 2010; van Zuilen et al.,2016; Tian et al., 2019),从而进行下一步的消解和纯化。络合法原理是用树脂(MCI Gel-CK08P)与BaSO4中的阳离子(Ba2+)充分络合,而SO42-进入溶液相。再通过HCl淋洗树脂上的Ba2+( Paytan et al., 1993; Griffith et al., 2008)。HI溶解法是通过反应 BaSO4+8HI+2H+→Ba2++4H2O+H2S+I2,将不溶的BaSO4转化成可溶的Ba2+(Takano and Watanuki, 1972)。以上三种方法中:络合法需要的时间较长,大约为10天;HI法会产生H2S等有毒气体,实验相对复杂;相对来说,碳酸钠置换法最快速并简便,因此成为溶解BaSO4最常用的方法。
碳酸钠置换法最早是用于重晶石中的放射成因Sr同位素测量(Breit et al., 1985; Paytan et al., 1996,2007),之后也应用于Ba的测量。重晶石消解主要分为去除基质(有机质、硅酸盐、碳酸盐等)和置换BaSO4两部分(Tian et al., 2019),具体步骤为:(1)称取2 mg的重晶石粉末于聚四氟乙烯的烧杯中,加入50 μL浓HNO3和0.5 mL的30 %的H2O2,为了避免剧烈反应,低温(70~90℃)加热一天,然后在低温(~90℃)蒸干,以充分去除有机质;(2)加入1.3 mL 3:1的浓HNO3与浓HF,加热过夜随后蒸干,以充分去除碳酸盐和硅酸盐;(3)加入1.2 mL王水,加热过夜随后蒸干。加入1 mL 3 mol/L的HCl,加热过夜随后蒸干。这一步是为了去除氟化物。(4)加入1 mL碳酸钠溶液(Na2CO3:BaSO4=1:10),在低温(< 100℃)下加热四小时,然后充分静止后分离上清液,向残余固体中继续加入1 mL碳酸钠溶液,重复上述操作两次以充分置换BaSO4;(5)向烧杯中缓慢加入1 mL 3 mol/L的HCl,溶解置换所得的碳酸钡固体,之后便可以进行化学纯化。对于重晶石的Ba同位素,van Zuilen等(2016b)发现碳酸钠置换BaSO4的置换率达到在33%~99%时,对重晶石的Ba同位素组成不会有显著的影响。Tian等(2019)通过合成重晶石(Na2SO4+Ba(NO3)2=BaSO4+2NaNO3)确定了置换法的可靠性,并严格检验了碳酸钠置换过程中BaSO4置换效率以及基质效应可能对Ba同位素分馏产生的影响。检验结果发现:合成重晶石的Ba同位素组成与用于合成的硝酸钡的Ba同位素组成在误差范围内完全一致;当BaSO4的置换效率大于50%时,置换产生的影响和基质效应均可以忽略不计。
在碳酸钠置换法的基础上,Tian 等(2020)发现用“水提取法”可以快速准确的测量重晶石的Ba同位素,该方法可将化学流程从五天缩短至了两小时,并且水提取法测量结果与碳酸钠法在误差范围内完全一致(Tian et al., 2020)。该方法简要的流程如下:称取10 mg 重晶石粉末于聚四氟乙烯烧杯中,加入4 mL超纯水,振荡30 min,超声30 min,离心30 min,随后分离上清液,将上清液在低温(< 100℃)下蒸干,加入1 mL 3 mol/L的HCl后便可以纯化过柱子。水提取法的原理为:超纯水提取出重晶石微颗粒与溶解态Ba的混合物,该混合物在蒸干之后能在3 moL/L的HCl中完全溶解,并且经检验溶解态Ba对重晶石Ba同位素的影响可以忽略不计。相比碳酸钠置换法来说,水提取法不仅仅是缩短了化学流程的时间,操作步骤也得到了极大的简化。
2.4 海水与河水颗粒样品的消解及水样纯化前的准备
对于海水及河水样品需要将采集的样品先进行过滤。一般以0.2 μm为界,大于0.2 μm的为颗粒态物质,小于0.2 μm的为溶解态物质。海水颗粒态物质采用3 mL HCl+2 mL HNO3+1 mL HF混合酸在90℃过夜完全消解,且分析消解液中的Al以判断陆源钡的影响(e.g., Cao et al., 2020b)。
虽然海水和河水样品不需要消解,但需要在纯化前做一些准备,目前主要有三种方式:(1)最常用的方法是先将海水中溶解的Ba2+浓缩富集转化为固体,再用酸溶解之后纯化。研究者将采集的海水样品加入相应量的Ba双稀释剂(双稀释剂的量根据海水中Ba的浓度而定)充分混合,之后进行浓缩富集(Horner et al., 2015; Bates et al., 2017;Bridgestock et al., 2018; Hemsing et al., 2018)。浓缩富集最早用于测量海水中的226Ra和Ba含量(Foster et al., 2004),原理在于用Na2CO3溶液升高海水的pH值,使得海水中的226Ra和Ba2+随着CaCO3一起析出(Foster et al., 2004)。具体的步骤为:将7.5 mL 1 mol/L Na2CO3溶液(pH~12)滴加到120 mL的海水样品中,并间歇性振荡。所得固体沉淀物经过离心、两次超纯水清洗、干燥,然后溶解于化学纯化所需的酸中(Foster et al., 2004)。(2)不采用浓缩富集,过滤后的水样直接加入Ba的双稀释剂(双稀释剂的量根据海水中Ba的浓度而定)混匀后蒸干,然后进行化学纯化(Cao et al., 2016)。Cao 等(2016)根据Ba含量的不同,在10~40 mL海水样品中加入130Ba-135Ba双稀释剂,放置过夜使其充分混合。随后将样品蒸干,再用5~8 mL的1 mol/L HCl中重新溶解,并在热板上加热直至重新溶解以准备纯化。(3)不加稀释剂,直接将水样蒸干(体积根据水样的Ba浓度而定),然后在3 mol/L的HCl中溶解,再通过阳离子树脂进行纯化(Gou and Deng, 2019; Gou et al., 2019)。
3 化学纯化
化学纯化是获得高精度Ba同位素数据的必要前提。由于基质离子会干扰Ba同位素测量,因此化学纯化的好坏直接影响测量结果的准确度和精确度。Ba 的化学纯化流程的建立主要包括标定淋滤曲线,检测不同样品(如不同浓度、岩性、基质等)上样量对淋滤曲线的影响。对于未在过柱前加稀释剂的样品,还需要确定化学流程的回收率。
3.1 离子交换树脂分离
淋洗曲线可以直观展示目标元素和基质元素的分离情况(图2),好的淋洗曲线需要满足两个要求:(1)目标元素与基质元素需要尽可能分离;(2)目标元素的回收率尽可能高,在没有加入双稀释剂时,回收率应该接近100%。这就需要严格选择树脂、柱子、以及淋洗酸。
3.1.1 离子交换树脂与柱子的选择
树脂纯化的原理在于各个元素在不同种类的洗脱液中与树脂的亲和能力(Kd)不同,因此可以在不同的洗脱液中分离出目标元素。由于Ba的离子形式(Ba2+)呈阳离子态,并且电荷数低,半径大,因此常采用阳离子树脂进行分离提纯。目前,纯化Ba的阳离子交换树脂主要包括三种:(1)AG50W-X8 (Takahashi et al., 2009; Miyazaki et al., 2014; Van Zuilen et al., 2016; Bullen and Chadwick 2016; Cao et al., 2016; Hsieh and Henderson, 2017;Hemsing et al., 2018; Bridgestock et al., 2018; Lin et al.,2019, Charbonnier et al., 2020),(2)AG50W-X12(Nan et al., 2015, 2018; Zeng et al., 2019; Gou et al.,2019; Tian et al., 2019, 2020),(3)Dowex50W-X8(Eugster et al., 1969; Foster et al., 2004, Pretet et al.,2016),这三种阳离子树脂均可以很好的分离Ba元素。一些稀土元素(如镧、铈等)与离子交换树脂的亲和系数”Kd”和Ba的相近,淋洗过程容易进入Ba的接收区间。同时,136Ce和138Ce对136Ba和138Ba存在同质异位素干扰(表1),过高Ce的残留将影响Ba同位素的测量结果。当样品中稀土元素含量较高时,可以通过多次纯化(Nan et al.,2015)或者采用较稀的 HNO3(1.5~2 moL/L,van Zuilen et al., 2016b; Lin et al., 2019)接取Ba以达到最好的分离效果。除了用阳离子树脂外,Moynier等(2015)在第二柱和第三柱选用少量的Sr特效树脂通过3 moL/L HNO3来淋洗Ba(Moynier et al., 2015),以便将Ba与稀土元素分开,进一步充分提纯Ba。

图2 Ba同位素淋洗曲线,以AG50W-X8 和AG50W-X12的第一柱为例(改自Lin et al., 2019和Nan et al., 2015)Fig.2 Elution curves of Ba purification procedures, take the first column of AG50W-X8 and AG50W-X12 as examples(modified from Lin et al., 2019 and Nan et al., 2015)
除了树脂的种类以外,树脂的体积和承载树脂的柱子的形状(如内径和长度比等)也会影响Ba元素的分离情况。一般来说,树脂体积越大,柱子内径越小,长度越长(即内径/长度比越小),分离时间越长,效果越好。但是考虑到成本和实验本底,分离效果可以满足需求时一般采用体积最小的树脂用量。
3.1.2 回收率、淋洗酸和上样量对Ba淋洗曲线的影响
Kondoh等(1996)研究发现,轻的Ba同位素更倾向于被阳离子树脂吸附,富集于后期的淋洗液中,而重的Ba同位素更倾向于先被淋洗出来。因此,如果样品在化学分离过程中回收率未接近100%,则接取样品中的Ba同位素组成与其真实的组成之间会存在差异。为避免化学流程中产生的Ba同位素分馏,对于未在化学提纯之前添加双稀释剂的样品,需要保证Ba的回收率接近100%。因此,化学纯化流程既需要考虑将Ba与基质元素尽可能分开,又要保证Ba的高回收率。
根据Ba和其它主微量元素与树脂亲和能力的差异(Strelow, 1960),研究者们首先选用2~3 moL/L HCl淋洗出基质元素,然后选用6 moL/L HCl(Takahashi et al., 2009; Miyazaki et al., 2014;Moynier et al., 2015; Van Zuilen et al., 2016)或 2~4 moL/L HNO3(Nan et al., 2015, 2017; Bridgestock et al.,2018; Lin et al., 2019; Zeng et al., 2019; Tian et al.,2019, 2020)淋洗Ba。为了达到最好的分离效果,减少淋洗的酸量(降低空白),并尽量节约时间,在淋滤曲线标定过程,需要尝试多种不同浓度酸的淋洗方案。例如Nan 等(2015)采用不同浓度盐酸和硝酸的组合,结果显示,在 3 mol/L 的 HCl情况下,基质元素(包括所有主量元素和 Sr)均可以在 20 mL 以内完全淋洗出来。而4 mol/L HNO3则可以在尽可能短的时间里把Ba完全淋洗下来。综合分离效果、时间和淋洗酸量,3 mol/L HCl + 4 mol/L HNO3为最佳淋滤曲线,Ba 的接收区间为 29~35 mL,共 7 mL。
此外,不同的上样量也可能改变目标元素的淋洗区间。例如,不同上样量的Mg的淋滤曲线不同(An et al., 2014)。因此,不同上样量是否会影响 Ba 的淋洗曲线也需要评估。Nan 等(2015)测试了不同上样量对Ba淋洗曲线的影响。结果发现:(1)Ba 上样量从 2 μg 到 20 μg 获得的 Ba 的淋洗区间完全一致,因此在2~20 μg上样量的范围不会造成淋洗曲线的漂移。并且整个纯化流程Ba的回收率可以达到 99%。Zeng 等(2019)为了建立低Ba含量且含量变化大的碳酸盐岩样品的Ba纯化流程,也检测了不同上样量对淋洗曲线的影响。结果发现,300~500 ng的上样量范围内不会造成淋洗曲线的漂移。
3.2 不同样品的纯化
化学纯化的基本流程为:首先,清洗树脂和柱子;第二,将清洗好的树脂装载到柱子中;第三,向柱子中加入清洗溶液再次对树脂进行清洗;第四,平衡树脂(与载入样品使用的酸一致);第五,载入样品;第六,按照标定的淋洗曲线淋洗基质和接取Ba。不同样品的化学纯化方法也不同,这不仅仅与样品性质相关(硅酸盐岩、碳酸盐岩、硫酸盐岩、水样),也与国内外各个实验室所采用的树脂以及所用的酸有关。
(1)对于硅酸盐岩样品(上样量>2 μg)来说,一般采用两柱阳离子树脂可以将Ba与基质元素分离开。例如,Nan等(2015)分别采用2 mL 和0.5 mL两柱阳离子树脂(AG50W-X12),3 moL/L的HCl淋洗基质元素,4 moL/L的HNO3淋洗Ba。
(2)对于珊瑚、石笋这些碳酸盐岩样品的纯化则相对复杂。因为其 Ba 含量可以低至几个 ppm,导致其Ca/Ba 可以高达 200000(m/m)(Hall and Chan, 2004)。虽然前人研究表明利用双稀释剂法校正Ba同位素组成时即使Ca/Ba比值达到 100 也不会对Ba同位素组成造成明显的影响(van Zuilen et al., 2016b),但是Yu 等(2020)发现在Ca/Ba达到400的时候对仪器的参数要求比较严格。因此,仅通过一柱阳离子树脂纯化可能难以分离干净Ca,从而可能对Ba同位素的测量产生显著影响。此外,碳酸盐岩样品中还含有大量的Sr,而在一柱阳离子树脂分离中Sr和Ba的淋滤曲线会存在一点重叠区域(Zeng et al., 2019)。Zeng等(2019)针对这类低Ba含量的碳酸盐岩样品采用了三柱阳离子树脂(AGW50-X12)提纯,并在Nan等(2015)的基础上把第一柱改用更细更长的石英柱子以充分去除Ca和Sr,再通过第三柱阳离子树脂(AGW50-X12)充分去除稀土元素。
(3)对于重晶石这种Ba的主要矿物来说,其纯化流程相对简单,因为这类样品的Ba含量极高且基质元素较低,一般采用少量(≤0.5 mL)阳离子树脂就可以充分地提纯Ba元素。Tian等(2019,2020)采用0.5 mL AGW50-X12在3 moL/L的HCl中淋洗基质元素,3 moL/L的HNO3中淋洗Ba。
(4)对于海水和河水样品的纯化,除前期准备(浓缩富集、加双稀释剂、蒸干)外,纯化流程与常规的硅酸盐岩的纯化流程可以类比。
4 质谱分析
由于Ba的第一电离能较低(5.21 eV),因此TIMS和MC-ICP-MS两种质谱仪均能很好的电离Ba。要获得高精度的Ba同位素组成数据,在仪器测量过程中需要解决:(1)基质效应的影响;(2)离子化过程中产生的同质异位素以及离子团(表1)的干扰;(3)仪器产生的质量歧视影响。值得注意的是,TIMS是通过不同的激发温度电离目标元素,因此,相对于MC-ICP-MS来说,TIMS对基质和Ce、La等样品中残留的同质异位素不敏感。此外,对于同质异位素Xe和大离子团(ZrAr和MoAr)对Ba同位素的干扰也只能在MC-ICP-MS仪器上出现,因为TIMS不需要Ar气作为载气,不存在Xe的干扰。但由于TIMS需要点样,抽真空也比较耗时,样品盘容量有限,而MC-ICP-MS是溶液进样,测样效率比TIMS更高。因此,对于Ba同位素测试来说,两种仪器各有优缺点。
4.1 基质效应的影响
基质效应是指化学纯化后残留在样品中的基质元素(如 Na、K、Al、Fe、Mg、Cu、Zn、Sr等)和有机质对同位素测量的影响,多发生在MC-ICP-MS的测量过程中。这些基质元素虽然在质量上与Ba同位素的质量相差很大,但是仍然可以影响Ba同位素测量,被称之为“看不见的基质效应”。因此,在建立Ba同位素分析方法时,需要在化学纯化流程中充分的分离基质元素。同时,也需要在仪器上进行基质元素添加实验,进一步定量评估基质效应对Ba同位素测试的影响。Nan 等(2015)采用干等离子体样品—标样间插法测量时,当纯化后的样品溶液同时满足:Ca/Ba≤1、Mg/Ba≤1、 Na/Ba≤0.5、Sr/Ba≤0.5、K/Ba≤0.1、Fe/Ba≤0.05、Al/Ba≤0.01时,基质元素的存在不会影响 Ba 同位素测量结果。Gou和Deng (2019)采用与Nan 等(2015)相同的方法却发现当纯化后的样品溶液同时满足Ca/Ba>5、Na/Ba>5、K/Ba>5、Mg/Ba>5、Ce/Ba>0.2 时,基质效应可以忽略。这说明,采用干等离子体样品—标样间插法测量时,不同的仪器对基质效应的响应可能存在差异。由此可见,基质效应对Ba同位素测量的影响程度,不仅仅与化学分离程度相关,还可能与具体的仪器类型、仪器的参数、测量方法等相关。
van Zuilen等(2016 b)采用双稀释剂法(130Ba /135Ba)测量时,基质元素(如Ca、Na和Sr等)的影响相比采用样品—标样间插法时显著降低,当X/Ba≤100时双稀释剂法校正质量分馏均是有效的。Yu 等(2020)发现通过调节仪器参数NAI(Normalised Ar Index,NAI=2×38Ar+/40Ar2+)可显著降低基质效应的影响,从而使仪器质量分馏最小化。通过六组实验(NAI=0.02、0.07、0.14、0.55、0.86、1.01)发现,当采用干等离子体,H+Jet锥组合,NAI调节至0.55~1.01时,即使Ca/Ba和Sr/Ba 达到400,双稀释剂法校正仍然有效。因此,在MC-ICP-MS测量Ba同位素时应在高NAI条件下进行,同时选择最优的锥组合。
此外,基质效应除了样品中残余的阳离子外,还包括树脂中淋洗出来的有机质的影响(Pietruszka and Reznik, 2008; Hughes et al., 2011)。Nan 等(2015)测试了有机质对Ba同位素分析的影响,将不同浓度(2 μg、4 μg、6 μg、8 μg、10 μg)的SRM3104a载入到同样的树脂中。理论上来说,上样量越高,有机质的干扰越不明显。结果显示,当Ba 的上样量为2 μg时,溶解的有机质将造成高达-0.705‰的 Ba 同位素测量偏差。随着Ba 上样量的增加,有机质的影响逐渐减小,当Ba 的上样量高于 6 μg 时,溶解有机质的的影响在误差范围内可以忽略。因此,为了避免有机质的干扰,一般会增加Ba的上样量并且在过完柱子之后采用双氧水和浓硝酸除有机质(Nan et al., 2015; Zeng et al.,2019; Tian et al., 2019, 2020)。
4.2 同质异位素及离子团的干扰
同质异位素是指质量数相同但质子数不同的一类核素。Ba的同质异位素分别是130Xe、132Xe、134Xe、136Xe、136Ce、138Ce、138La,可能的干扰离子团是ZrAr和MoAr(表1),这些同质异位素和大离子团都可能对Ba同位素测量产生干扰。对于来自样品中的同质异位素,一般可通过化学纯化减小其干扰。但在严格的化学纯化之后,Ba同位素测量过程中仍然需要严格校正同质异位素和大离子团的干扰(表1)。例如,化学纯化后仍然残留的少量Ce,136Ce 和138Ce会对136Ba和138Ba产生同质异位素的干扰。一般来说可以通过监测140Ce来校正136Ba的信号。Gou和Deng(2019)发现,当测试溶液中Ce/Ba≤0.1时,可以通过SSB法有效校正,Ba同位素测试不会受到影响,当Ce/Ba超过0.1时会显著影响校正结果。Nan等(2018)发现,当测试溶液中Ce/Ba≤0.2时,双稀释剂(135Ba-136Ba)法可有效校正测量结果,当Ce/Ba超过0.2时,Ce会显著影响校正结果。
载气(Ar气)中存在少量的杂质气体氙气(Xe)也会影响Ba同位素的测量,如130Xe、132Xe、134Xe和136Xe 分别会对130Ba、132Ba、134Ba和136Ba 产生同质异位素的干扰。对于Xe的干扰,一般通过监测131Xe 来校正Xe同质异位素的干扰(von Allmen et al., 2010; Miyazaki et al., 2014; Nan et al., 2018; Zeng et al., 2019; Tian et al., 2019, 2020;Gou and Deng, 2019)。van Zuilen 等(2016b)检测了129Xe、131Xe、125Te来校正同质异位素的干扰。但是对于130Te对130Ba的干扰一般可以忽略不计(von Allmen et al., 2010),因为Te在自然界的丰度很低(如海水中Ba/Te≈300000~750000,地壳中Ba/Te≈50000~115000),并且 Te主要呈现 Te4+和Te6+,在海洋中不太可能进入BaSO4的晶格中代替Ba离子。von Allme等(2010)也监测了128Te和128Xe的信号,发现测量过程中并没有检测到128Te的信号存在,Te对Ba同位素测量的影响可忽略。
对于大离子团ZrAr和MoAr的干扰,van Zuilen 等(2016 b)在MC-ICP-MS上采用双稀释剂法(130Ba/135Ba)测量时发现,当Mo/Ba > 4和Zr/Ba>28时,会显著影响Ba同位素的测量结果(van Zuilen et al., 2016 b)。但由于大多数自然样品中Ba的丰度都高于Mo和Zr,化学纯化过程中阳离子树脂对Mo和Zr的吸附效果远不如Ba(Strelow et al.,1960),大部分化学流程可以将Mo和Zr去除的较干净。因此,在实际测量过程中ZrAr和MoAr分子团对Ba同位素的影响可以忽略。
4.3 仪器质量歧视的校正
仪器质量歧视校正一般采用3种方法(附表1):样品—标样间插法(Sample-Standard Bracketing,SSB)、Ce元素添加法(Ce-doping)和双稀释剂法(Double-Spike)。对于Ba同位素测量来说,三种校正方法均可以在MC-ICP-MS仪器上实施。而对于TIMS仪器来说,更多的是采用双稀释剂法来校正质量歧视。下文对这三种方法分别进行详细的介绍,并对各校正法分别进行详细的讨论。
4.3.1 样品—标样间插法(MC-ICP-MS)
样品—标样间插法(SSB)是指先测一个标样,再测样品,再接着测一个标样,用前后两个标样的平均值来代表标样的组成。SSB法的原理在于以下假设:(1)两个连续测量值之间的仪器质量分馏呈线性变化;(2)样品和标准品经历相同的仪器质量分馏(Albarède et al., 2004 ;Archer and Vance,2004; Maréchal et al., 1999)。该方法要求化学纯化流程的回收率近100%,以避免造成化学流程中造成的 Ba分馏(Albarède and Beard, 2004)。并且SSB法仅能在MC-ICP-MS仪器上校正仪器测量过程中产生的同位素质量相关分馏。再者测量时样品与间插标样的化学性质也需要保证相同,包括基质、浓度、以及酸度等。。
(1)酸度的影响:Nan等(2015)发现,样品与标样的酸浓度相差小于1%时,酸度差异不会显著影响Ba同位素测量。Gou和Deng(2019)发现,样品—标样酸度相差在 25% 范围内时,对Ba同位素测量没有影响。实际测量中,为了避免酸度差异对测量结果的影响,均使用相同批次的 2% (m/m)HNO3来稀释样品和间插标样。
(2)浓度的影响:Nan等(2015)发现当样品/标样的浓度比值在0.35~1.5的范围时,测量结果不受显著影响。但Gou和Deng(2019)发现Ba同位素测量对样品—标样浓度差非常敏感,即使样品与标样浓度相差 5% 也会对Ba同位素测量造成显著影响。这进一步标明,不同的仪器对测试条件的响应不同。为确保Ba同位素测量的准确的,在采用SSB法测量时,需要严格匹配样品和标样之间的浓度(浓度差不超过5%),以避免浓度差异造成的影响。
4.3.2 Ce 元素添加的方法(MC-ICP-MS)
用添加元素内标的方法校正仪器质量歧视效应已经被应用到多种同位素体系,例如用Cu对Zn同 位 素进行校正 (Maréchal et al.,1999; Archer and Vance, 2004),用Cu对Fe同位素进行校正(Kehm et al., 2003; Roe et al., 2003),以及用Tl对Pb同位素进行校正(Hirata, 1996; Belshaw et al.,1998; Rehkämper and Halliday, 1998; Rehkämper and Mezger, 2000; White et al., 2000)。Ce在元素周期表中与Ba相邻,136Ce 和138Ce 与136Ba 和138Ba为同质异位素(表1)。虽然Ce会造成Ba同位素的干扰,但由于其质量数接近Ba,在准确的校正基础上,Ce也可以作为内标对Ba同位素进行校正。Ce元素添加法是在样品中加入一定量的同位素比值已知的Ce内标,假定仪器对Ce同位素和Ba同位素的质量歧视效应相同,通过Ce同位素的真实比值与测量比值算出Ce同位素的分馏系数,并根据算出的分馏系数和仪器实测的Ba同位素组成,算出Ba同位素的真实值,从而达到校正仪器质量歧视目的。
Nan等(2018)通过指数分馏计算并结合样品—标样间法插在MC-ICP-MS上建立了Ce元素添加法。该方法采用的是湿法进样,Ba的测试浓度为 1.5×10-6,添加的 Ce 浓度为 120×10-9。同时监测了143Nd 来扣除142Nd 对142Ce 的干扰。在湿法条件下,由于Xe 在清洗酸和样品溶液中的信号一直很稳定,因此Xe的同质异位素干扰可以忽略(Nan et al., 2018)。值得注意的是,Ce元素添加法测试需要的Ba溶液浓度较高(至少1.5×10-6,Nan et al., 2018),相比样品标样间插法(~200×10-9)和双稀释剂法(可小于100×10-9),Ce元素添加法并不适用于低Ba含量的样品。
4.3.3 双稀释剂法(MC-ICP-MS/TIMS)
双稀释剂法(DS)是指在样品中加入一定量的已知同位素比值已知的Ba双稀释剂(如130Ba-135Ba或135Ba-136Ba),通过仪器实测的Ba同位素比值及已知的稀释剂Ba同位素,迭代计算样品中的Ba同位素组成(Albarede and Beard, 2004)。最初建立双稀释剂法是因为TIMS上无法使用SSB 来校正仪器的质量分馏,最近双稀释剂法已扩展到MC-ICP-MS,并在Ba同位素的测试过程中得到了广泛应用。双稀释剂法不仅能校正仪器测量过程中造成的Ba同位素分馏,在样品纯化前加入稀释剂还可以校正样品前处理引起的质量分馏。因此对化学纯化的回收率要求可以降低,尤其是对于Ba含量低的样品来说,双稀释剂法是最优的测量方法(Nan et al., 2018; Zeng et al., 2019)。
目前报道的最常用的Ba双稀释对包括四种,分别是:130Ba-135Ba (von Allmen et al., 2010; Böttcher et al., 2012; Miyazaki et al., 2014; van Zuilen et al.,2016 Cao et al., 2016)、132Ba-136Ba(van Zuilen et al., 2016; Bullen and Chadwick, 2016)、135Ba-136Ba(Horner et al., 2015; Bates et al., 2017; Nan et al.,2018; Crockford et al., 2019; Zeng et al., 2019; Tian et al., 2019, 2020) 和135Ba-137Ba(Horner et al., 2015;Hsieh and Henderson, 2017; Hemsing et al., 2018)。根据Rudge等(2009)给出的不同同位素的双稀释剂配比,130Ba-135Ba的最佳稀释比是2.36 (130Ba /135Ba≈2.36),132Ba-136Ba的最佳稀释比是0.064 (132Ba/136Ba≈0.064),135Ba-136Ba 的最佳稀释比是 1.72(135Ba/136Ba≈1.72),135Ba-137Ba的最佳稀释比是2.49(135Ba/137Ba≈2.49)。四种双稀释剂在最佳稀释比的条件下都可以很好的校正仪器产生的质量相关分馏。然而,双稀释剂法在使用时,需要严格标定稀释剂的Ba同位素组成、计算样品与稀释剂的最佳稀释比。当稀释剂的Ba同位素组成标定不准确以及样品与稀释剂的比例偏离最佳稀释比时,可能会造成人为的测量误差。
Miyazaki等(2014)在MC-ICP-MS上检测了不同双稀释剂比例对δ137/134Ba的校正影响。结果发现,当双稀释剂(130Ba-135Ba)与样品(IAEA-CO-9)混合比例在0.11~0.33范围内,采用标定后的双稀释剂比例(134Ba/130Ba=0.076528,135Ba/130Ba =1.060129,137Ba/130Ba=0.209145) 校 正 δ137/134Ba的 结 果 为0.019±0.058‰(n=9);然而,直接采用Oak Ridge National Laboratory给定的双稀释剂比例(134Ba/130Ba=0.076432,135Ba/130Ba=1.040925,137Ba/130Ba=0.208963)校正δ137/134Ba的结果为-0.015±0.2158‰(n=9)。Lin等(2019)在TIMS也上检测了不同双稀释剂比例对δ137/134Ba的校正影响。结果发现,当双稀释剂(130Ba-135Ba)与样品(NIST SRM3104a)混合比例在0.05~0.55范围内,采用标定后的双稀释剂比例(130Ba/137Ba=4.758403,134Ba/137Ba=0.366471,135Ba/137Ba=5.553565)校正δ137/134Ba的结果为-0.002‰±0.062‰(n=9);然而,直接采用Oak Ridge National Laboratory给定的双稀释剂比例(130Ba/137Ba=4.763156,134Ba/137Ba=0.366227,135Ba/137Ba=5.522122)校正δ137/134Ba的结果与稀释剂—样品的混合比例呈正相关,并且明显偏离真实值。van Zuilien 等(2016b)分别在MC-ICP-MS和TIMS检验了样品与双稀释剂(130Ba-135Ba和132Ba-136Ba)的比例对δ137/134Ba的校正影响。结果发现:(1)样品与130Ba-135Ba双稀释剂比例在0.11~0.28范围内时,校正结果在误差范围内一致,精度好于0.05‰ (2SD);当比例超出0.11~0.28时,校正结果显著偏离真实值并且精度较差(2SD>0.05‰)。(2)样品与132Ba-136Ba双稀释剂比例在最佳混合比(0.67)的10%以内(0.60~0.74)才适合测量。因此,在使用双稀释剂之前必须对其进行严格标定,并以最佳的比例与样品混合。
5 总结与展望
虽然早在40年前就报道了Ba的稳定同位素组成变化,但直到2010年,才真正建立了高精度的Ba同位素分析方法(溶液法),并开展了包括硅酸盐岩、碳酸盐岩、硫酸盐岩以及海水等样品的Ba同位素研究。不同类型的样品的化学前处理略有不同,但大多采用酸溶解,阳离子交换树脂纯化。通过树脂对Ba元素进行分离纯化,极大地降低了基质效应,提高了Ba同位素的分析精度。在仪器测试过程中,常采用样品—标样间插法(SSB)、Ce元素添加法、或双稀释剂法校正仪器产生的质量歧视效应。
虽然溶液法的高精度Ba同位素分析法方法已建成,但是由于基质效应以及标样—样品匹配难等问题,Ba同位素的原位分析方法至今还未建成。原位法具有高空间分辨率、高效率以及无化学分离等优点,能为Ba同位素的地质应用提供更坚实的基础。因此,在溶液法的基础上,希望将来能大力开展Ba同位素原位分析方法。通过溶液法,目前Ba同位素在地壳和地幔的储库组成(Nan et al.,2018; Li et al., 2020),花岗岩的演化过程(Deng et al., 2021),玄武岩风化过程中的Ba同位素分馏机理(Gong et al., 2019, 2020),各矿物之间Ba同位素的分馏系数(Wang et al., 2021),推断硫酸盐矿床的起源(Hodgskiss et al., 2019; Crockford et al.,2019),示踪海洋初级生产力(Bridgestock et al.,2019),海洋Ba循环(Horner et al., 2015; Cao et al.,2016, 2020a,b; Hsieh and Henderson, 2017; Hemsing et al., 2018; Bridgestock et al., 2018; Hsieh et al., 2020)等方面取得了初步进展。但是在花岗岩风化过程的分馏机理、成岩过程中的Ba同位素分馏等基础性工作还未得到深入研究。此外,Ba同位素在矿床、古环境、壳幔物质再循环等方面的应用也还非常少。总之,Ba同位素是一个非常有用的地球化学工具,在地质作用应用研究中具有巨大的潜力。
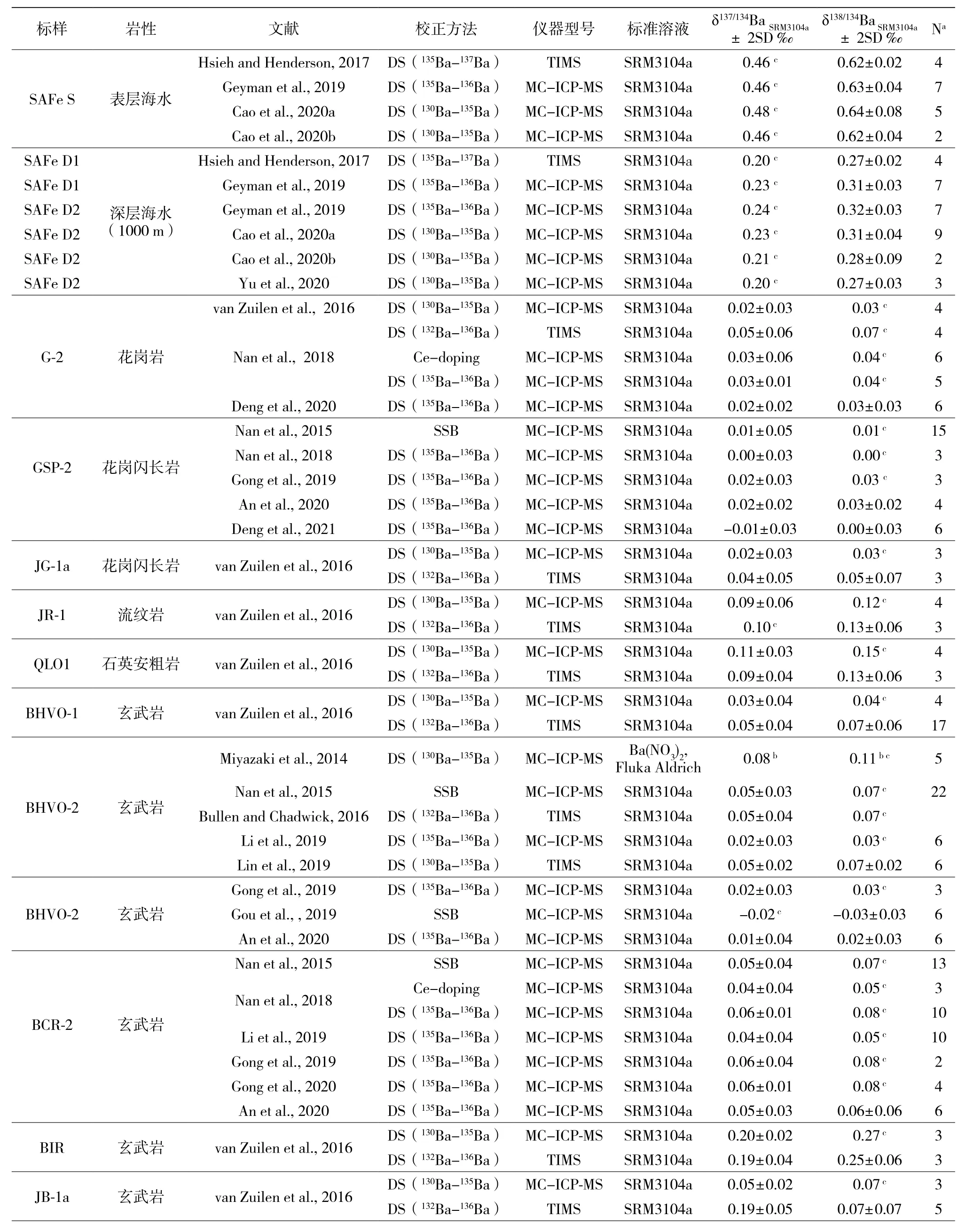
附表1 国内外各个实验室之间的数据对比以及标准样品的Ba同位素组成汇总Table 1 Summary of Ba isotope data obtained for various intercalibration standards by different laboratories and techniques

(续附表1)

(续附表1)
致谢:感谢曾振和吝祎勃在文章撰写和修改过程中给予的帮助。
