2015-2018年豫南地区猪圆环病毒2型分子流行病学调查
2021-06-24连慧香朱凤霞王俊锋易先国张伟彬董建国曲哲会
连慧香,朱凤霞,王俊锋*,易先国,张伟彬,刘 涛,董建国,曲哲会,赵 瑜,刘 佳*
(1.信阳农林学院牧医工程学院/河南省大别山区生态畜禽健康生产工程研究中心,河南信阳 464000;2.驻马店市动物疫病预防控制中心,河南驻马店 463000;3.河南农业职业学院,河南洛阳 451450)
猪圆环病毒2型(Porcine circovirus type 2,PCV2)是单股、环状、闭合的DNA病毒,属于圆环病毒科圆环病毒属[1]。该病毒主要破坏猪体免疫系统而引起免疫抑制,在临床上常发生与其他病原微生物共同感染的情况,诱发其他疾病的发生而使发病猪的死亡率明显升高,给世界养猪业带来巨大的经济损失[2-3]。
PCV2基因组为单链环状DNA病毒,大小为1 766 bp~1 768 bp,含有11个开放阅读框(ORF),其中ORF2基因编码的衣壳结构蛋白(Cap)与病毒致病性及免疫原性有关。有研究人员利用软件预测PCV全序列中的抗原位点,发现PCV中存在的抗原位点共有5个,4个位于ORF2中[4],这也证实了ORF2编码的Cap蛋白上拥有PCV2病毒的主要保护性抗原表位,是刺激机体产生免疫反应的结构蛋白[5-6],因此ORF2已成为PCV2疫苗开发研究的主要候选基因之一[7]。并且PCV2的毒力与ORF2基因有很大的关系,不同地区分离到的PCV2毒株之所以毒力不同,也很有可能是由于ORF2基因发生了变异造成的[8]。
目前已发现PCV2有6种基因亚型(PCV2a、PCV2b、PCV2c、PCV2d、PCV2e、PCV2f),其中PCV2a、PCV2b和PCV2d是国内主要流行的3种基因亚型毒株[9-10],而河南省流行的主要为PCV2b[12]和PCV2d亚型毒株[11-12],但关于PCV2在豫南地区的分子流行病学情况还未见报道。鉴于此,本研究通过对2015年—2018年豫南地区猪场疑似PCV2发病猪采集病料,利用PCR技术进行检测,设计特异性引物扩增部分PCV2阳性毒株的全基因,与国内外已发表毒株相应的基因序列比对分析并构建遗传进化树,以便分析PCV2在豫南地区的流行情况和分子遗传变异规律,为PCVD的防控和基因型疫苗的研发奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品采集 2015年-2018 年期间分别采集豫南地区疑似PCV2感染猪的淋巴结、脾及肺脏组织样品,共157份,置-80℃保存以备用。
1.1.2 主要试剂 2×TaqMix混合酶,南京诺唯赞生物科技有限公司(Vazyme)产品;PMD18-T vector、DNA Marker,大连宝生物工程公司(TaKaRa)产品;DNA抽提试剂盒、胶回收试剂盒,爱思进生物技术(杭州)有限公司产品。
1.1.3 主要仪器 PCR仪(MyCycler),Bio-Rad公司产品;低温离心机(5920 R),德国Eppendorf公司产品;琼脂糖凝胶电泳仪(JY-SPAT),北京君意东方电泳设备有限公司产品;紫外成像仪(VWR82026-836),美国 UVP 公司产品等。
1.2 方法
1.2.1 病料的处理 取病料1 g左右作为待检样品进行研磨,用生理盐水按1∶5比例稀释成乳剂反复冻融3 次,12 000 r/min离心5 min,取上清分装,置于-80℃保存备用。按DNA抽提试剂盒的方法提取病毒DNA。
1.2.2 引物的设计与合成 登录GenBank参照PCV2序列设计引物,P1/P2为样品检测引物,目的片段为1 154 bp;A1/A2为扩增全基因引物,扩增出的片段大小为1 767 bp。引物使用终浓度为10 μmol/L,稀释后置-20℃保存。引物序列如表1所示。
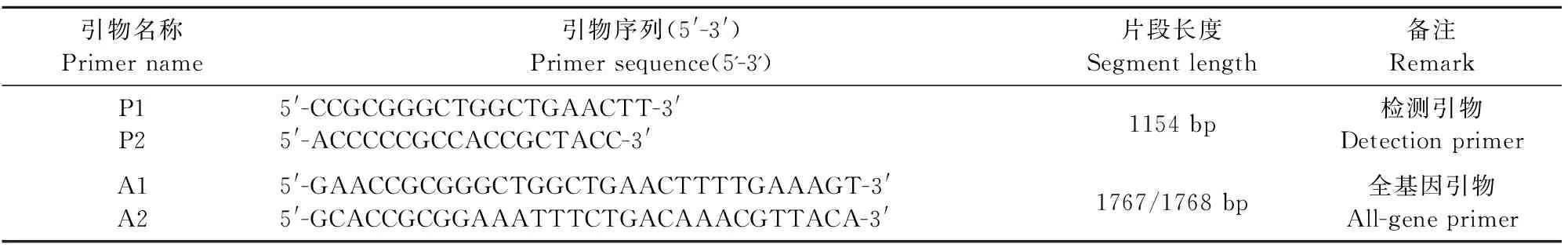
表1 PCR引物序列
1.2.3 病料PCR的检测 按DNA抽提试剂盒的方法提取病毒DNA,以P1/P2(表1)作为特异性引物检测PCV2,反应体系为25 μL/sample:上、下游引物(10 μmol/L)各0.5 μL,2×TaqMix12.5 μL,ddH2O 8.5 μL,DNA模板3 μL。反应条件:94℃预变性5 min;94℃变性40 s,60℃退火40 s,72℃延伸50 s,35个循环;72℃延伸7 min。PCR产物通过12 g/L琼脂糖凝胶电泳进行检测。
1.2.4 PCV2阳性毒株全基因组的扩增及序列分析 利用A1/A2引物对PCV2阳性标本进行PCR扩增,反应体系为50 μL/sample:DNA模板3 μL,2×TaqMix25 μL,上、下游引物(10 μmoL/L)各1.0 μL,ddH2O 20 μL。PCR反应条件:94℃预变性5 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,35个循环;72℃延伸7 min;4℃保存。用10 g/L琼脂糖凝胶电泳检测PCR产物。产物胶回收纯化后与PMD-18T载体连接,用A1/A2引物进行菌液PCR鉴定,筛选阳性克隆,抽提质粒经酶切鉴定正确后送至上海杰李公司进行序列测定。测序所获得的基因序列应用生物软件Lasergene、MEGA5.2分析。
1.2.5 所用参考毒株序列 本研究所用参考毒株序列见表2。
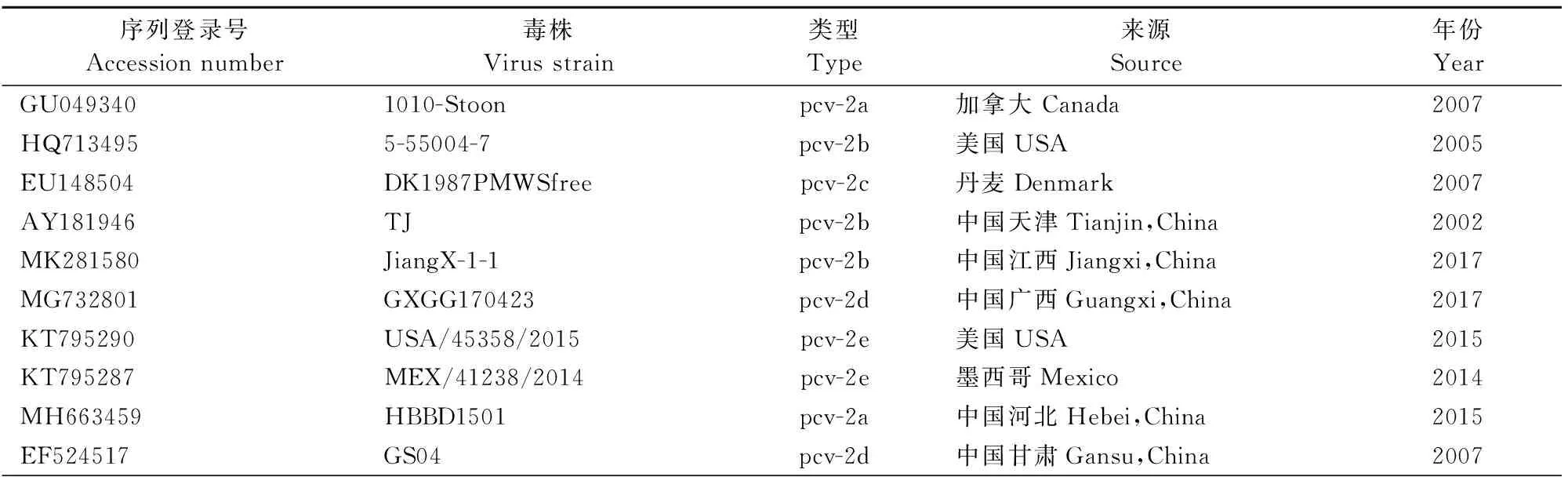
表2 PCV2参考毒株信息
2 结果
2.1 病料PCR检测结果
2015年-2018年共采集豫南地区疑似PCV2感染样品157份,使用引物P1和P2进行PCR检测。共有43份扩增出约1 154 bp大小的目的片断,与预期长度一致,为PCV2阳性,样品阳性率为27.39%。部分阳性结果见图1。
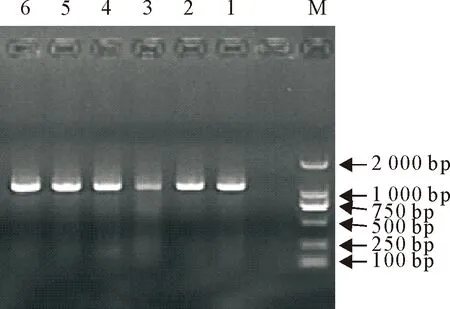
M.DNA 标准DL 2 000; 1~8.扩增的目的片段M.DNA Marker DL 2 000; 1-8.PCR products using Pland P2 primers
2.2 阳性样品全基因组的扩增和基因组进化分析
2.2.1 PCV2全基因扩增结果 利用PCV2特异性引物A1和A2通过PCR扩增PCV2阳性病料的全基因,扩增产物经10 g/L琼脂糖凝胶电泳后,在2000bp处有特异性条带,大小约为1.7kb,与预期一致,见图2。将扩增的全基因PCR产物连接载体克隆测序,得到13株PCV2豫南株全基因序列,长度均为1 767 bp。分别命名为YuNan1-13。

M.DNA 标准DL 2 000;1~18.PCV2全基因扩增产物M.DNA Marker DL 2 000; 1-18.The PCR products of the complete genome of PCV2
2.2.2 PCV2全基因的序列分析 用DNAStar软件对获得的13株PCV2基因序列与国内外已发表的10株代表毒株的全基因序列进行同源性比较,结果见图2。序列分析结果显示本试验所获得的13株全基因序列之间的核酸同源性为94.2%~99.8%,与国内外已发表毒株同源性为90.7%~99.4%。
2.2.3 PCV2全基因遗传进化树分析 为了进一步探讨分离株基因的遗传进化关系,本研究所获得的13株毒株与10株参考毒株构建进化树,结果见图3。遗传进化关系显示,13株豫南分离株可分为三大分支(PCV2a、PCV2b和PCV2d)。其中有10株属于PCV2d,2株属于PCV2b,1株属于PCV2a,未发现其他亚型。
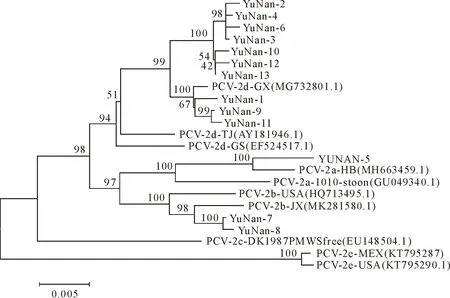
图3 PCV2分离株全基因组系统进化树
2.2.4 13株PCV2 ORF2氨基酸序列分析 通过DNAStar分析软件,将13株PCV2的ORF2与10株参考毒株推导的氨基酸序列进行比对,结果13株豫南分离株ORF2氨基酸同源性为86.8%~100%,与10株参考毒株ORF2氨基酸序列同源性为80.9%~99.6%。PCV2a基因型分离株与参考毒株ORF2氨基酸同源性为93.5%~97.9%,PCV2b基因型分离株与参考毒株ORF2氨基酸同源性为97.0%~98.3%,PCV2d基因型分离株与参考毒株ORF2氨基酸同源性为95.3%~99.1%。氨基酸序列比较和分析结果显示,PCV2各基因型主要在8、53-77、86-91、121、130-134、151、169、185-191、203-217、232的氨基酸位点上表现不同,PCV2a其特异性氨基酸位点在77D、86-91TNKISI,PCV2b其特异性氨基酸位点在89R、210E,PCV2d其特异性氨基酸位点在89L、90T、134N。10株PCV2d和3株PCV2d参考毒株的ORF2氨基酸分析比对发现,近年来分离的PCV2d毒株的ORF2氨基酸序列与2010年前参考毒株对比发现,氨基酸8Y变异为8F,59位R或A变异为K,68A变异为N,151P变异为T。
3 讨论
PCV2不但是一种基因组较小,且有较高进化速率的DNA病毒,而且还是影响养猪业经济发展的重要病原体[13]。目前,在我国不同地区均具有一定的感染率,且分布广泛。但关于PCV2近年来在豫南地区的流行情况报道较少。本研究通过对来自2015年—2018年期间采集的豫南地区疑似PCV2感染的157份样品采用PCV2特异性检测引物进行PCR检测,检测出43 份PCV2阳性样品,阳性率达27.39%。这一结果接近连慧香等[14]的调查结果,但远远低于黄立等[15]和曲哲会等[16]的调查结果,说明豫南地区当前采取的PCV2 综合防控措施效果较好,但PCV2感染依然存在且较为严重。另外,本研究采集病料的猪场大部分进行了PCV2疫苗的免疫,还有如此高的感染率,这可能与病毒的变异有关。
据资料报道,国内PCV2感染主要流行的有PCV2a亚型、PCV2b亚型和PCV2d亚型,2012 年之后PCV2d逐渐成为优势流行毒株[17]。豫南地区也是PCV2感染较严重的地区之一,但关于PCV2在豫南地区的分子流行病学情况还未见报道,为了解豫南地区PCV2分子流行概况,将检测为PCV2阳性的部分样品进行全基因的克隆、测序并进行序列分析。结果显示,获得的13 株PCV2全基因序列之间的核酸同源性为94.2%~99.8%,与国内外已发表毒株同源性为90.7%~99.4%,表明PCV2各毒株之间相对保守,具有较高的相似性。通过与国内外10株参考株进行遗传进化树分析,发现所得到的全基因序列分为3个亚群,10株属于PCV2d,2 株属于PCV2b,1株属于PCV2a。由此可见,PCV2d基因亚型逐渐成为豫南地区的优势流行毒株。这与李明亮[12]、徐朋丽[18]、时庆贺等[11]和邓文芳等[19]的研究结果基本一致。此外,在PCV2d分支中,本研究10株分离株与2017年分离的MG732801处于同一分支,与较早分离的AY181946和EF524517关系较远。PCV2a分支中,本研究中1株分离株与2015年分离的MH663459处于同一分支,与2007年分离的GU049340关系较远;PCV2b分支中,本研究2株分离株与2017年分离的MK281580处于同一分支,与2005年分离的HQ713495关系较远。以上结果表明,豫南分离株与早期分离株同源性相对较低,与近期分离株同源性相对较高,说明PCV2在豫南地区也在不断变异和进化。
ORF2基因编码PCV2的衣壳蛋白(Cap),是与病毒致病力有关的唯一结构蛋白,参与宿主的免疫应答和病毒复制,该蛋白由233或234个氨基酸构成,其中53-91 aa、121-151 aa和190-210 aa是3 个主要的异构域,包含着4个蛋白质表位:69-83 aa、117-131 aa、132-146 aa和195-202 aa。本研究中,通过ORF2基因编码的氨基酸序列分析发现,PCV2各基因型主要在8、53-77、86-91、121、130-134、151、169、185-191、203-217、232的氨基酸位点上表现不同,这些变异位点基本上都位于衣壳蛋白的抗原表位上,可能会导致衣壳蛋白出现新的表面构象及病毒毒力和免疫原性的改变,从而使疫苗产生的抗体无法正常识别,这将会导致免疫失败的发生。不同基因型有独特基因变异位点,这些独特的基因变异位点可能构成了各基因型特有的表面构象而成为特有的基因型。
通过对本研究获得的10 株PCV2d和3 株PCV2d参考毒株的ORF2氨基酸序列分析比对发现,近年来分离的PCV2d毒株的ORF2氨基酸序列与2010 年前参考毒株对比发现,氨基酸在8、59、68、151位产生变异,而这些位点的改变可能使病毒毒力改变。此外,有报道提出PCV2d毒株大量存在并流行于免疫后的猪场[20],其可能的原因是在疫苗免疫诱导的选择压力下,基因发生了突变,导致PCV2的抗原结构发生了变化,出现具有逃避疫苗免疫能力的PCV2流行毒株,从而导致PCV2d最近几年的广泛流行,其具体原因还有待进一步探索研究。
