犬乳头瘤病毒研究概况
2021-06-24李亚兰杨雅娣邓治邦杨凌宸王爱兵
李亚兰,冯 园,杨雅娣,胡 意,谭 磊,邓治邦,杨凌宸,王爱兵*
(1.湖南农业大学 动物医学院,湖南长沙 410128;2.兽用蛋白质工程疫苗湖南省重点实验室,湖南长沙 410128;3.湘潭市中心医院,湖南湘潭 411100)
近年来,越来越多的脊椎动物乳头瘤病毒(Papilloma viruses,PVs)被发现和鉴定,该类病毒通过感染机体的鳞状或粘膜上皮细胞导致亚临床感染或良性增生,但某些病毒亚型或持续感染会导致人、牛、犬、猫家畜及野生动物(如野猪)等出现上皮增生性病变,而表现出各种临床症状,甚至包括癌症,如人类宫颈癌的发生与人类乳头瘤病毒(Human papillomavirus,HPV)、犬类鳞状细胞癌与犬类乳头瘤病毒(Canine papilloma virus,CPV)的感染密切相关。PVs不仅具有宿主特异性特点,而且基因型多,如已报道的HPV超过200个基因型、CPV有23个基因型[1]。
国外学者在1898年首次发现疣可在犬之间传播,直到1959年才从无细胞提取物中获得可传播的CPV。不同类型的CPV感染犬类的不同部位(如口腔、皮肤、足部等)从而诱发不同的病理特征及临床症状,包括皮肤乳头瘤、口腔乳头瘤、疣状表皮增生、病毒色素斑、鳞状细胞癌等[1]。受CPV感染的犬常会自发恢复,而且体内产生的特异性抗体可以保护它们不受再次感染,所以CPV感染通常不被认为是一种危及生命的疾病[2],但最近有研究表明,CPV引起的良性乳头瘤可恶性转化为鳞状细胞癌[3],并且PVs感染对免疫功能低下的动物形成更大的威胁,比如在严重联合免疫缺陷(SCID)犬内生性乳头瘤中发现的CPV2,其在免疫能力强的动物中没有诱发乳头瘤,同样在实验性接种的犬中也没有引起类型特异性免疫反应[4]。该病毒感染后可影响犬的外貌、导致疼痛,在感染严重的情况下可造成犬的死亡,损害实验犬饲养公司的经济效益,而且影响利用犬类进行科学实验获得相关数据的可靠性。此外,由于犬的自身状况及周围环境因素的影响,病毒也会随新的宿主环境改变而进化,从而出现越来越多的突变体。基于此,本文将对于该病毒的生物学特征、流行情况、感染所致疾病及并发症进行综述,提高对该病毒及所致疾病的认识,为后期的基础及临床研究奠定理论基础,同时提示需要对该病毒进行更进一步临床及预防研究。
1 犬乳头瘤病毒基本生物学特征
CPV为环状、闭合、双链DNA病毒,属于乳头瘤病毒科。病毒特征为无囊膜仅衣壳包裹的球形病毒粒子,呈典型对称的二十面体,直径约为40 nm~60 nm,其基因组大小约为7.7 kb~8.0 kb,是目前所知的PVs中基因组最大的病毒。CPV基因组编码区含有7个~8个开放阅读框(open-reading frames,ORF),按照功能的不同主要分为3个部分:(1)早期转录E区(early-regions,ERs):主要编码非结构的早期蛋白El、E2、E4、E5、E6、E7,参与病毒的复制与转录及基因的表达调控[5]。(2)编码晚期蛋白L区(late-regions,LRs):编码结构蛋白L1和L2,其中L1为主要衣壳蛋白,有种属、类型特异性和中和抗体抗原表位,可自组装成类似病毒的VLPs,能诱导机体产生L1型特异性的中和抗体,具有较强的免疫原性;L2是次要衣壳蛋白,有种属特异性抗原表位;两者共同参与病毒的组装与释放[6-7]。(3)非编码区(non-coding-regions,NCRs):即长调控区(long-control-regions,LCRs)区,位于早期和晚期区之间,该区域不编码任何蛋白,但调节病毒基因转录,是CPVs变异最多的区域[7]。
迄今为止,已鉴定出的23种CPVs类型分布于3个不同的属中:Lambdapapillomavirus(CPV1、CPV6);Taupapillomavirus(CPV2、CPV7、CPV13、CPV17、CPV19、CPV21、CPV22、CPV23);Chipapillomavirus(CPV3、CPV4、CPV5、CPV8、CPV9、CPV10、CPV11、CPV12、CPV14、CPV15、CPV16、CPV18、CPV20)。每一种CPV类型都与特定的病变有关,如在Lambdapapillomavirus属中,CPV1是最常见的类型,除可引起口腔乳头瘤病,还与皮肤乳头瘤和鳞状细胞癌有关[8-9]。在Taupipillomavirus属中,CPV2、7、13、17和19在内生和外生乳头瘤、口腔乳头瘤病和鳞状细胞癌中均有报道[13-16]。皮肤色素斑块与Chipapillomavirus所有类型相关[9-12,17-20,]。
2 犬乳头瘤病毒流行概况
由于犬乳头瘤被认为是一种不危及生命的疾病,因此全球对CPV流行病学进行调查不多,相应的CPV流行病学数据及报道极少。CPV感染在大多数犬群中是地方性的[21],所以需要在不同的国家进一步开展与CPV相关的流行病学调查,特别是在临床表现和易感犬种方面。
现有的PVs流行病学调查显示,并非所有的自然感染都会引起明显的症状,而且病毒DNA可以在人类和一些动物(如犬)的临床健康群体中检测到。如一项研究报告表明有超过50%健康犬皮肤上可检测到CPV-DNA的存在[22],目前尚不清楚属于亚临床感染病例,或只是在其皮肤上携带CPV核酸。在研究中发现CPV1和CPV2是典型犬乳头瘤的主要病毒,其中口腔以CPV1感染为主,其他部位以CPV2感染为主。尽管CPV具有多样性,但也可能是共生的,尤其是CPV2感染的犬比例偏高,将可能会增加癌变的风险[1]。据文献报道CPV在纯种犬中的感染可能比混合品种更为普遍,同时,CPV引起疾病的发生率与狗的年龄和性别之间没有统计学上的显著相关性(P>0.05)[21]。但另一团队在调查中发现,雄性犬患CPV的感染率(60%)高于雌性犬(40%)[23]。因此,在CPV感染流行病学的各方面研究尚需更大规模的调查分析。现有犬乳头瘤病零星报道总结如表1中。
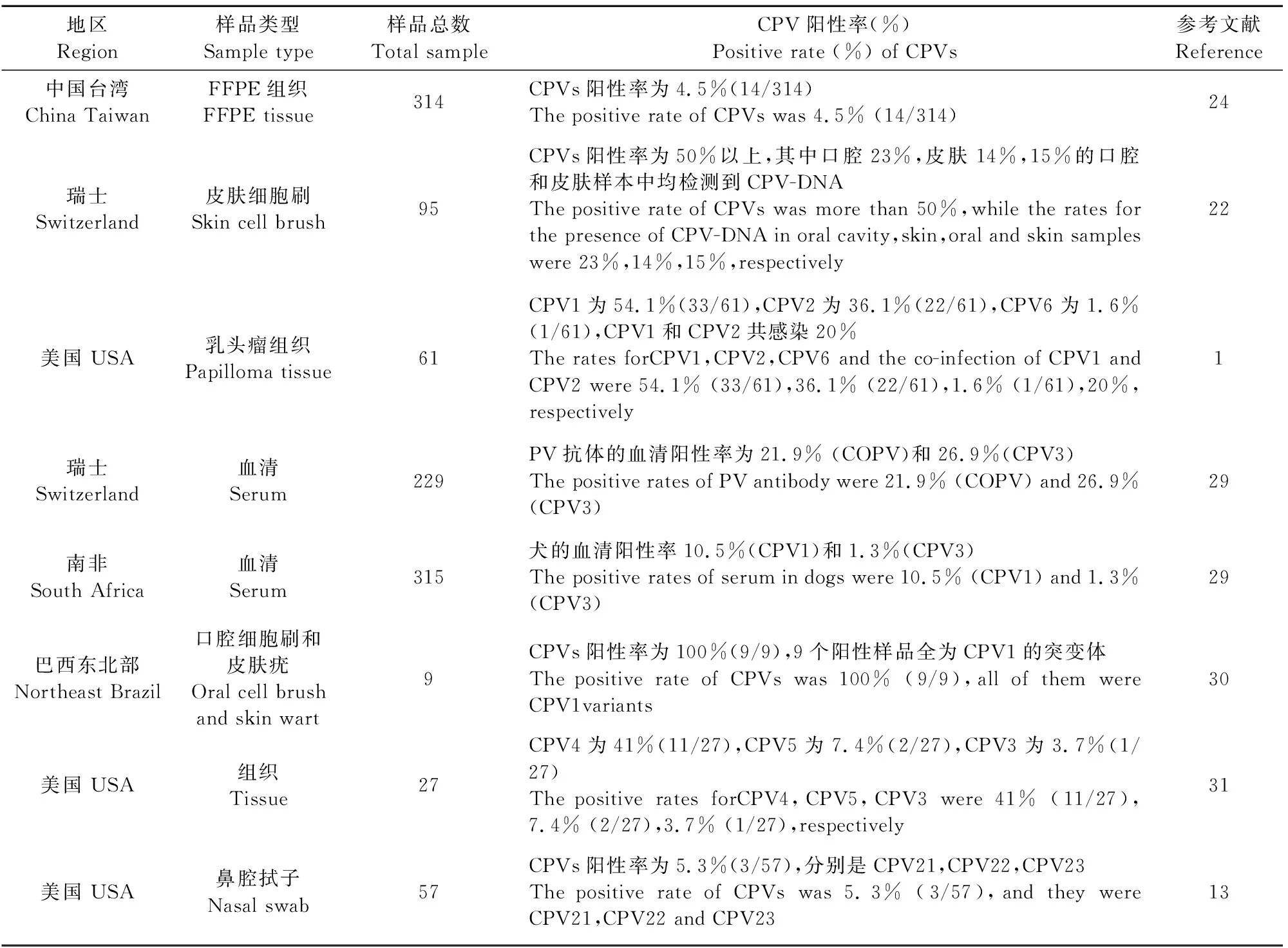
表1 现有犬乳头瘤病流行概况
3 犬病毒性乳头瘤临床症状
乳头瘤是一种增生性上皮病变,通常发生于鳞状上皮或粘膜上皮,许多是由PVs引起的,所以也被称为病毒性乳头瘤。CPV诱发的临床症状具有如下特点:(1)CPV感染可能是亚临床的,也可能引起微小病变或良性肿瘤;(2)受影响部位包括犬的阴茎、外阴、皮肤和结膜等[25];(3)病毒性乳头瘤可能是内生的或外生的,典型地表现为病毒性细胞病变的形态学特征,包括发育异常、胞浆空泡化、细胞增生、肉芽肿、核内包涵体、苏木精和伊红(HE)染色的蓝灰色胞质变性;(4)这些病变大多是暂时性的,但仍有一些持续存在并有可能逐渐发展为恶性鳞状细胞癌,如人类和动物中有一部分HPV和动物PVs明显与癌症的发生有关,因此将这些PVs称为高危型乳头瘤病毒;(5)有数据表明CPV类型与病变类型及其进展之间存在一定的相关性[26]。
CPV诱发的临床症状大致可以分为口腔乳头瘤(Oral papillomatosis)、皮肤乳头瘤(Cutaneous papillomas)、病毒色素斑(Viral pigmented plaques)、鳞状细胞癌(Squamous cell carcinomas)、疣状表皮增生(Epidermodysplasia verruciformis)。在目前的23种CPV类型中,最常见的是Chipapillomavirus属,它们都是从带有色素斑块的犬组织中分离出来的,其中一些新的突变株引起的症状会发展为鳞状细胞癌[26-28],具体的临床症状如表2所示。

表2 CPV诱发的临床症状
4 犬乳头瘤病毒检测方法
多种方法包括电镜、原位杂交、滚环扩增、PCR、ELISA和NGS等,并结合临床表现、流行病学、病理学观察等用于检测和确诊犬CPV相关乳头瘤病。这些方法各有所长,比如免疫组织化学需要相当数量的病毒蛋白来提供阳性信号从而清楚地显示病毒的活性;原位杂交不仅可以确定病毒核酸在固定组织中的定位,从而确定感染的组织和细胞,还可靶向RNA时显示病毒的转录;电子显微镜可实视化病毒特征性结构,并证明生产性感染;滚环扩增法可用于新鲜但不固定的样本(乳头瘤病毒的环状DNA未降解),是一种独立于序列而扩增整个病毒基因组的方法,有助于检测和鉴定PVs。PCR及组织病理学常被用来对CPV进行分析和型别鉴定。下面简要介绍几种常用的CPV检测方法:
4.1 聚合酶链反应
传统聚合酶链式反应(polymerase chain reaction,PCR)技术通过对CPV-DNA中某一特定核苷酸序列进行扩增,然后通过凝胶电泳技术对扩增产物进行定性分析。因此PCR引物设计尤为重要,目前有通用引物和特异引物,前者靶向CPV亚型L1-ORFs的保守序列,后者针对CPV各基因型E1基因保守序列的差异而设计[26]。
PCR检测CPV步骤包括:(1)从疑似样品中分离出犬基因组和病毒DNA;(2)利用犬GAPDH引物对进行PCR确认和分析核酸质量;(3)利用靶向L1基因的简并引物对进行PCR,扩增潜在的乳头瘤病毒基因组片段;(4)利用特异性CPV亚型引物进行PCR确定所属亚型;(5)确定亚型需要进行多次PCR,并且不能确定新的CPV类型或反馈假的结果,此情况下,可使用多引物滚环扩增(multiple-primed rolling-circle amplification,RCA),然后将目的片段克隆再进行测序分析[32]。此外,在PCR过程中,采用较低的退火温度,如50℃左右,可以扩增出范围更广的DNA模板[33]。因此,有必要设计更灵敏可靠的PCR引物,优化反应条件。
4.2酶联免疫吸附法
PVs在传统细胞培养中不易复制,而血清学检测可基于异源表达的病毒抗原。PVs结构蛋白L1的独特性如可自组装形成病毒样颗粒(VLPs)及表现出的高度免疫原性,使得L1-VLP可用于疫苗接种和作为抗原进行血清学检测[34]。研究表明,GST标记的L1蛋白同样可以自发形成五聚体和VLP,并且这种表达技术的结果与杆状病毒表达VLP的替代系统相同[27]。Lange C E等[29]将异源表达的CPV衣壳蛋白L1-N端与GST融合制备的蛋白作为抗原,建立了可同时鉴别两种不同类型CPV抗体的酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)方法,在检测的血清中发现了针对COPV和CPV3的特异性抗体,也发现了大量对这两种抗原都呈阳性的抗体。而未来需要产生和验证其它基于CPV-L1的ELISA方法,以便用于CPV的检测和研究。
4.3 免疫组化
研究人员对3种形式的犬SCCs(黏膜、皮肤和原位SCCs)样本(通过PCR检测含有PVs-DNA)进行了免疫组化(immunohistochemistry,IHC)分析,发现黏膜SCCs和皮肤SCCs在临床上和组织学上相似,都表现为增生性、外生性和侵袭性,均有侵入真皮的非典型细胞索或岛状细胞组成,所有病例均有大核、核仁突出,并有大量核分裂,大多样品中也存在过早的角化细胞。而原位SCCs在临床中出现大量色素沉着、鳞状斑、斑块(伴有溃烂)和结节(溃疡性结节);组织病理学上可见明显的角化过度棘皮病和角膜结块,表皮有大量不典型细胞和早期角化;异型性包括巨核细胞增多症、不等核细胞增多症、高色素、着丝过度、核仁突出、多核细胞和异常的有丝分裂,但基底膜完整,真皮未受影响[36-37]。
4.4 二代测序
二代测序(next generation sequencing techno-logy,NGS)技术的发展与进步,使得一次检测中发现新的和多种病原体变得更加容易。例如Tarka等人[38]通过NGS调查了一家犬舍幼犬胃肠炎的可能感染原因种,发现犬星状病毒是这些幼犬腹泻的原因外,还检测到其他病毒感染,包括一些CPV和一种犬细小病毒(疫苗株)以及一种非常低水平的弯曲杆菌。这项研究表明,NGS在兽医诊断中既可以检测共感染,也可以提供潜在有用的流行病学信息,以确定这些感染的可能来源。但是,高昂的成本使得NGS未能成为首检CPV的有效手段。
5 犬乳头瘤病毒疫苗研制情况
犬乳头瘤病是一种以感染幼犬或免疫缺陷犬为主的自限性疾病。大多数病犬在不经治疗或干预的情况下会自行缓解,但病情严重时,手术无法彻底根除,不仅影响动物机体的正常功能,而且容易引起继发感染和种群间传播。目前预防和治疗CPV感染的方法主要包括疫苗预防法、外科手术摘除法、中药治疗法等,均有一定的治疗效果,但临床创面容易受到饲养环境限制,引起继发炎症反应,造成预后不良,且多有复发[12]。因此,疾病主要以疫苗预防为主,同时加强饲养管理。
5.1 自体疫苗
自体疫苗,在疣病临床治疗中很常见,将被移除的疣制成一个粗制的疫苗,并注射到同一个动物体内。据报道,该方法在治疗犬乳头瘤方面是有一定疗效,用粗糙的疣提取液和佐剂,经肌肉或皮下注射到犬体内,2周~3周后,口腔黏被病毒感染时,阻止了疣的发展[39]。同样使用灭活的粗疣提取物也对预防口腔乳头瘤病具有效果,试验研究显示99只比格犬接种了经福尔马林灭活的COPV疣粗匀浆物,1个月后,接种疫苗的犬能够对病毒感染起到一定的抵抗作用,而对照组不能抵抗病毒的入侵,都感染出现疣。随后,超过6万只比格犬接种了该疫苗,并没有出现不良反应,但是,接种灭活的COPV提取物后,在注射部位偶尔会出现各种上皮性肿瘤,比如SCCs[39]。
5.2 COPV-L1-VLPs疫苗
重组CPV病毒衣壳蛋白L1在体外表达,并且能够自组装成病毒样颗粒(VLPs),这使得新一代安全高效的COPV-L1-VLPs疫苗得以开发并可预防犬感染。在杆状病毒表达系统中,体外表达的COPV主要衣壳蛋白L1形成VLPs,当注射到犬的足垫时,来自免疫犬的血清在被动转移实验中对实验犬提供了完全保护[40]。并且发现这种免疫需要正确折叠显示构象表位的VLP,因为变性的L1蛋白产生的抗体则不能保护动物免受感染。Chen Y等人制备了突变型的COPV-L1-VLPs,该突变株虽然组装成VLPs,但不表达中和构象表位[41]。即使蛋白质被截短,以消除中和构象表位的表达,形成VLPs的能力仍然存在。形成VLPs的能力和表达重要构象表位的能力之间的区别在疫苗设计中至关重要,这表明并非所有VLPs都具有预防作用。PVs衣壳表面的构象依赖性抗原表位的鉴定对于了解病毒与宿主的早期相互作用以及开发有效的PVs疫苗具有重要意义。
5.3 GST-COPV-L1融合蛋白疫苗
目前临床试验中的预防性PVs疫苗是由病毒L1衣壳蛋白在真核表达系统中产生,并以VLPs的形式纯化而成,但是表达效率低,为了评价VLPs是否可用于有效的疫苗接种,Yuan H[42]等人在大肠埃希氏菌中将L1蛋白表达为GST融合蛋白,发现GST-COPV-L1融合蛋白可形成五聚体。尽管这些衣壳样结构并没有组装成VLPs,但在先前验证VLPs疫苗有效性的COPV模型中检测到其免疫原性,并且动物实验结果也显示GST-COPV-L1五聚体完全保护犬免受高剂量病毒对其口腔黏膜的感染[42]。该研究表明虽然缺乏VLPs的形成,但GST-COPV-L1融合蛋白仍然保留其天然的构象。总之,这是一种新的疫苗,可以保护犬免受CPVs感染。GST标记既不干扰颗粒组装,也不干扰表位表达,GST-L1制剂作为疫苗具有保护作用。该疫苗基于GST-L1融合蛋白在细菌中的表达,为生产CPV疫苗提供了一种简单、经济的替代方法,同时,可以作为第二代PVs疫苗的良好候选者。
5.4 COPV-L1-DNA疫苗
DNA可以通过针头注射而在肌肉内传递,也可以通过颗粒介导的DNA递送(particle-mediated DNA delivery,PMDD)到表皮内,每种途径都能诱导细胞和体液免疫,但PMDD提供了强大的细胞和体液反应[43]。研究人员用低剂量的COPV-L1-DNA免疫比格犬,并通过PMDD方式将COPV-L1-DNA递送到皮肤和口腔黏膜,发现可产生适度的全身抗体和T细胞淋巴细胞增殖性免疫反应,从而完全保护比格犬免受高剂量传染性COPV的攻击[43]。DNA疫苗的操作相对简单,也是预防高危型PV的有效策略,它能编码多种抗原,在多价疫苗免疫中可以对抗多种PVs。同时,多核苷酸疫苗抗原的长期持续表达可使T细胞产生持久的反应,建立免疫记忆。
6 展望
CPV引发的犬乳头瘤病是一种传染性较强的疫病,其不仅对犬本身产生影响,而且对基于犬进行科学研究造成不良后果。随着生活水平的提高和生活方式的改变,未来人们对于伴侣犬数量和质量要求增加,因此有必要加强对于CPV的基础研究和应用研发。首先,需针对当前国内外CPV流行病学资料严重缺失的状况,开展流行病学调查,从而对CPV流行程度做到心中有数。其次,CPV基因型的丰富性和高度的异质性导致PVs的分子检测一直是兽医学的一个挑战,在感染检测方面除了改进现有的检测技术之外,还需要取长补短,使不同检测技术和不同学科之间的探索更加深入,将不同的检测技术进行融合应用,研发更快速、灵敏和高特异性的新型检测技术。再者,尽管在CPV预防疫苗方面进行了一些有益的尝试,但仍未有任何一种商业化的疫苗产品面世。此外,除了研发预防性疫苗外,还需要研发治疗性疫苗。虽然COPV-VLPs在动物预防接种中的作用已经被证实,但全长COPV-L1蛋白对VLPs的形成不是必需的,通过用其他病毒蛋白替换L1蛋白的非必需区域来制造嵌合型VLPs颗粒从而具有多种抗原活性,而VLPs似乎能够针对MHCⅠ和MHCⅡ抗原处理途径的表位,表明利用这种技术开发治疗性疫苗是可行的。最后,动物乳头瘤病毒感染的预防性疫苗接种的成功,将为HPV感染疾病的预防策略提供很好的借鉴,因此,有效预防、治疗性疫苗接种及其他治疗方法的研制将是乳头瘤病毒研究的重要目标。
