含兔出血症病毒VP60蛋白病毒样颗粒的兔三联灭活疫苗的研究
2021-06-24韩水仲陈凌燕白晨雨王同燕黄玉欣宋欢欢张浩浩邓均华田克恭
韩水仲,陈凌燕,白晨雨,王同燕,黄玉欣,宋欢欢,张浩浩,石 晶,邓均华*,田克恭*
(1.国家兽用药品工程技术研究中心,河南洛阳 471000;2.普莱柯生物工程股份有限公司,河南洛阳 471000;3.长春西诺生物科技有限公司,吉林长春 130000)
兔病毒性出血症(Rabbit hemorrhagic disease,RHD)、巴氏杆菌病(Paseurellosis)及产气荚膜梭菌病(Clostridiumperferingensdisease)是危害养兔业最严重的3种急性传染病,3种病的病原分别为兔出血症病毒(Rabbit hemorrhagic disease virus,RHDV)、多杀性巴氏杆菌(Pasteurellamultocida,Pm)和A型产气荚膜梭菌(Clostridiumperfringens,Cp)。目前,预防上述3种传染病主要依靠疫苗免疫。由于缺乏培养兔出血症病毒的敏感细胞系,传统上,RHD的预防主要依靠组织灭活疫苗[1]。但是,RHDV组织灭活疫苗生产具有以下缺陷:首先,组织灭活疫苗的生产需要使用未接种疫苗的敏感兔,而敏感兔不易获得且质量具有不确定性;其次,疫苗生产需使用RHDV强毒感染兔,需要配备负压动物房以及专门的GMP生产线,不利于大规模生产且存在潜在的生物安全风险;再者,由于用兔增殖活毒,存在动物伦理与福利问题。近年来,随着生物技术的发展,通过基因工程手段构建可表达有效蛋白以用于动物疫病预防的亚单位疫苗产品逐渐增多,相对于传统疫苗,亚单位疫苗具有生产成本低,有效抗原含量高等优点。因此,用基因工程技术研发RHD亚单位疫苗成为趋势。目前国内经批准的利用重组VP60蛋白预防RHDV的疫苗有江苏省农业科学院兽医研究所开发的“兔出血症病毒杆状病毒载体灭活疫苗(BAC-VP60株)”产品及普莱柯生物工程股份有限公司开发的“兔出血症病毒杆状病毒载体灭活疫苗(RHDV-VP60株)”,但将其与多杀性巴氏杆菌和产气荚膜梭菌联合制备三联疫苗用于预防传染病尚未见相关报道。本研究主要利用构建的表达RHDV VP60蛋白病毒样颗粒及实验室分离鉴定的A型多杀性巴氏杆菌SC0512株及A型产气荚膜梭菌LY株制备三联灭活疫苗并对其进行安全性及免疫效力评价,拟解决传统RHDV组织灭活苗生产过程存在的生物安全风险问题,实现29一针三防。
1 材料与方法
1.1 材料
1.1.1 菌株和毒株 表达兔出血症病毒VP60蛋白病毒样颗粒的重组杆状病毒RHDV-VP60株、兔多杀性巴氏杆菌(A型)SC0512株、兔产气荚膜梭菌(A型)LY株、兔出血症病毒强毒HN株,国家兽用药品工程技术研究中心鉴定和保存。
1.1.2 主要试剂 SF-SFM昆虫细胞无血清培养基,沃美生物公司产品;改良马丁培养基、酪蛋白胨、酵母浸粉,北京奥博星生物技术有限公司产品;甲醛,国药集团化学试剂有限公司产品;硫柳汞钠,上海沪丰生物科技有限公司产品。
1.1.3 实验动物 1.5 kg~3.0 kg健康易感兔,RHDV HI抗体效价低于1∶4,购自河南省康达实验动物有限公司;16 g~20 g Balb/c小白鼠,购自北京维通利华实验动物有限公司。
1.1.4 主要仪器 生物反应器(Celligen 115),美国NBS公司产品;发酵罐(10JS-7000C),上海保兴生物设备工程有限公司产品。
1.2 方法
1.2.1 重组VP60蛋白病毒样颗粒的制备 将重组杆状病毒RHDV-VP60株按MOI=1的剂量接种在生物反应器中长至2.0×106个/mL~2.5×106个/mL的Sf9细胞,培养条件为27℃、80 r/min、DO 50%、pH6.5。培养96 h后,收获细胞培养物,冻融后,离心去除细胞碎片,取样测定其对1%人O型红细胞的血凝效价,其余加入终浓度为0.5 g/L的甲醛溶液,充分混匀,37℃灭活24 h,测定灭活抗原的血凝效价。
1.2.2 兔多杀性巴氏杆菌菌液的制备 将兔多杀性巴氏杆菌SC0512株种子液按培养基总量的1%~2%接入,37℃、pH 7.0、DO 20%~30%条件下,采取流加补料法发酵培养18 h~24 h,收获菌液,取样进行活菌计数,其余加入终浓度为1.5 g/L甲醛,充分混匀,37℃灭活24 h。
1.2.3 兔产气荚膜梭菌菌液的制备 兔产气荚膜梭菌(A型)LY株按培养基总量的2.5%~5%接入,37℃、pH7.0、通入氮气保压0.01 MPa、转速100 r/min条件下,采取手动补糖法发酵培养4 h~5 h,收获菌液,取样进行毒素含量测定,其余加入终浓度为0.5 g/L的甲醛溶液,充分混匀,37℃灭活脱毒72 h。毒素含量用小鼠测定,将收获的菌液离心过滤后,滤液用明胶缓冲液做不同梯度稀释,分别接种小鼠,观察24 h,根据小鼠死亡情况计算毒素含量。
1.2.4 三联灭活疫苗的制备 按上述方法共制备3批抗原,并按下述方法混合后制备3批疫苗。用PBS(0.015 mol/L,pH 7.0)将重组兔出血症病毒VP60蛋白液分别稀释至血凝效价为1∶213,兔多杀性巴氏杆菌SC0512株菌液稀释至1.0×1010CFU/mL,兔产气荚膜梭菌(A型)LY株菌液稀释至200个小鼠MLD/mL,然后分别按3∶11∶10进行混合。将上述抗原混悬液与氢氧化铝胶按4∶1的体积比混合,同时按总量的0.1 g/L加入硫柳汞,充分搅拌混匀。
1.2.5 三联苗的安全检验 将3批疫苗分别经皮下途径接种5只健康易感兔,4.0 mL/只,接种后观察14 d,每日观察兔的精神、采食、饮水、粪便、体温等。
1.2.6 三联苗的最小免疫剂量测定 将3批疫苗分别以0.5 mL/只、1.0 mL/只、2.0 mL/只剂量经皮下途径注射1.5 kg~3.0 kg的健康易感兔,每个剂量免疫15只,同时设15只不免疫作为攻毒对照。
1.2.6.1 兔出血症病毒HI抗体效价测定及攻毒 免疫后14 d,所有兔均通过耳缘静脉采血,分离血清,使用8个血凝单位抗原测定血清中抗兔出血症病毒HI抗体效价。将免疫兔及对照兔采血后转至负压强毒区,各皮下注射兔病毒性出血症病毒HN株1.0 mL(含1000LD50),攻毒后观察7 d,统计各组兔的死亡率。
1.2.6.2 兔多杀性巴氏杆菌攻毒 免疫后21 d,取各剂量免疫兔及对照兔各5只转至负压强毒区,每只经皮下接种兔多杀性巴氏杆菌菌液1 mL(含3~10 CFU/mL),攻毒后观察10 d,统计各组兔的死亡率。
1.2.6.3 兔产气荚膜梭菌攻毒 免疫后21 d,取各剂量免疫兔及对照兔各5只,每只经耳缘静脉注射1个致死剂量的兔产气荚膜梭菌毒素,攻毒后观察7日,统计各组兔的死亡率。
1.2.7 三联苗的免疫持续期试验 将3批疫苗以2.0 mL/只经颈背部皮下注射1.5 kg~3.0 kg的健康易感兔,分别于免疫后0 d、14 d、21 d、30 d、90 d、180 d、210 d时,选择5只免疫兔连同对照兔采血,用8个血凝单位抗原检测其血清中抗兔出血症病毒HI抗体效价,同时分别用兔出血症病毒、多杀性巴氏杆菌、产气荚膜梭菌毒素攻毒,统计攻毒保护情况。
2 结果
2.1 三联苗的制备
用重组杆状病毒RHDV-VP60株制备的3批重组VP60蛋白液对1%人O型红细胞的HA效价为1∶218~1∶219,灭活后HA效价为1∶217~1∶218。将蛋白和菌液灭活并检验合格后,添加20%铝胶佐剂混合均匀制备疫苗,共制备3批疫苗,批号20131201~20131203。
2.2 三联苗的安全检验
将3批疫苗分别经颈背部皮下超剂量接种1.5 kg~3.0 kg的健康易感家兔5只,4.0 mL/只。接种后观察14 d,接种兔精神、采食、饮水、粪便、体温均无异常。
2.3 三联苗最小免疫剂量测定
免疫后14日,0.5 mL/只剂量组免疫兔血清RHDV HI抗体效价为1∶8~1∶32,1.0 mL/只剂量组为1∶16~1∶64,2.0 mL/只剂量组为1∶32~1∶128(见图1);免疫后14 d,用兔出血症病毒HN株攻毒,对照兔全部(5/5)死亡,0.5 mL/只剂量免疫组保护率60%~80%(3/5~4/5),1.0 mL/只和2.0 mL/只剂量免疫组保护率100%(5/5)。免疫后21 d,用兔多杀性巴氏杆菌攻毒,对照兔全部(5/5)死亡,0.5 mL/只剂量免疫组保护率60%~80%(3/5~4/5),1.0 mL/只剂量免疫组保护率80%~100%(4/5~5/5),2.0 mL/只剂量免疫组保护率100%(5/5);免疫后21 d,用兔产气荚膜梭菌毒素攻毒,对照兔全部(5/5)死亡,0.5 mL/只剂量免疫组保护率40%~60%(2/5~3/5),1.0 mL/只剂量免疫组保护率80%~100%(4/5~5/5),2.0 mL/只剂量免疫组保护率100%(5/5)(见表1)。
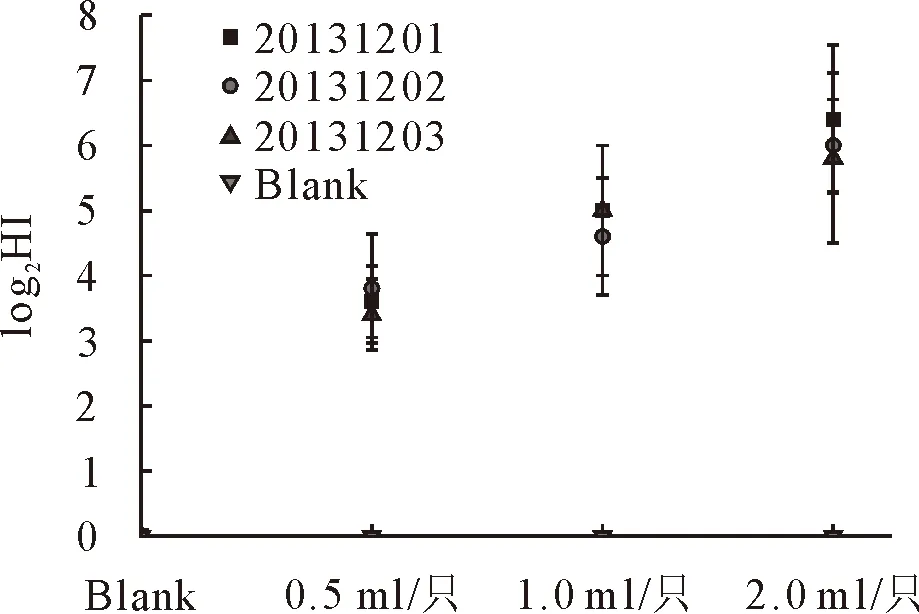
图1 不同剂量免疫兔免疫14 d时血清中抗兔出血症病毒HI抗体效价

表1 3批疫苗不同剂量免疫兔攻毒保护结果
2.4 三联苗免疫持续期
疫苗免疫后不同时间测定兔血清中抗兔出血症病毒HI抗体效价,免疫后14 d,血清HI效价为1∶16~1∶64;免疫后30 d,血清HI效价达到1∶64~1∶512,至免疫后210 d,血清HI效价为1∶16~1∶32(见图2)。免疫后210 d攻毒,兔出血症病毒HN株攻毒,对照兔80%(4/5)死亡,免疫兔全部(5/5)健活;用兔多杀性巴氏杆菌SC0512株和兔产气荚膜梭菌LY株毒素攻毒,对照兔全部(5/5)死亡,免疫兔保护率80%(4/5)(见表2)。

图2 3批疫苗免疫后不同时间兔血清抗兔出血症病毒HI抗体效价
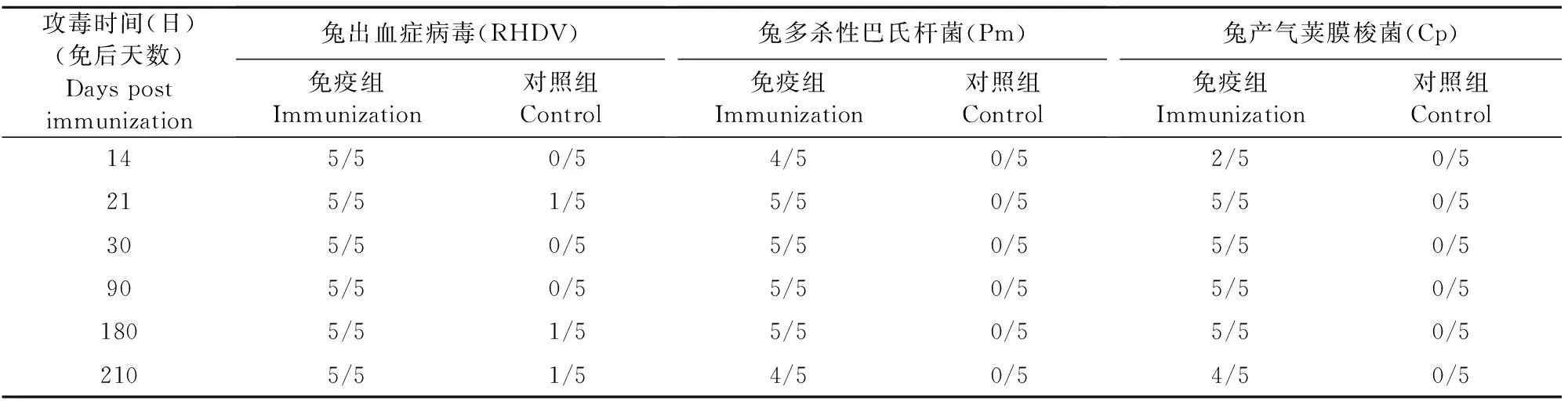
表2 疫苗免疫后不同时间攻毒保护结果
3 讨论
目前用于重组蛋白生产的表达系统主要有大肠埃希氏菌、酵母、杆状病毒表达系统等。国内外有报道使用上述三种表达系统分别表达兔出血症病毒VP60蛋白均取得良好的免疫保护效果[2-11]。本研究选择杆状病毒表达系统用于兔出血症病毒抗原的生产。相对于酵母和杆状病毒真核表达系统,用原核表达系统表达的重组蛋白缺少糖基化、翻译后修饰等,使重组表达蛋白在生物活性上存在缺陷,表达的蛋白易出现包涵体[10]。虽然有报道将兔出血症病毒VP60基因与β-半乳糖苷酶、SUMO等共表达可促进可溶性表达,但去除该标签需经过酶切和纯化,不利于大规模生产[2-3]。用酵母表达重组蛋白,其表达的蛋白可组装成病毒粒子,免疫原性良好,兔免疫后可抵抗兔出血症病毒的感染,但由于成本等原因,在兽用生物制品应用较少。用杆状病毒表达重组蛋白,重组蛋白可溶性表达,蛋白活性高,更加便于产业化,且在兽医上已开发出相应的亚单位疫苗用于猪瘟、猪圆环病毒病等的预防。国内外有报道用杆状病毒表达重组VP60蛋白,但可能由于病毒株或表达系统不同,出现重组蛋白未形成病毒样颗粒[6]。本研究所用的重组杆状病毒RHDV-VP60株表达的VP60蛋白在细胞内可折叠成病毒样颗粒,电镜下观察,其形态同天然病毒相似,可最大限度保持天然病毒的生物活性(未发表资料)。杆状病毒表达的重组蛋白产量较低,是制约其规模化应用的原因之一[9]。通过重组杆状病毒感染家蚕,将家蚕处理后获得重组蛋白虽然产量高,但可能存在质量控制等问题,目前还未见规模化生产[6,9,12]。国内有报道构建的重组杆状病毒表达的VP60蛋白含量为1∶212~1∶213[11,13]。本研究所用重组杆状病毒表达的VP60蛋白含量不低于1∶218,与文献报道相比,表达量至少提高了32倍,且免疫效果良好,节约了生产成本,便于规模化生产。
兔产气荚膜梭菌疫苗的保护效果与其疫苗中类毒素的含量呈正相关[14]。用产气荚膜梭菌类毒素制备的疫苗免疫动物也可获得良好的保护效果[15]。虽然通过浓缩可提高毒素含量,但这无疑增加了企业生产成本[16-17]。为提高发酵菌液中毒素的含量,适宜的培养基及培养条件至关重要。本研究通过系列筛选,筛选出一种适宜产气荚膜梭菌LY株生长的培养基,收获的发酵菌液中,其毒素含量不低于400 MLD/mL,显著高于《中华人民共和国兽用生物制品规程》(2000年版)及其他研究者报道[17-18]。
总之,本研究开发的兔三联灭活疫苗生产成本低,易规模化生产,免疫效果确实,解决了传统RHDV组织灭活苗生产过程存在的生物安全风险问题,同时实现了一针三防。
