柴黄清胰活血方对重症急性胰腺炎模型大鼠肝脏氧化应激的影响
2021-06-24姜朝丽王天刚晋小宁
付 娟,姜朝丽,王天刚,赵 龙,晋小宁,李 志
(西南医科大学附属中医医院脾胃病科,四川泸州 646000)
急性胰腺炎(acute pancreatitis,AP)是消化系统常见的急腹症之一,尽管大多数AP 具有自限性,但仍有20%~30%可发展为重症急性胰腺炎(severe acute pancreatitis,SAP),其并发症多、病情凶险,院内病死率高达15%[1]。SAP不仅引起胰腺局部的炎症反应,也常引起胰腺以外多器官损伤,肝脏为主要损伤器官之一,肝衰竭是SAP 患者死亡的主要影响因素之一,发生率高达83%[2]。目前重症急性胰腺炎肝损伤的发病机制尚未完全阐明,有关研究表明氧化应激反应为关键的发病机制[3-6],因此早期阻断或抑制氧化应激对防治SAP 合并肝损伤,保护肝功能至关重要。本研究通过观察柴黄清胰活血方对SAP 模型大鼠血清淀粉酶(AMY)、谷丙转氨酶(ALT)、谷草转氨酶(AST)的影响,对比用药后超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、血红素加氧酶-1(HO-1)等氧化应激水平的变化,探讨柴黄清胰活血方对SAP 模型大鼠肝脏损伤的保护作用及可能机制,以期为临床治疗提供依据。
1 材料与方法
1.1 实验动物
SPF级健康雄性SD大鼠128只,体重(250±30)g,8 周龄,购自成都达硕实验动物有限公司[许可证号:SCXK(川)2015-030)]。动物实验通过西南医科大学伦理委员会批准(审批号:2020885)。
1.2 实验药物及试剂
柴黄清胰活血方成药由西南医科大学附属中医医院制剂室提供,通过相关工艺制成流浸膏,流浸膏生药含量为2.02 g/g(批号:20180602),本次实验用量为1.2 g/kg。牛磺胆酸钠(sigma,批号:#SLBT9650);戊巴比妥钠(天津兰洪新能源科技公司,批号:170108);HE 染色试剂盒(Solarbio,批号:20191015);MDA、T-SOD、GSH-PX、CAT、ALT、AST 试剂盒(南京建成生物工程研究所,批号:A003-1-2,A001-1-2,A005-1-2,A007-1-1,C009-2-1,C010-2-1);山羊抗鼠IgG(Bioss,批号:AG05187292);山羊抗兔IgG、HO-1抗体(购自CST,批号:27、1#$UNIVPA19-07003308_25);总RNA 提取试剂盒(TIANGEN,批号:#S7801)等;Real-time PCR引物由成都擎科生物有限公司合成。

表1 实时荧光定量PCR的引物序列
1.3 动物模型制备、分组及给药
适应性喂养1 周后SD 大鼠随机分为4 组(n1=32),即Blank、Sham、SAP 和Chaihuang 组;各组再分6 h、12 h、24 h、48 h 4 个亚组(n=8)。于实验前12 h开始禁食,但不禁水,称重后,以1%戊巴比妥钠(6 mL/kg)腹腔注射麻醉大鼠,再固定,剃毛备皮,消毒,铺巾,沿腹中线于剑突下剪一长2~3 cm切口,逐层入腹,找到十二指肠和胰腺,在近肝门处用小动脉夹闭暂时性阻断胰胆管,清洁磨钝尾静脉针头沿十二指肠乳头对侧肠壁无血管区缓慢进入胰胆管约0.5 cm,0.1 mL/min 缓慢匀速推注5%牛磺胆酸钠(1 mL/kg BW),拔针后压迫穿刺点5 min,当胰腺组织开始肿胀并初步呈现充血、点状出血征象时,初步判断模型制备成功,观察造模成功后,松开动脉夹并逐层缝合关腹。Sham 组开腹后仅翻动胰腺和十二指肠即逐层缝合关腹,Blank 组不予任何干预。术后背部皮下注射4 mL 生理盐水补充术中失水,术后自由饮水,注意保暖。麻醉苏醒后,Chaihuang 组灌胃柴黄清胰活血方流浸膏药液(1.2 g/kg),Sham组和SAP组灌胃给予生理盐水(10 mL/kg),均隔6 h给药1次。
1.4 标本采集和指标检测
术后6、12、24、48 h 分批取材各组8 只大鼠,取材时沿原切口剪开腹腔,观察大鼠腹腔、胰腺、肝组织的大体形态变化。腹主动脉取血,静置后离心-20 ℃保存以备生化检测;10%甲醛固定部分新鲜肝脏组织备测病理检查(参Camarg法进行双盲病理评分);余下部分制备匀浆冻存于-80 ℃冰箱备测Western Blot、RT-PCR,各项指标均按试剂盒说明书严格操作。
1.5 统计学处理
实验数据使用prism 7.0 软件进行统计学分析,结果以均数±标准差(x±SD)表示,多个样本均数比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD法,P<0.05为差异有统计学意义。
2 结果
2.1 重症急性胰腺炎模型大鼠制备后胰腺及腹腔观察
大鼠胰腺呈不同程度的充血、水肿,部分可见出血、坏死和脂肪皂化斑;HE 染色可见叶间隙腺泡间隙明显扩张,部分腺泡坏死,坏死灶内有大量炎细胞浸润;腹腔可见淡黄色或血性浑浊腹水,肠管颜色变暗,管壁充血水肿明显,肠腔内积聚大量粪便和液体,腹腔脏器呈不同程度粘连,表明重症急性胰腺炎大鼠模型制备成功,见图1。

图1 大鼠胰腺组织形态结构(HE染色,× 200)
2.2 HE染色肝组织的光镜下观察及病理学评分
Blank组和Sham组肝细胞形态正常,排列整齐,未见细胞凋亡、坏死及炎细胞浸润等改变,两组对比无明显差异。SAP组6 h肝细胞水肿,空泡形成,少许红细胞堆积和炎细胞浸润;12 h肝索排列紊乱,点状细胞坏死,炎细胞浸润增加;24 h 肝血窦扩张,组织间红细胞充盈,见较多细胞嗜酸性变,坏死面积增大;48 h 肝细胞水肿较24 h 稍减轻,肝索排列紊乱,仍见炎细胞浸润。Chaihuang 组较同时间点SAP 组,肝细胞损伤明显减轻,小叶结构尚存,炎性浸润和细胞嗜酸性变少见,未见明显肝细胞坏死,见图2。Sham 组与Blank 组比较,肝脏组织病理评分差异无统计学意义(P >0.05);SAP组、Chaihuang组较Sham组病理评分明显升高(P<0.05);Chaihuang 组病理评分较SAP组降低(P<0.05),见表2。

图2 各组大鼠肝组织形态结构(HE染色,× 200)

表2 各组大鼠肝组织病理学评分(x±SD,n=8)
2.3 大鼠血清AMY、ALT、AST比较
与Blank 组相比,Sham 组血清AMY、ALT、AST水平无明显差异(P >0.05)。与Sham组相比,SAP组和Chaihuang 组各时点AMY、ALT、AST 含量均明显升高(P<0.05)。与SAP组相比,Chaihuang组各时点AMY、ALT 含量均显著降低(P<0.05);12、24、48 h AST 水平明显降低(P<0.05),6 h AST 水平无明显差异(P >0.05),见图3~图5。
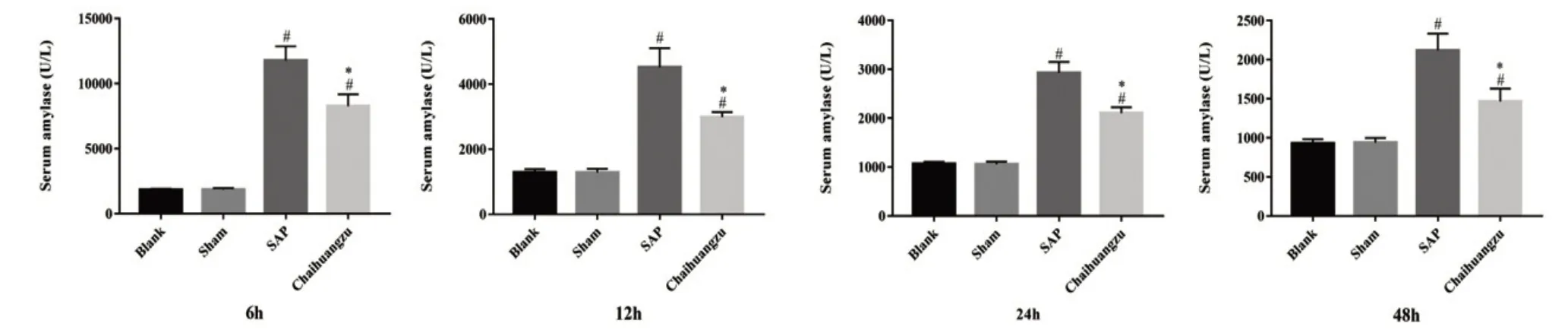
图3 各组大鼠AMY比较
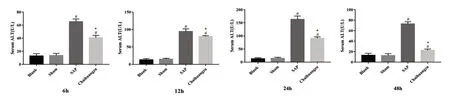
图4 各组大鼠ALT比较

图5 各组大鼠AST比较
2.4 大鼠肝组织S〇D、CAT、GSH-Px、MDA比较
与Blank 组相比,Sham 组SOD、CAT、GSH-Px、MDA水平未见明显差异(P >0.05)。与Sham组相比,6、12、24 h SAP 和12 h Chaihuang 组SOD 水平降低(P<0.05);各时点SAP 组和Chaihuang 组CAT、GSH-Px 水平均明显降低(P<0.05);12、24、48 h SAP 组MDA 水平明显升高(P<0.05)。与SAP 组相比,Chaihuang 组各时点CAT 水平较高(P<0.05);12、24、48 h Chaihuang 组GSH-Px 水平升高(P<0.05);12、24、48 h Chaihuang 组MDA 水平降低(P<0.05),见图6~图9。

图7 各组大鼠肝组织CAT比较

图8 各组大鼠肝组织GSH-Px比较
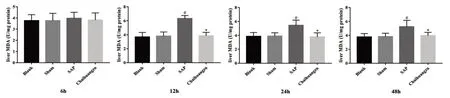
图9 各组大鼠肝组织MDA比较
2.5 大鼠肝组织H〇-1 mRNA表达比较
与Blank组相比,Sham组HO-1 mRNA表达水平无明显差异(P >0.05)。SAP 和Chaihuang 组各时间点较Sham 组HO-1 mRNA 表达水平均明显升高(P<0.05)。12、24、48 h Chaihuang组HO-1 mRNA水平较SAP组更高(P<0.05),见图10。

图10 各组大鼠肝组织H〇-1 mRNA比较
2.6 大鼠肝组织H〇-1蛋白表达比较
与Blank组相比,Sham组HO-1蛋白表达无明显差异(P >0.05);6、12、24 h SAP 组和Chaihuang 组HO-1 水平较Sham 组明显升高(P<0.05)。Chai⁃huang 组6、12、24 h HO-1 蛋白表达较SAP 组更高(P<0.05),见图11。

图11 各组大鼠肝组织H〇-1蛋白比较
3 讨论
SAP 为临床危急重症,极易合并多器官功能损害,以肝脏为主要损伤器官,且与病情程度呈正相关[2]。SAP 合并肝功能损害较为复杂,ALT、AST 是急性肝细胞损伤的敏感标志,广泛运用于肝功能及SAP 肝损伤评价[7-8]。本实验结果显示,模型组和柴黄组ALT、AST活性明显高于假手术组,柴黄组总体水平低于模型组,结合AMY 含量的改变,提示造模后大鼠确有不同程度的肝功能受损,而柴黄清胰活血方对SAP模型大鼠肝损伤有保护作用。
氧化应激被认为是AP发病机制的重要调节器,是指机体受各种因素刺激造成氧化和抗氧化系统之间的平衡被打破,导致组织损伤,干扰器官正常代谢活动的一种应激状态[9]。在SAP病程进展过程中胰腺腺泡细胞受损产生大量的氧自由基,过量的氧自由基可视为重要的炎性介质加重胰腺局部的炎症反应,且可增加毛细血管通透性,损伤血管内皮细胞,释放大量有毒物质引起扳机样级联放大连锁反应,导致胰腺及胰外多脏器损伤等改变,尤其是肝脏。有研究[10]表明脂质过氧化的加重和抗氧化水平的下降加重了AP模型大鼠的肝损伤,评价氧化应激反应可通过检测氧化应激中间产物,如MDA可反映机体脂质过氧化和细胞受自由基攻击的损伤程度;亦或检测体内抗氧化酶,如SOD、CAT、GSH-Px等可间接反映机体清除活性氧的能力。本实验研究制备SAP 大鼠模型后,病理结果显示模型大鼠存在明显肝损伤,其肝索排列紊乱,伴不同程度的细胞嗜酸性变、肝细胞坏死亦或炎性细胞浸润;肝组织SOD、CAT、GSH-Px活性降低,MDA含量升高,表明肝损伤进程存在明显的氧化应激失平衡改变。而柴黄组SOD、GSH-Px、CAT 水平明显高于模型组,MDA 活性低于模型组,提示柴黄清胰活血方可恢复肝组织氧化和抗氧化平衡,增强抗氧化、减弱过氧化以保护SAP并发肝损伤。
HO-1是血红素降解的限速酶,能够在代谢过程中发挥抗氧化、抗炎、抗凋亡、抗增殖的作用,已成为一种重要的防御分子[11]。Zhang 等[12]实验证明HO-1通过抗炎和抗氧化机制减少脂质过氧化,防止细胞凋亡或衰竭,降低胰腺和肝脏损伤相关标志物的表达,尤其在减轻炎症反应,保护胰腺和肝脏等器官免受损伤方面发挥重要作用。本实验通过测定SAP 模型大鼠肝组织HO-1 蛋白和mRNA 的表达,结果表明柴黄组和模型组较假手术组数值升高,结合组织病理学结果提示HO-1 参与SAP 并发肝损伤过程,证实了HO-1 是一种细胞保护酶,在炎症等应激状态下可启动机体适应性(代偿性)保护机制[11-12];而柴黄组HO-1 水平较模型组更高,提示柴黄清胰活血方可通过诱导HO-1表达的上调对SAP模型大鼠肝损伤起到保护作用。
祖国医学认为SAP多因酒食不节、情志失舒、外邪侵袭、虫积内扰等导致湿、热、瘀、毒结聚中焦,脾胃升降传导失司,肝胆气机疏泄不利,气滞血瘀,甚至血败肉腐,阴阳离绝。柴黄清胰活血方由生大黄、柴胡、黄芩等14味中药组成,具有清热解毒、通腑泄浊、疏肝利胆、活血化瘀、缓急止痛之功。现代药理学研究证实,大黄具有抗炎、改善微循环、清除内毒素、促进肠蠕动等药理活性,能有效减轻胆汁及胰液淤积,降低SAP大鼠血清ALT、AST,减轻SAP并发肝损伤[13]。黄芩的主要成分为黄酮类化合物,有抗炎、抗氧化、清除氧自由基等作用,可下调SAP 患者NF-κB 活性和炎症因子IL-6 水平,使AMY、ALT 下降,减轻胰腺、肝脏组织损伤[4,8]。柴胡的主要活性成分柴胡皂苷可调控NF-κB/STAT3 信号通路,发挥抗菌、抗炎、增强免疫、解热、镇痛的作用,减轻小鼠肝损伤程度[14];且可提高GSH 等抗氧化水平,降低MDA活性及其引起的交联性损伤[15]。
4 结论
SAP 并发肝损伤是一个多因素、多方面且复杂的病理生理过程。本课题组前期实验研究中已证实柴黄清胰活血方对SAP模型大鼠具有治疗作用[16-18],本研究进一步探讨其对肝损伤氧化应激作用机理,结果显示给予柴黄清胰活血方干预可通过诱导HO-1 表达的上调抑制氧化应激反应(降低MDA 水平),有效提高机体对氧自由基的清除能力(升高SOD、CAT、GSH-Px 活性),从而降低肝损伤相关标志物(ALT、AST)的表达,减轻SAP 模型大鼠肝脏组织病理损伤程度。但本方药味的药理及化学成分复杂,难以解释发挥疗效的可能靶点和信号通路,今后可根据中药多途径、多靶点的作用特点,借助网络药理学分析和阐释组方药对关系及作用机制,并进行深入临床研究,以更好地掌握SAP 并发肝损伤的发病机制,为该病的防治和新药的研究提供新的理论和实践依据。
