耗竭巨噬细胞抑制脂多糖诱导小鼠肾脏及全身炎症损伤的作用研究
2021-06-21安晓宁魏兆楠陈永熙
安晓宁,魏兆楠,沈 艳,史 浩,张 文,陈永熙
(上海交通大学医学院附属瑞金医院a.肾脏科;b.实验医学研究中心,上海 200025)
急性全身性炎症如败血症会诱发细胞因子风暴,严重影响多种器官组织的功能。在此过程中,单核巨噬细胞可经多种途径参与炎症反应,而炎症部位的趋化因子与单核巨噬细胞表面的相应受体作用,可诱导后者活化并向感染部位募集,活化的单核巨噬细胞又可进一步诱导更多的巨噬细胞活化、募集。活化的巨噬细胞除可分泌肿瘤坏死因子α(tumor necrosis factor α,TNF-α) 等促炎因子外,还可调动其他粒细胞和淋巴细胞,共同促进包括肾脏在内的局部和全身炎症反应。机体除了表现为全身炎症反应外,各脏器也会出现相应的病变。组织病理检查可发现炎症细胞在肾脏间质中浸润。临床上,患者处于败血症等全身炎症状态下,可出现蛋白尿、血尿或血液及尿液中肌酐水平升高。
单核巨噬细胞参与了多种疾病的进展,病理检查常可发现巨噬细胞在发生炎症的组织中增殖和浸润[1]。脊髓损伤、帕金森病及佐剂性关节炎等多种动物模型研究显示,耗竭巨噬细胞可改善疾病损伤,但耗竭巨噬细胞对炎症反应所致肾脏损伤的保护作用,目前少有报道[2-3]。本研究采用选择性集落刺激因子1 受体抑制剂GW2580 耗竭小鼠体内的巨噬细胞,观察其对脂多糖(lipopolysaccharide,LPS)诱导的小鼠肾脏及全身炎症反应的作用,探究GW2580 对机体炎症反应及炎症状态下受累肾脏的影响,为进一步探索GW2580 在炎症损伤中的应用提供研究基础。
材料与方法
一、材料
1.动物:本研究所用C57BL/6JNifdc 小鼠购自浙江维通利华实验动物技术有限公司,实验所用小鼠为8~10 周龄,共18 只雄鼠,体重为(25±5)g/只。
2.试剂和仪器:本研究所用仪器包括光吸收酶标仪(BioTek)、流式细胞仪(美国贝克曼库尔特有限公司)、正置荧光显微镜[卡尔蔡司(上海)管理有限公司]。实验试剂包括GW2580(大连美仑生物技术有限公司)、小鼠TNF-α 酶联免疫吸附试验试剂盒(BD Pharmingen,美国)、脂多糖(Sigma 公司,美国)、小鼠F4/80 BB700(BD Pharmingen,美国)、流式细胞术检测染色缓冲液(BD Pharmingen,美国)、红细胞裂解液(BD Pharmingen,美国)、尿液试纸条(美国贝克曼库尔特有限公司)。
二、方法
1.小鼠炎症损伤模型的建立:根据文献[4]的方法,采用腹腔注射LPS(3 mg/kg)的方式进行炎症诱导,建立小鼠炎症损伤模型。首先进行GW2580 耗竭巨噬细胞的预处理实验。GW2580 剂量根据文献及本研究预实验结果采用160 mg/kg[5]。预处理组小鼠(n=9)分别在GW2580 灌胃后第0、4、7 天时处死(每个时间点处死3 只),制备脾脏细胞单细胞悬液,然后采用流式细胞术检测脾脏中巨噬细胞的百分比(第0 天为对照组)。另取小鼠进行GW2580 干预炎症反应的研究(n=9),将小鼠分为3 组,即正常对照组、LPS 组和GW2580+LPS 组,每组各3 只。正常对照组不予药物处理;LPS 组予腹腔注射LPS,16 h 后处死小鼠;GW2580+LPS 组,小鼠首先进行1 周的GW2580 灌胃,在第8 天时予腹腔注射LPS,16 h 后处死小鼠。
2.标本获取:由于小鼠体内炎症反应发生较快,故于建模后16 h,用注射戊巴比妥钠的方法麻醉小鼠后,经眼球采血法留取外周血,进行血清标志物的检测,并用颈椎脱臼法处死小鼠,取其脾脏和肾脏组织。处死前4 h 使用小鼠代谢笼收集尿液标本。
3.小鼠血及尿指标检测:小鼠外周血标本在室温下静置1 h 后,以2 000 r/min 的速度离心10 min(离心半径为85 mm),取上层清液。用酶联免疫吸附试验检测血清中TNF-α 的水平变化。TNF-α 检测按试剂盒说明书进行操作,即将TNF-α 标准品和样品依次加入包被的微孔板中,每孔100 μL;室温下孵育2 h,洗涤后加入检测抗体,孵育结束后依次加入链霉亲和素-辣根过氧化物酶、显色底物以及终止液,使用酶标仪检测450 nm 处的吸光度值。另取离心后的血清,检测其中的肌酐和尿素氮水平,评估小鼠肾功能。采用干化学分析法(尿液试纸条)进行小鼠尿红细胞和尿蛋白的检测,若尿液中存在蛋白质或血红蛋白,则试纸条变将出现颜色变化。
3.流式细胞术检测:因脾脏中的巨噬细胞数量较为丰富,所以选择小鼠的脾脏进行GW2580 耗竭巨噬细胞效果的检测。将小鼠脾脏组织去除表面包膜后,研磨成单细胞悬液,用40 μm 的细胞过滤筛网去除结缔组织,使用红细胞裂解液裂解红细胞后,加入5 μL 小鼠巨噬细胞表面标志物F4/80 的抗体(小鼠F4/80 BB700),在室温下避光孵育20 min,洗涤、重悬后进行流式细胞术检测。
4.小鼠肾脏组织检测:用生理盐水从心尖灌注后,取小鼠的肾脏组织,用甲醛常温固定24 h 后进行石蜡包埋,切成2 μm 的薄切片,脱蜡复水后进行苏木精-伊红染色,观察肾脏组织中炎症细胞的浸润情况。
三、统计学处理
应用SPSS 11.0 软件进行数据分析,定量资料采用均数±标准差(±s)表示,2 组间比较采用t 检验,以P<0.05 为差异有统计学意义。
结 果
一、GW2580 对小鼠脾脏巨噬细胞的影响
在GW2580 预处理实验中,随着给药时间延长,小鼠的脾脏巨噬细胞逐渐减少(见图1)。与处理前相比,第4 天小鼠脾脏细胞中巨噬细胞占总细胞的百分比显著下降,差异有统计学意义(7.42%比4.78%,P<0.05)。至给药第7 天,小鼠脾脏巨噬细胞百分比下降为3.50%,与处理前及第4 天相比,差异均有统计学意义(P<0.05)。
二、耗竭小鼠巨噬细胞对LPS 诱导小鼠炎症因子表达的影响
在基础状态下,小鼠体内的TNF-α 水平低于检测最小值。腹腔注射LPS 后16 h 其血清TNF-α水平明显升高,达(126.4±16.47) pg/mL(1 pg/mL=1 ng/L),与正常对照组相比,差异有统计学意义(P<0.05),提示小鼠体内出现炎症反应。予小鼠GW2580 灌胃1 周后,腹腔注射LPS,16 h 后其血清TNF-α 水平较LPS 处理组明显下降[低于最低检测值31.3 pg/mL(1 pg/mL=1 ng/L)],差异有统计学意义(P<0.05)(见图2)。

图2 GW2580 对LPS 诱导小鼠血清TNF-α 的影响
三、耗竭小鼠巨噬细胞对LPS 诱导小鼠炎症损伤的脾脏巨噬细胞的影响
GW2580 干预组中,首先给予小鼠为期1 周的GW2580 灌胃,随后进行腹腔注射LPS。流式细胞术检测结果表明,与LPS 组相比,GW2580+LPS 组小鼠脾脏细胞中巨噬细胞占总脾脏细胞的百分比下降明显,差异有统计学意义(4.15%比8.02%,P<0.05);与正常对照组相比,差异同样有统计学意义(4.15%比7.59%,P<0.05)(见图3)。

图3 GW2580 对LPS 诱导小鼠脾脏巨噬细胞的影响
四、耗竭小鼠巨噬细胞对LPS 诱导小鼠肾脏炎症损伤的影响
干化学分析法检测结果显示,GW2580+LPS组、LPS 组及正常对照组这3 组小鼠均未出现血尿和蛋白尿。但与正常对照组相比,LPS 组小鼠的血清肌酐升高,差异有统计学意义[(14.3±1.23)μmol/L 比(10.47±0.25)μmol/L,P<0.05];而LPS 组与GW2580+LPS 组比较,血清肌酐值差异无统计学意义[(14.3±1.23)μmol/L 比(14.67±0.55)μmol/L,P>0.05](见图4)。肾脏病理检测结果显示,LPS 组小鼠肾脏组织间质中出现炎症细胞浸润、肾小管空泡化等改变,而GW2580+LPS 组小鼠肾脏组织的病理损伤较LPS 组明显减轻,提示GW2580 处理可减轻LPS 诱导小鼠肾脏组织的炎症细胞浸润(见图5)。
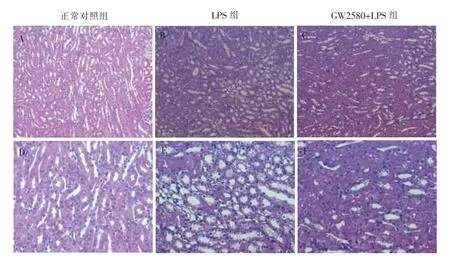
图5 GW2580 对LPS 诱导小鼠肾脏病理的影响

图4 GW2580 对LPS 诱导小鼠血清肌酐的影响
讨 论
一、炎症反应与肾脏损伤
LPS 是革兰阴性细菌外膜的组成部分,参与了机体内炎症反应的发生、发展。目前,LPS 输注或注射动物模型已被广泛用于炎症反应的研究中。LPS可激活单核巨噬细胞等固有免疫细胞,产生炎症级联反应,最终导致全身性炎症反应。LPS 诱导的炎症反应可影响肾脏组织学形态。本研究在LPS 诱导的全身炎症小鼠中观察到血清TNF-α 水平升高及肾组织炎症细胞浸润增多、肾小管受损等病理改变。此外,相关研究还表明,LPS 可使肾组织出现通透性增强、肾间质血流量增加等功能改变[6]。在LPS诱导的动物模型中可以观察到,其细胞因子改变比人体中的反应更快、更激烈[7-8]。因此,本研究在小鼠腹腔注射LPS 16 h 后进行血清炎症因子的检测,以便于更准确地对小鼠的全身炎症反应情况进行评估。
越来越多的研究表明,巨噬细胞参与的炎症反应与肾脏损伤有密切联系[9-10]。目前,巨噬细胞浸润在肾脏疾病中起重要作用的结论已经得到了广泛认可。巨噬细胞是固有免疫的重要成分,属于髓系免疫细胞,具有较强的可塑性和异质性,在不同的微环境中可具有不同的表型和功能。当机体发生炎症时,巨噬细胞可限制炎症扩散、调节炎症的消散、促进组织修复,若机体存在炎症持续状态,如炎症性自身免疫病、慢性炎症感染等,持续存在的刺激可驱动单核细胞持续被招募到炎症部位,并影响骨髓中髓细胞的输出[11]。有研究表明,巨噬细胞在持续性炎症状态中可促进组织纤维化[12]。本研究结果表明,用GW2580 耗竭小鼠体内巨噬细胞后,LPS诱导炎症因子TNF-α 的作用受到显著抑制,肾脏损伤也有明显的减轻,表明GW2580 可耗竭巨噬细胞从而抑制炎症反应,对LPS 诱导小鼠肾组织损伤具有保护作用。本研究结果也提示,巨噬细胞可作为干预炎症所致肾脏损伤中的新靶标。
二、耗竭巨噬细胞对局部及全身炎症损伤的作用
鉴于巨噬细胞浸润对肾脏疾病损伤中的作用,越来越多的研究者将目光转向阻断巨噬细胞在肾脏的募集,从而达到减轻肾脏损伤的目的[13]。这些研究主要采用调节单核细胞和巨噬细胞招募过程中的分子靶点、促炎趋化因子等方式进行干预,以达到减少组织中巨噬细胞浸润,从而减轻组织损伤的效果。如部分研究采用了选择素特异性中和抗体[14]、CCL2/MCP-1 中和抗体或者截短的CCL2/MCP-1 肽类似物 (MCP-19-76)[15]、CCL5/RANTES 类似物进行干预,结果在多种肾脏炎症模型中均发现肾脏组织中浸润的巨噬细胞显著减少及蛋白尿的改善。可见,以巨噬细胞为靶标进行干预治疗,对减轻肾脏炎症反应以及缓解肾组织损伤具有积极意义。
本研究采用LPS 诱导建立小鼠炎症模型,并采用GW2580 耗竭巨噬细胞。GW2580 可选择性作用于巨噬细胞表面的选择性集落刺激因子1 受体,以发挥生物学活性。本研究采用的化合物GW2580 作为巨噬细胞耗竭剂已在多种疾病模型 (如帕金森病、脊髓损伤、佐剂性关节炎等[16-18])中得到应用,但GW2580 在肾脏疾病中的应用目前少有报道。相关研究表明,肾脏组织中巨噬细胞浸润与肾脏损伤密切相关[19],在肾脏炎症性疾病中,组织中浸润的单核巨噬细胞可能是一个潜在的干预靶点,减少巨噬细胞可抑制炎症在肾脏中的发展。本研究使用GW2580 耗竭巨噬细胞,连续给药1 周可达到明显的巨噬细胞耗竭效果。在此基础上,在LPS 诱导的小鼠炎症模型中应用GW2580 干预后,小鼠体内的炎症因子表达下降,肾间质炎症细胞浸润减轻。本研究中LPS 组与GW2580+LPS 组间的血肌酐水平无差异,但均比对照组有所升高,推测由于LPS 对肾脏损伤可表现在间质炎症细胞浸润及肾小管损伤,GW2580 耗竭巨噬细胞虽可改善间质炎细胞浸润,但该作用短期内无法改善肾脏的整体功能。
总之,本研究证实GW2580 可有效减少炎症模型小鼠体内的巨噬细胞数量,连续灌胃1 周可达到理想的巨噬细胞耗竭效果;证实GW2580 可减少体内巨噬细胞,从而显著抑制LPS 诱导的炎症因子产生,并可减轻肾脏组织炎症细胞浸润,使炎症反应得到有效控制。这为今后进一步研究巨噬细胞在肾脏疾病中的作用打下基础。
