重组人源化双功能单克隆抗体致细胞因子释放综合征1例
2021-06-20周雨婷朱斌马雁
周雨婷 朱斌 马雁
摘 要 双特异性抗体现已成为肿瘤免疫治疗药物的热点,而其诱发的与免疫相关的细胞因子释放综合征(CRS)可能危及生命,已成为当前关注的焦点。我院Ⅰ期临床试验1例乳腺癌患者,首次输注重组人源化双功能单克隆抗体MBS301在11 min后出现胸闷、气急渐加重、周身湿冷、血氧下降等症状,考虑为CRS。予以甲泼尼龙琥珀酸钠抗炎,哌拉西林钠舒巴坦钠及利奈唑胺抗感染、化痰等对症治疗,患者症状好转。及时应用糖皮质激素可以治疗双特异性单克隆抗体引起的CRS。
关键词 重组人源化双功能单克隆抗体 细胞因子释放综合征 糖皮质激素
中图分类号:R979.19; R965.3 文献标志码:B 文章编号:1006-1533(2021)09-0036-03
A case report of recombinant humanized bispecific monoclonal antibodyinduced cytokine release syndrome
ZHOU Yuting*, ZHU Bin, MA Yan* *
(Department of Pharmacy, Shanghai Cancer Center, Fudan University, Shanghai 200032, China)
ABSTRACT The bispecific monoclonal antibody (mAbs) has been recently becoming a hotspot in cancer immunotherapy. Meanwhile, the immune-related fatal cytokine release syndrome (CRS) triggered by bispecific mAbs may be life-threatening and has become the focus of current attention. We reported a case that a female patient with relapse and metastatic breast cancer who underwent an initial infusion of MBS301 developed such symptoms as chest distress, dyspnea, clammy body, hypoxemia and so on 11 minutes after infusion. Methylprednisolone sodium succinate, piperacillin sodium and sulbactam sodium as well as linezolid were subsequently administered and her symptoms were improved. Therefore, glucocorticoid combined with antibiotics can be timely used for the treatment of CRS caused by bispecific antibody.
KEy WORDS recombinant humanized bispecific monoclonal antibody; cytokine release syndrome; glucocorticoid
近年来,随着生物技术的迅速发展,双特异性抗体(bispecific antibody,biAb)已经成为肿瘤免疫治疗的关注热点。重组人源化双功能单克隆抗体MBS301是一种岩藻糖全敲除的双特异性抗人表皮生长因子受体-2(human epidermal growth factor receptor 2,HER-2)抗体,目前处于Ⅰ期临床试验,用于治疗HER-2阳性乳腺癌和胃癌。随着双特异性抗体临床应用经验的积累,其固有的和潜在的致命性不良反应尤其是细胞因子释放综合征(CRS)备受重视。CRS是免疫治疗中多种因素触发的全身性炎症反应。其特征是细胞因子的显著升高并且伴有以下相关症状:呼吸困难、发热、头痛、低血压、恶心、皮疹、心动过速、低氧血症。本文报道我院1例复发转移的乳腺癌患者首次使用MBS301时发生CRS的案例,以期为临床提供参考。
1 临床资料
患者,女,58岁,左乳腺癌术后(ER-,PR-,HER-2+),左胸壁复发,肺﹑淋巴结转移。2019年6月19日参加“评价注射用重组人源化双功能单克隆抗体MBS301治疗HER-2阳性复发或转移性恶性实体瘤的安全性﹑耐受性和药代动力学的开放﹑剂量递增的Ⅰ期临床研究”。
2 治疗及结果
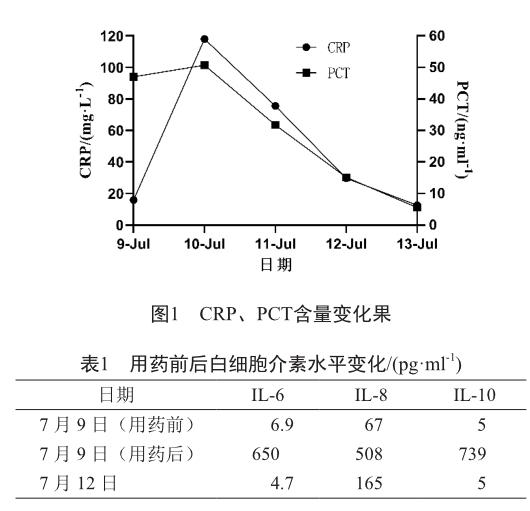
2019年7月9日,患者首次接受MBS301输注治疗,11 min后出现胸闷﹑气急渐加重、周身湿冷、血氧下降、两肺满布湿啰音,免疫相关细胞因子和炎症因子水平明显升高。白细胞介素-6(IL-6)与白细胞介素-10(IL-10)分别上升至基线水平的94倍和148倍;C-反应蛋白(CRP)在用药后第2天达峰值,为基线水平的7.5倍,降钙素原(PCT)升高不明显。先后静脉给药地塞米松、氢化可的松琥珀酸钠、呋塞米、二羥丙茶碱对症治疗,无效。15:13时转入重症监护病房(ICU),予注射用甲泼尼龙琥珀酸钠160 mg抗炎,注射用哌拉西林钠舒巴坦钠4.5 g及利奈唑胺注射液600 mg/300 ml抗感染、化痰等对症治疗,细胞因子水平回落,CRP、PCT含量逐渐下降,患者胸闷、气急、缺氧症状明显好转。7月15日患者转出ICU,继续激素缓慢减量及抗生素治疗。7月22日出院。上报严重不良事件(serious adverse event,SAE),随访报告为“CRS”,危及生命。患者治疗前后CRP、PCT含量及白细胞介素水平变化见图1、表1。

3 讨论
MBS301是全球首个岩藻糖全敲除的双特异性抗体。作用机制为同时结合HER-2抗原的D2和D4结构域,发挥曲妥珠单抗和帕妥珠单抗联合协同的效应;岩藻糖敲除增强抗体依赖细胞介导的细胞毒作用(antibodydependent cell-mediated cytotoxicity,ADCC),使其具有更好的抗肿瘤活性[1]。MBS301目前处于Ⅰ期临床研发阶段,是针对HER-2阳性乳腺癌和胃癌的试验药物。
双特异性抗体是通过双靶向免疫抗原和肿瘤抗原,激发机体免疫反应,从而杀死肿瘤细胞。但是由于T细胞重定向双特异性抗体在杀伤靶细胞的过程中,也可能同时诱导新活化的T细胞分泌促炎细胞因子[2]。2006年3月的TGN1412事件[3],Teachey等[4]报道难治性B细胞前体急性淋巴细胞白血病患者给予博纳吐单抗后发生CRS。这些案例研究均提示,需关注双特异性抗体药物固有、潜在的甚至致命的系统性炎性免疫应答——CRS。
本例患者于当天给药后IL-6达650 pg/ml峰值; 白细胞介素-8(IL-8)、IL-10分别为508 pg/ml、739 pg/ ml。可以观察到患者IL-6、IL-8、IL-10水平在用药后显著升高。有研究表明,IL-6是CRS主要的调控因子[5];也有临床结果显示,重度CRS的许多典型症状与IL-6相关[6],如:血管外渗、弥漫性血管内凝血(disseminated intravascular coagulation,DIC)、心肌症可能;IL-6亦能够介导神经毒性[7]。此外,CRP作为有价值的生物标志物可以衡量其严重程度[8]。该患者在给药后第二天(7月10日)测得CRP为118.1 mg/ml,研究表明,CRP的峰值水平及其倍数差异在一定程度可识别重度CRS的风险[9]。因此,在出现CRS症状期间常规监测CRP水平可能具有临床实用价值。值得注意的是CRS和输液反应都会出现发热、皮疹、呼吸困难等相似的临床症状,如何鉴别诊断二者尤为重要,CRS以IL-6、IL-10、 γ干扰素(IFN-γ)等细胞因子水平短时间内迅速上升为特征。如果患者其中一种细胞因子水平高于正常水平250倍或者两种细胞因子同时高于正常水平75倍,可考虑CRS[10]。该患者接受治疗前后相关细胞因子增高水平符合这一判断标准,最终判定为双特异性抗体(MBS301)诱发的CRS。
基于ASTCT(American Society for Transplantation and Cellular Therapy)CRS分级共识[6]指出的3级CRS为:①发热,体温≥38 ℃;②低血压,需要1种血管加压药物;③低氧血症,需要高流量(速率>6 L/min)鼻导管吸氧、面罩吸氧等。本例CRS患者体温38 ℃、救治过程中予以去甲肾上腺素6 mg持续静脉注射(血压95/63 mmHg)、5 L/min面罩吸氧(血氧饱和度84%),均符合上述指南标准,考虑患者为3级严重CRS(sCRS≥3级)。
患者胸部CT平扫示两肺大面积渗出性病变,两侧胸腔积液。痰培养提示金黄色葡萄球菌。白细胞计数22.1×109/L、淋巴细胞计数0.3×109/L、中性粒细胞计数21.5×109/L,PCT和CRP均升高。予注射用哌拉西林钠他唑巴坦钠(4.5 g q8h静脉滴注)联合利奈唑胺注射液(0.6 g:300 ml bid静脉滴注)抗细菌治疗。用药后5 d CT显示两肺弥漫渗出改变及两侧胸腔积液均较前吸收,炎症因子逐渐恢复正常水平,患者胸闷、气急、缺氧症状明显好转,表明选用的抗感染治疗方案合理,用法用量正确。
本例患者以糖皮质激素甲泼尼龙琥珀酸钠为主要治疗药物,哌拉西林钠他唑巴坦钠及利奈唑胺抗感染、化痰等对症治疗,患者症状好转(未复发)。临床经验表明糖皮质激素治疗CRS有效,通常甲泼尼龙以2 mg /(kg·d)为起始剂量,数日逐渐减量至停药。研究表明,对于(IL-6难以阻滞的案例亦或也是)伴有严重神经毒性的CRS 3或4级患者/CRS 3或4级相关神经功能障碍的患者,在血液动力学相对稳定并且无致命性症状的前提条件下,糖皮质激素或可考虑作为首选一线免疫抑制治療药物(地塞米松0.5 mg/kg,最大剂量10 mg/剂)[11]。此外,重组人源化抗人IL-6受体单克隆抗体托珠单抗对于重度或严重威胁生命的CRS有效[12]。一般情况下,可给予成人托珠单抗8 mg/kg;体重<30 kg的患者12 mg/ kg,每次滴注剂量不超过800 mg,静脉滴注时间1 h以上,给药间隔时间至少8 h。如在24至48 h内临床无明显改善,可选择追加应用相应剂量。与糖皮质激素不同的是托珠单抗不能透过血脑屏障。据悉,本例重组人源化双功能单克隆抗体致CRS事件目前尚未有其他文献报道。糖皮质激素、托珠单抗以及其他IL-6靶向单克隆抗体(如司妥昔单抗)、靶向免疫抑制剂:抗肿瘤坏死因子-α(TNF-α)人-鼠嵌合单克隆抗体英夫利西单抗、依那西普均可用于干预肿瘤免疫治疗引起的CRS。希望能够有越来越多的临床经验以及针对CRS的特殊临床管理模式出现,以给予患者更安全、有效的肿瘤免疫治疗。
参考文献
[1] Huang S, Li F, Liu H, et al. Structural and functional characterization of MBS301, an afucosylated bispecific antiHER2 antibody[J]. mAbs, 2018, 10(6): 864-875.
[2] 闫莉萍, 张旻, 王庆利, 等. 双特异性抗体药物非临床研究的考虑要点[J]. 中国新药杂志, 2017, 26(17): 2008-2013.
[3] Wadman M. Londons disastrous drug trial has serious side effects for research[J]. Nature, 2006, 440(7083): 388-389.
[4] Teachey DT, Rheingold SR, Maude SL, et al. Cytokine release syndrome after blinatumomab treatment related to abnormal macrophage activation and ameliorated with cytokine-directed therapy[J]. Blood, 2013, 121(26): 5154-5157.
[5] Shimabukuro-Vornhagen A, G?del P, Subklewe M, et al. Cytokine release syndrome[J]. J Immunother Cancer, 2018, 6(1): 56.
[6] Lee DW, Santomasso B, Locke FL, et al. ASTCT consensus grading for cytokine release syndrome and neurologic toxicity associated with immune effector cells[J]. Biol Blood Marrow Transplant, 2019, 25(4): 625-638.
[7] Brown ART, Gutierrez C. Comments regarding “ASBMT consensus grading for cytokine release syndrome and neurologic toxicity associated with immune effector cells”[J]. Biol Blood Marrow Transplant, 2019, 25(6): e209-e210.
[8] García Roche A, Díaz Lagares C, élez E, et al. Cytokine release syndrome. Reviewing a new entity in the intensive care unit[J]. Med Intensiva, 2019, 43(8): 480-488.
[9] Neelapu SS, Tummala S, Kebriaei P, et al. Chimeric antigen receptor T-cell therapy - assessment and management of toxicities[J]. Nat Rev Clin Oncol, 2018, 15(1): 47-62.
[10] Davila ML, Riviere I, Wang X, et al. Efficacy and toxicity management of 19-28z CAR T cell therapy in B cell acute lymphoblastic leukemia[J]. Sci Transl Med, 2014, 6(224): 224ra25.
[11] Riegler LL, Jones GP, Lee DW. Current approaches in the grading and management of cytokine release syndrome after chimeric antigen receptor T-cell therapy[J]. Ther Clin Risk Manag, 2019, 15: 323-335.
[12] Le RQ, Li L, Yuan W, et al. FDA approval summary: tocilizumab for treatment of chimeric antigen receptor T cell-induced severe or life-threatening cytokine release syndrome[J]. Oncologist, 2018, 23(8): 943-947.
[13] FDA. FDA approval brings first gene therapy to the United States. 2017[EB/OL]. (2017-08-30)[2020-04-12]. https:// www.fda.gov/news-events/press-announcements/fdaapproval-brings-first-gene-therapy-united-states.
