奥拉帕利靶向治疗卵巢癌含铂二线化疗失败的疗效
2021-06-20王翠红范宇飞
王翠红,范宇飞
(北京燕化医院肿瘤科,北京 102500)
卵巢癌(ovarian cancer,OC)因临床症状隐匿及筛查手段有限以至于早期不易被发现,70%以上患者确诊时已为晚期,治疗后70%多在1~2 年内复发,5 年生存率为30%~40%[1]。2015 年我国癌症统计报告显示[2],卵巢癌发病率高达52.1%,病死率居女性生殖道恶性肿瘤的首位。临床上卵巢癌复发后铂类耐药患者采用脂质体阿霉素、吉西他滨、拓扑替康等单药化疗,铂类敏感患者则选用铂+紫杉醇等药物联合化疗,尽量延长无铂治疗期,继而再采用含铂化疗方案[3],但患者总生存期仍无显著变化,未取得有效的临床疗效。奥拉帕利(Olaparib)是一种聚腺苷二磷酸-核糖聚合酶抑制剂,可阻断DNA 碱基切除修复,并在同源重组修复缺陷的肿瘤中产生阻断效应,目前在乳腺治疗中已获认可[4],2014 年分别被欧洲和美国用于化疗后BRCA 突变铂类敏感和晚期复发的卵巢癌的治疗[5,6]。2018 年,我国国家药监局也已批准奥拉帕利片剂在国内上市,并用于铂类敏感复发性卵巢癌的维持治疗。本研究选取2018 年10 月1 日~2019 年12 月31 日我院收治的44 例含铂二线化疗失败的卵巢癌患者临床资料,探讨卵巢癌二线化疗失败后应用奥拉帕利靶向治疗的疗效,现报道如下。
1 资料与方法
1.1 一般资料 选取2018 年10 月1 日~2019 年12月31 日北京燕化医院收治的含铂二线化疗间隔6个月以上进展的卵巢癌患者44 例,按照随机数字表法分为观察组与对照组,每组22 例。纳入标准:①病理学确诊为卵巢癌,临床分期明确;②预期生存时间>3 个月,PS 评分0~2 分,血尿常规、肝肾功能、心电图未见明显异常;③经二线治疗失败后影像学或CA125 显示疾病进展。排除标准:①严重心肺肝肾功能不全者;②精神障碍者;③依从性较差者。两组年龄、病理类型、临床分期比较,差异无统计学意义(P>0.05),具有可比性,见表1。本研究符合《赫尔辛基宣言》要求,患者知情同意并签署知情同意书。
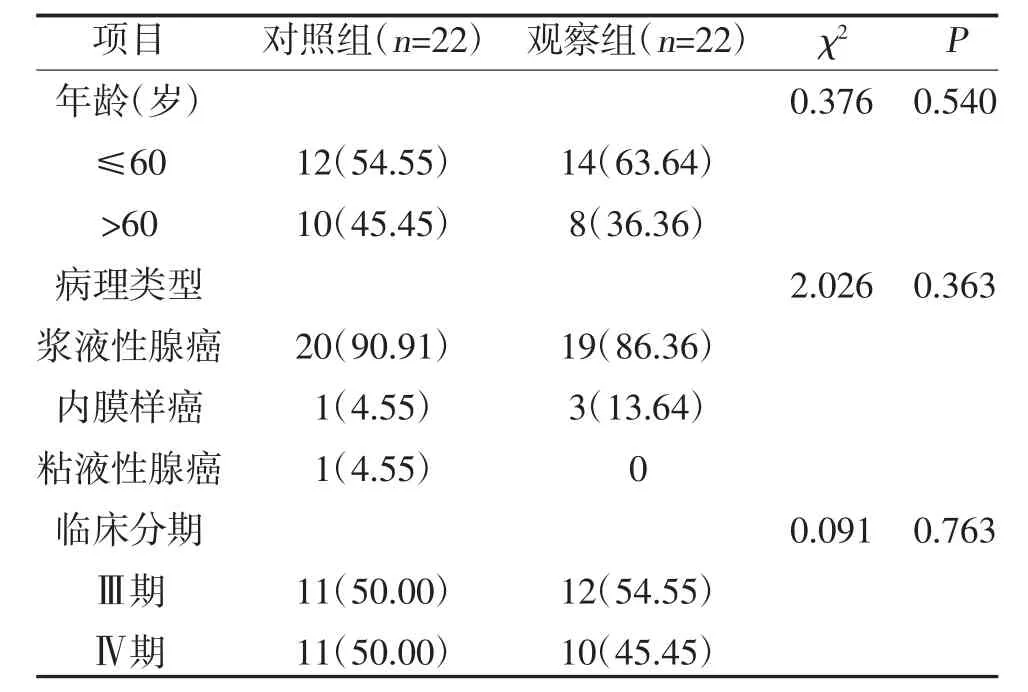
表1 两组一般资料比较[n(%)]
1.2 方法 对照组予4 周期化疗,方案根据前期治疗选择紫杉醇(辰欣药业股份公司,国药准字H20 057404;135~175 mg/m2,d1,Ⅳ,q3w)、紫杉醇(白蛋白结合型)(石药集团欧意药业,国药准字H20 183044;260 mg/m2,d1,Ⅳ,q3w)、依托泊苷(江苏恒瑞医药,国药准字H3 205583;80 mg/m2,d1~d3,Ⅳ,q3w)、多柔比星脂质体(石药集团欧意药业,国药准字H20 113320;30 mg/m2,d1,Ⅳ,q4w)±铂类[顺铂(齐鲁制药,国药准字H20 023461;75 mg/m2,d1,Ⅳ,q3w);卡铂(齐鲁制药,国药准字H20 020180;AUC=5,d1,Ⅳ,q3w)],每2、4 周期评估疗效。观察组予奥拉帕利(德国Abbvie Deutschland GmbH&Co.KG,批准文号H20180049)300 mg/次,2 次/d,口服,若出现Ⅲ度以上不良反应,将奥拉帕利从300 mg/次,2 次/d 减到150 mg/次,2 次/d,3 个月后复查。治疗后观察组每周查血常规1 次、每2 周查肝肾功能1 次;对照组每周查血常规2 次、肝肾功能1 次直至化疗后第14 天。
1.3 观察指标 比较两组临床疗效、治疗前后CA125水平及不良反应发生情况。
1.3.1 疗效评价标准 根据实体瘤疗效评价标准(RECIST 1.1)[7],将疗效分为完全缓解:所有目标病灶消失;部分缓解:基线病灶长径总和缩小≥30%;稳定:基线病灶长径总和有缩小但未达到部分缓解或有增加但未达进展;进展:基线病灶长径总和增加≥20%或出现新病灶。总有效率=(完全缓解+部分缓解)/总例数×100%。
1.3.2 CA125 水平 使用迈瑞试剂盒配套试剂检测,采用化学发光免疫法检测患者CA125 水平,正常范围为0~35 U/ml。
1.3.3 不良反应 以美国国立癌症研究所通用毒性标准3.0(NCI-CTC3.0)分级0~Ⅳ度进行评价,主要包括骨髓抑制(白细胞减少症、血小板减少症、贫血)、胃肠道反应(恶心、呕吐)和神经毒性。
1.4 统计学方法 数据均采用SPSS 17.0 统计学软件进行分析,正态分布的计量资料以()表示,组间比较采用t检验;计数资料以[n(%)]表示,采用χ2检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 两组临床疗效比较 观察组总有效率高于对照组,差异有统计学意义(P<0.05),见表2。

表2 两组临床疗效比较[n(%)]
2.2 两组糖类抗原CA125 比较 治疗前,两组CA125比较,差异无统计学意义(P>0.05);观察组治疗后CA125 低于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组治疗前后CA125 比较(,U/ml)
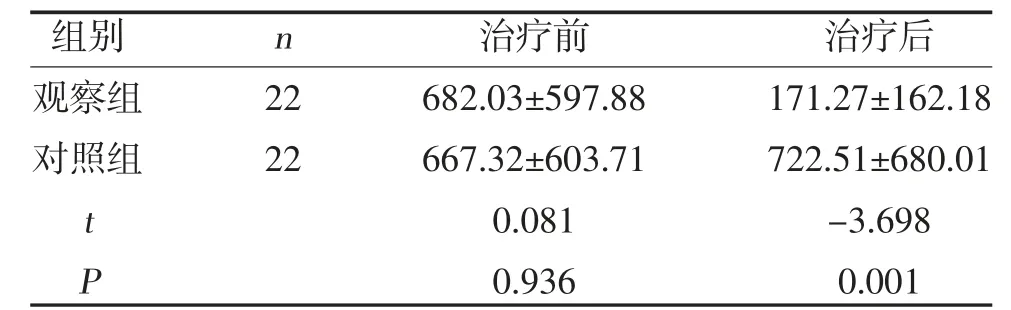
表3 两组治疗前后CA125 比较(,U/ml)
2.3 两组不良反应比较两组骨髓抑制、乏力、胃肠道反应发生率比较,差异无统计学意义(P>0.05);观察组周围神经病变发生率低于对照组,差异有统计学意义(P<0.05),见表4。
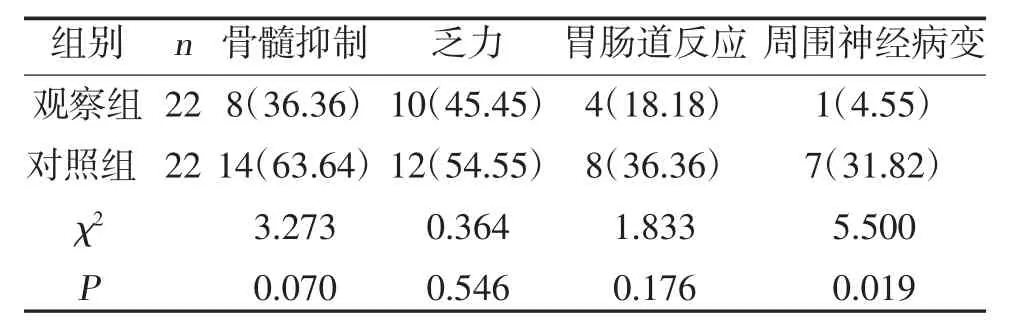
表4 两组不良反应比较[n(%)]
3 讨论
NCCN 指南推荐以铂为基础的化疗方案作为卵巢癌初次化疗的首选方案[8],治疗模式常常是术后化疗,停药复查,复发后再治疗,更短间期再次复发,再次治疗,直至生命终结,治疗过程中铂类药物成为多次备选药,但其容易导致耐药后疾病进展,也会出现患者无法耐受铂类蓄积,进而出现骨髓抑制、消化道反应、肾功损害等毒副反应而终止治疗。而PARP抑制剂有望打破卵巢癌近20 年内5 年总生存期无显著改善的局面,即在一线或复发治疗缓解后或者二线化疗再进展后加PARP 抑制剂维持治疗,以推迟疾病复发和缓解疾病进展时间,进而延长晚期卵巢癌患者的生存时间[9,10]。
人体内DNA 损伤有两种主要修复过程,一种是PARP 参与的DNA 单链断裂后的损伤修复,另一种是BRCA1/2 参与的同源重组修复,其中一种是修复障碍,而另一种是可代偿。若两者同时障碍,则可能促进细胞的凋亡,这即是PARP 抑制剂的作用机理-合成致死效应[11,12]。研究表明[13,14],铂敏感复发卵巢癌患者应用奥拉帕利维持治疗可长期临床获益。奥拉帕利通过作用于基因组不稳定和突变的肿瘤,使得肿瘤细胞选择性凋亡,同时能增强免疫治疗前的突变负荷[15]。卵巢癌的复发临床上可表现为CA125升高、体检发现肿块、影像学检查发现肿块、出现胸腔或腹腔积液、出现不明原因的肠梗阻等症状,其中CA125 是最为常用的卵巢癌肿瘤标志物,尤其是浆液性卵巢癌的首选肿瘤标志物。CA125 的阳性率与肿瘤分期、组织学类型有关,晚期、浆液性癌患者的阳性率约84.10%、92.40%,在绝经后人群CA125 诊断卵巢癌的敏感度和特异度可达90.7%、89.8%[16]。本研究结果显示,观察组总有效率为54.55%,高于对照组的22.73%,差异有统计学意义(P<0.05),且观察组治疗后CA125 低于对照组,差异有统计学意义(P<0.05),这与奥拉帕利的靶向抑制和捕获DNA损伤修复酶PARP,导致肿瘤细胞死亡相关。此外,本研究中两组骨髓抑制、乏力、胃肠道反应发生率比较,差异无统计学意义(P>0.05);观察组周围神经病变发生率低于对照组,差异有统计学意义(P<0.05),虽然两组骨髓抑制、乏力、胃肠道反应发生率无明显差异,但观察组总体数据低于对照组,且周围神经病变不良反应发生率更低,与Pujade-Lauraine E 等[17]研究结果类似,其研究中1~2 级不良事件发生率为62%,≥3 级不良反应事件为36%,再次提示奥拉帕利靶向治疗的患者耐受较好,不良反应较少。
综上所述,针对卵巢癌含铂二线化疗复发的患者,奥拉帕利相比常规化疗在近期疗效及安全性方面均有优势,可降低患者CA125 水平及不良反应发生几率,对控制卵巢癌的进展具有良好效果。
