沙门菌和大肠杆菌噬菌体对试验感染小鼠的保护作用
2021-06-19徐凤宇朱振宇蒋依倩张喜庆马红霞高云航么乃全
徐凤宇,朱振宇,蒋依倩,张喜庆,马红霞,高云航,么乃全
(1. 吉林农业大学动物科学技术学院,吉林 长春 130118 ;2. 动物生产及产品质量安全教育部重点实验室,吉林 长春 130118)
沙门菌、大肠杆菌是引起动物败血症和肠炎等疾病的重要病原,间或引起食物中毒[1-2],可在不同动物间传播[3]。随着养殖业的发展及抗生素的不合理使用,耐药菌株不断被分离并呈蔓延趋势[4],使细菌病的防治愈发困难,探寻治疗耐药菌感染的新型安全有效抗菌剂成为基础与临床医学研究的结合点。以细菌为天然宿主的噬菌体具有很好的杀菌能力,并能特异性杀死宿主菌而不破坏正常菌群,成为治疗多重耐药菌感染的新希望[5-7]。
本试验应用前期分离的多重耐药沙门菌噬菌体SP3383和大肠杆菌噬菌体EP-SY[8-9],分别进行预防和治疗宿主菌CVCC3383株或SY株感染小鼠试验,评价噬菌体对耐药菌感染的防治效果,为更深入探索噬菌体在临床中的应用提供资料。
1 材料与方法
1.1 菌株 沙门菌噬菌体SP3383和大肠杆菌噬菌体EP-SY由本实验室分离并保存。宿主菌猪霍乱沙门菌CVCC3383株,由吉林农业大学预防兽医实验室老师馈赠,本实验室保存;大肠杆菌SY株由本实验室分离并保存。
1.2 主要试剂与仪器 96孔细胞培养板、石蜡,均购自长春华益生物科技有限责任公司;苏木素-伊红染液,购自南京建成生物有限公司;黏附载玻片、盖玻片,均购自江苏世泰实验器材有限公司。酶标仪(15644)为上海京工实业有限公司生产;手动旋转式石蜡切片机(CUT4062)为德国SLEE医疗器械有限公司生产;倒置显微镜(IX71-A21PH)由奥林巴斯中国有限公司生产;生物组织摊烤片机(YT-7FB)为湖北省孝感市亚光医用电子技术公司生产。
1.3 实验动物 2~3周龄、体重10~15 g、健康离乳昆明小鼠110只,购自北京华阜康生物有限公司,预饲7 d。
1.4 方法
1.4.1 噬菌体体外杀菌活性检测 制备合适浓度的宿主菌与噬菌体液。取96孔细胞培养板,向各孔中分别加入稀释的噬菌体液与宿主菌液各100 μL,使其达到最佳感染复数(SP3383、EP-SY分别为0.1、0.01)比例,轻微振荡混匀,置37 ℃下培养;每隔1 h,从左至右依次加入相应的100 μL噬菌体液与100 μL宿主菌液,继续培养;12 h后用酶标仪测各孔吸光度。对照组为100 μL宿主菌液与100 μL 储存介质(Storage media,SM)液。
1.4.2 噬菌体对细菌感染小鼠的预防与治疗作用
1.4.2.1 噬菌体安全性检测 (1)无菌检测:取制备的噬菌体液100 μL,均匀涂布于LB平板上,37 ℃ 恒温培养24 h,观察平板上菌落生长情况。(2)噬菌体对小鼠的毒性:将预饲的健康离乳小鼠30只随机平分为3组,雌雄各半。第1组小鼠腹腔注射剂量为1012PFU/只的EP-SY噬菌体液;第2组小鼠注射同量的SP3383噬菌体液;第3组小鼠注射生理盐水。3个组小鼠同条件饲养,观察记录临床表现,7 d后扑杀剖检,检查各器官病变。
1.4.2.2 试验分组 将健康离乳昆明小鼠80只随机平分为8组。按姚营等[10]方法,在小鼠饮水中加入链霉素(5 mg/mL)预处理1 d,正常饲养1 d,禁食6 h后灌胃接种。感染组小鼠仅灌服接种2×1012CFU/只宿主菌液;预防组小鼠先灌服2×1011PFU/只 SP3383液或2×1010PFU/只EP-SY液,2 h 后再分别灌服2×1012CFU/只相应宿主菌液;治疗组小鼠先灌服宿主菌液,2 h后再灌服噬菌体液;对照组灌服灭菌生理盐水。
1.4.2.3 肠道组织病理切片的制作与观察 灌胃接种48 h后,将小鼠脱颈,观察各组小鼠十二指肠、空肠、肠系膜淋巴结病变,置于10%甲醛中固定,制作石蜡切片并进行H.E.染色,显微镜下观察各组小鼠的病理组织学变化。
1.4.2.4 脾脏和肠道组织活菌计数 无菌操作取1.4.2.3中处死小鼠的脾脏和肠道组织(大肠杆菌试验组取十二指肠,沙门菌试验组取空肠),加入等量生理盐水研磨成匀浆。对匀浆液作10倍梯度稀释,取适宜稀释度100 μL涂布于含有Amp和Kan的麦康凯琼脂培养基或SS琼脂培养基表面,干燥,置37 ℃恒温培养16 h计数菌落。
2 结果
2.1 噬菌体体外杀菌活性 以时间为横坐标,以OD680为纵坐标,绘制噬菌体杀菌活性曲线(图1)。在初始7 h内,在噬菌体SP3383作用下,CVCC3383的浊度逐渐降低,此后,尽管细菌浊度升高,吸光度仍较未处理组低0.3以上;在初始5 h内EP-SY杀菌组吸光度基本保持不变且较低,SY株的吸光度随时间延长呈持续上升趋势;5 h后EP-SY组浊度慢慢升高,但较SY组仍低约0.3。说明噬菌体SP3383、EP-SY在共培养前期对宿主菌具一定杀灭作用。
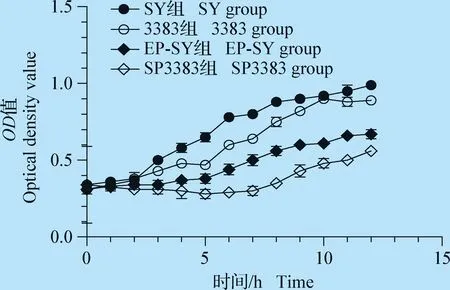
图1 噬菌体SP3383、EP-SY杀菌活性Fig.1 Bactericidal activity of phage SP3383 and EP-SY
2.2 噬菌体安全性检测 将涂有SP3383或EP-SY噬菌体液的平板培养24 h后,均未见菌落生长,说明噬菌体液无杂菌污染。小鼠腹腔注射EP-SY或SP3383噬菌体液7 d内,生长状况良好,未出现精神不振、食欲减退、粪便异常等现象,剖检未见组织器官出现病理变化,说明噬菌体EP-SY、SP3383对实验小鼠安全。
2.3 肠道组织病理学检测 沙门菌感染组小鼠肉眼可见空肠肿胀、出血,肠系膜淋巴结肿大、充血,其余各组无明显病变。显微镜下观察病理切片可见感染组小鼠空肠绒毛刷状缘部分破裂,杯状细胞增多(封三彩版图2A),预防组、治疗组小鼠肠道组织结构正常,绒毛刷状缘完整,与对照组基本一致(封三彩版图2B~2D)。

图2 光学显微镜观察小鼠空肠组织学变化 (H.E.染色,200×)Fig.2 Histological changes of jejunum in mice observed by light microscope (H.E.staining,200 ×)A:感染组; B:预防组; C:治疗组; D:对照组A:Infection group; B:Prevention group; C:Treatment group; D:Control group

图3 光学显微镜观察小鼠十二指肠组织学变化 (H.E.染色,200×)Fig.3 Histological changes of duodenum in mice observed by light microscope (H.E.staining,200×)A:感染组; B:预防组; C:治疗组; D:对照组A:Infection group; B:Prevention group; C:Treatment group; D:Control group
大肠杆菌感染组小鼠肉眼可见十二指肠肠壁变薄、充满气体,肠系膜淋巴结肿大,其余各组无明显病变。镜下可见小鼠十二指肠绒毛部分断裂,固有层与肠上皮细胞分离(封三彩版图3A),预防组、治疗组小鼠肠绒毛排列整齐,与对照组相近(封三彩版图3B~3D)。
2.4 脾脏和肠道组织活菌计数 沙门菌组灌胃接种48 h后,取小鼠脾脏和空肠,用SS琼脂培养基活菌计数。结果如图4所示,对照组脾脏及空肠匀浆中几乎无宿主菌生长;预防组(6.2×102CFU/g,4.2×104CFU/g)、治疗组(3.9×102CFU/g,1.2×105CFU/g)的脾脏及空肠匀浆中宿主菌数量较感染组(2.4×104CFU/g,6.7×107CFU/g)低,且差异显著(P<0.05)。说明噬菌体SP3383对耐药沙门菌CVCC3383株引起的小鼠感染有一定预防和治疗作用。

图4 小鼠脾脏和空肠的沙门菌CVCC3383株活菌计数结果Fig.4 Counting results of Salmonella CVCC3383 strain of mice spleens and intestine 注:与感染组比较,*:P<0.05;下图同Note: Compare to infection group,*:P<0.05. The same as below
大肠杆菌组灌胃接种48 h后,取小鼠脾脏和十二指肠,用含有Amp和Kan的麦康凯琼脂培养基活菌计数。结果如图5所示,对照组脾脏及十二指肠匀浆中几乎无宿主菌生长,预防组(1.7×102CFU/g,2.4×105CFU/g)、治疗组(4.2×102CFU/g,3.8×105CFU/g)脾脏及十二指肠匀浆中宿主菌数量明显低于感染组(1.8×104CFU/g,1.9×108CFU/g),且差异显著(P<0.05)。说明噬菌体EP-SY对耐药性SY株大肠杆菌引起的小鼠感染有预防和治疗作用。
3 讨论
体外杀菌活性试验发现,噬菌体SP3383和EP-SY分别在与宿主菌作用初始的7 h和5 h内可使宿主菌数量明显减少,之后上升;罗薇的研究[11]也表明,沙门菌与其噬菌体共培养4 h内宿主菌的OD值呈下降趋势,4 h后略上升;这种现象可能与细菌针对噬菌体感染产生的抗性有关[12-13],宿主菌可能通过阻止吸附、抑制DNA注入、阻断DNA复制、群体感应系统、流产感染等方式抵抗噬菌体,如普遍存在于细菌中的CRISPR-Cas系统,该系统包含规律成簇的间隔性短回文重复序列(Clustered regularly interspaced short palindromic repeats,CRISPR)和与其相关的Cas基因[14],宿主菌受到噬菌体感染时,会在CRISPR序列前导区插入一段与噬菌体序列一致的间隔序列,应用这一序列合成并加工成小的CRISPR RNA(crRNAs),诱导细菌降解噬菌体核酸[15-16]。本研究应用的宿主菌以哪种方式抵抗噬菌体值得深入探究。
噬菌体治疗效果与其给药途径密切相关[17],目前最常见的给药途径是腹腔注射和口服。其中注射给药主要针对引发菌血症及败血症的病原菌感染,治疗胃肠道细菌感染多采用口服方式。进入肠道的噬菌体不仅可在肠腔内定殖,还可通过肠黏膜移位至局部淋巴结及内脏[18]。本研究采用口服噬菌体途径预防和治疗大肠杆菌病和沙门菌感染,发现噬菌体能明显缓解大肠杆菌或沙门菌对小鼠肠道的损伤,显著降低脾脏及肠道中宿主菌的数量,但未能完全阻止菌血症的发生,虽然在实践中使动物体内病原菌数量控制在最小致死量以下,可以大大减少损失,但如果能采用多株噬菌体同时应用的鸡尾酒疗法或与其他益生微生物或内酯酶[19]、药物等联用,会使其发挥更高的治疗价值。
