球囊导引导管在颈内动脉次全闭塞支架植入术治疗中的应用
2021-06-19郑超波陈林辉吴炯高宇海周育苗万曙
郑超波 陈林辉 吴炯 高宇海 周育苗 万曙
颈内动脉次全闭塞是指颈内动脉起始部严重狭窄引起远端血管血流减少,从而导致病变血管远端完全或不完全坍陷的一类疾病[1]。近年来,研究发现即使给予强化药物治疗,症状性颈内动脉次全闭塞患者仍存在较高的早期(90 d内)卒中复发率(10.6%~30%)[2-3]。因此,对于患侧侧支循环代偿不足导致血流动力学障碍而出现缺血症状的患者建议手术治疗。目前已有多项研究证实颈内动脉支架植入术(carotid artery stenting,CAS)治疗颈内动脉次全闭塞是可行的,而且和单纯药物治疗相比能够明显降低卒中复发风险[4-7]。球囊导引导管(balloon guide catheter,BGC)是近年来针对急性颅内大动脉闭塞性缺血卒中治疗设计的头端带有单球囊的导引导管,在取栓过程中可以预防栓子逃逸至远端血管[8]。本研究回顾性分析浙江医院脑科中心症状性颈内动脉次全闭塞患者的临床资料,探讨BGC保护下CAS治疗此类患者的安全性及可行性。
1 对象和方法
1.1 对象 纳入2019年1月至2020年1月本院脑科中心收治的症状性颈内动脉次全闭塞行CAS治疗的患者 8 例,其中男 6 例,女 2 例;年龄 69.5(64.25,73.75)岁;左侧颈内动脉次全闭塞5例,右侧颈内动脉次全闭塞3例;1例伴有对侧颈内动脉起始部重度狭窄及同侧椎动脉起始部重度狭窄;临床表现为短暂性脑缺血发作(transient ischemic attack,TIA)5例,急性脑梗死 3例[美国国立卫生研究院卒中量表评分(National Institutes of Health stroke scale,NIHSS)≤3 分 2 例,NIHSS>3 分 1例];伴有高血压6例,高脂血症4例,2型糖尿病4例。纳入标准:(1)数字减影全脑血管造影(digital subtraction angiography,DSA)证实颈内动脉次全闭塞,DSA诊断标准:颈内动脉起始部重度狭窄伴远端血管管腔坍陷或狭窄导致颈内动脉血流速度较同侧颈外动脉明显缓慢;(2)术前颈动脉病变处高分辨MRI检查提示斑块内有脂质坏死、出血或者纤维帽破裂等易损斑块的征象;(3)颈内动脉次全闭塞造成脑缺血症状或者同侧大脑半球的血流动力学改变。排除标准:(1)未采用在BGC保护下联合远端栓子保护装置的血管内治疗方式;(2)颈内动脉起始部狭窄<95%的患者。本研究经医院医学伦理委员会审批通过,所有患者及其家属均知情同意。
1.2 血管内治疗 所有患者至少术前3 d口服阿司匹林(国药准字:J20130078,规格:100 mg/片,美国拜尔医药有限公司)100 mg/次,1次/d以及氯吡格雷[国药准字:J20180029,规格:75 mg/片,赛诺菲(杭州)制药有限公司]75 mg/次,1次/d。手术采用气管插管下全麻,在血管造影系统(Allura Xper FD20/20,荷兰飞利浦公司)下进行。常规消毒,采用Seldinger技术穿刺股动脉置入9F短鞘,静脉注射70 U/kg肝素进行全身肝素化。将9F BGC(美国史塞克公司)内衬5F 125 cm多功能导管同轴交换至颈总动脉近颈内动脉起始部狭窄病变处,行造影测量狭窄程度、长度及远近段血管直径,并留取路径图。使用300 cm 0.014微导丝(Synchro2,美国史塞克公司)将微导管(Echelon10,美国美敦力公司)小心送至狭窄病变远端至海绵窦段,随后微导管造影明确血管真腔,交换出微导管,这时充盈BGC球囊,关闭连接BGC的加压滴注,选用 2~3 mm×15 mm 球囊(Sprinter,美国美敦力公司)沿微导丝送至狭窄处进行扩张,造影提示扩张满意后退出球囊,将50 ml注射器连接BGC管腔回抽血液20~30 ml(可重复几次至血液过滤无血栓或斑块为止)。随后,沿着微导丝将4~5 mm保护伞(Spider,美国美敦力公司)送至颈内动脉C1段远端平直处后打开保护伞,随即抽瘪BGC球囊,打开加压滴注。随后选择合适大小的 4~5 mm×30 mm球囊(Sprinter/Viatrac,美国美敦力/雅培公司)送至颈动脉狭窄处扩张满意后,根据病变血管情况,选择合适类型颈动脉支架送入病变处释放,根据发生高灌注综合征风险、支架的贴壁情况、残余狭窄程度及支架类型决定是否后扩。若术中出现支架贴壁不良或者残余狭窄>50%,常规使用的4~5 mm×20/30 mm球囊(Sprinter/Viatrac,美国美敦力/雅培公司)以8 ATM进行快速后扩后撤出球囊。最后,再次充盈BGC球囊,关闭连接BGC的加压滴注,回收保护伞,将50 ml注射器连接BGC管腔回抽血液20~30 ml,造影明确残余狭窄及颅内血管情况。
1.3 血管狭窄的诊断标准 根据北美症状性颈内动脉狭窄内膜切除研究(North American symptomatic carotid endarterectomy trial,NASCET)中的方法计算狭窄程度,狭窄率=(1-B/A)×100%(B代表颈内动脉最窄处宽度,A代表颈动脉膨大部以远正常处管腔内径为基础内径。如颈内动脉分叉后全程狭窄,则取对侧颈动脉作比较)。
1.4 术后处理 术后至神经ICU监护12~48 h,根据患者术前高灌注风险大小利用降压药物联合镇静药物将收缩压控制在100~120 mmHg,术后继续口服阿司匹林100 mg/次,1 次/d 以及氯吡格雷[国药准字:J20180029,规格:75 mg/片,赛诺菲(杭州)制药有限公司]75 mg/次,1次/d,至少3个月。根据随诊情况及血栓弹力图结果决定是否改为单抗(阿司匹林100 mg/次,1次/d或氯吡格雷75 mg/次,1次/d)。术后观察有无过度灌注综合征、血栓栓塞事件、颅内出血相关的手术并发症;并随访3个月,观察有无再次支架侧颈内动脉供血区内缺血性事件发生,依据患者情况选择CT血管成像或者颈动脉超声了解血管是否通畅。
1.5 统计学处理 采用SPSS 16.0统计软件。符合正态分布的计量资料以表示,非正态分布的的计量资料以 M(P25,P75)表示。
2 结果
2.1 患者手术情况及疗效观察 所有患者手术均获得成功,支架植入后狭窄均明显改善,狭窄的程度由原来的(97.56±1.12)%下降至(34.03±8.24)%。术中颈总动脉被BGC锚定的部位的远近段均无血管痉挛及夹层发生。所有患者均在气管插管全麻下手术,有2例术前评估过度灌注风险较高的患者术后采用镇静联合降压处理,所有患者术后均未发生过度灌注综合征、血栓栓塞事件及颅内出血相关的手术并发症。其中4例患者在球囊扩张的时候出现心率减慢及血压下降,考虑颈动脉窦迷走反射,给予阿托品或多巴胺治疗后均好转,其中多巴胺术后维持均不超过72 h可缓慢减量至停药。根据患者颈内动脉起始部病变与其近端、远端血管的成角情况以及血管斑块的性质选择颈动脉支架的类型,其中选择闭环支架5例,开环支架3例。所有患者术后围术期均未发现新发神经功能缺血症状及体征。术后随访3个月,随访期内所有患者均无再次支架侧颈内动脉供血区内缺血性事件发生,血管通畅率100.0%,无支架内血栓形成,见表1。
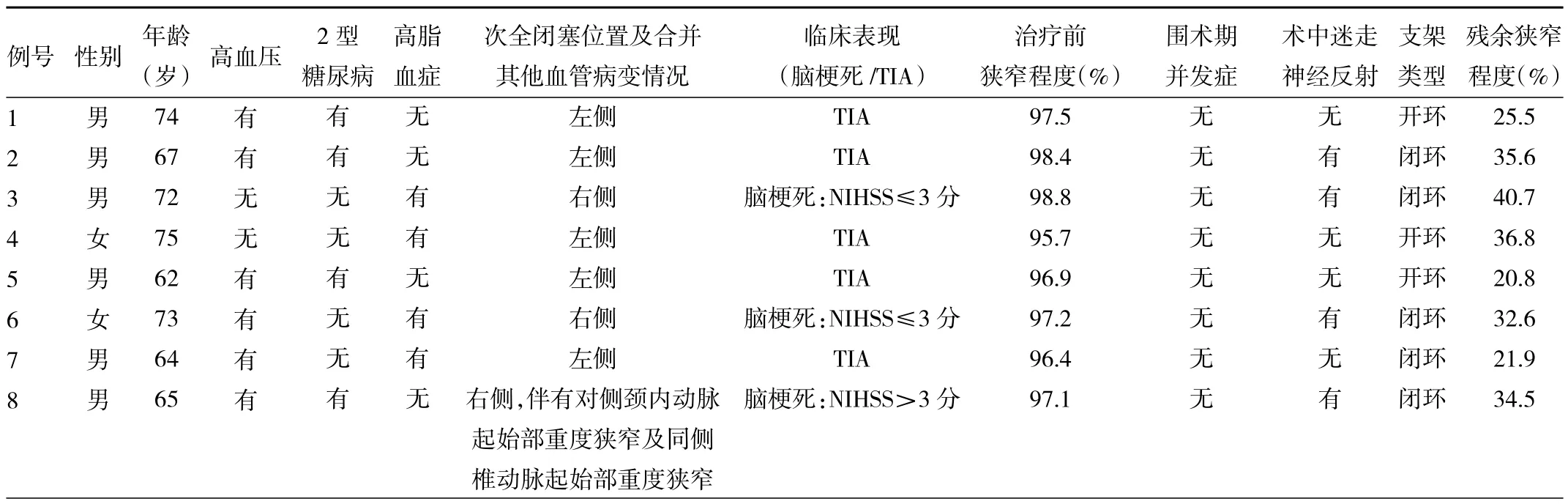
表1 患者术前及术中一般资料
2.2 典型病例
2.2.1 例1 男,74岁。因“发作性右侧肢体无力1周”于2019年12月24日入院。入院专科查体:神志清,言语清晰,计算力及记忆力下降(简易智力状态检查量表评分18分),四肢肌力V级,双侧巴氏征(-)。入院后CT血管成像提示左侧颈内动脉起始部次全闭塞(图1a),CT灌注成像提示左侧半球低灌注(图1b),左侧颈内动脉起始部斑块MRI提示斑块内出血(图1c),发病10 d后在插管全麻BGC保护下行左侧CAS(图1d-h)。
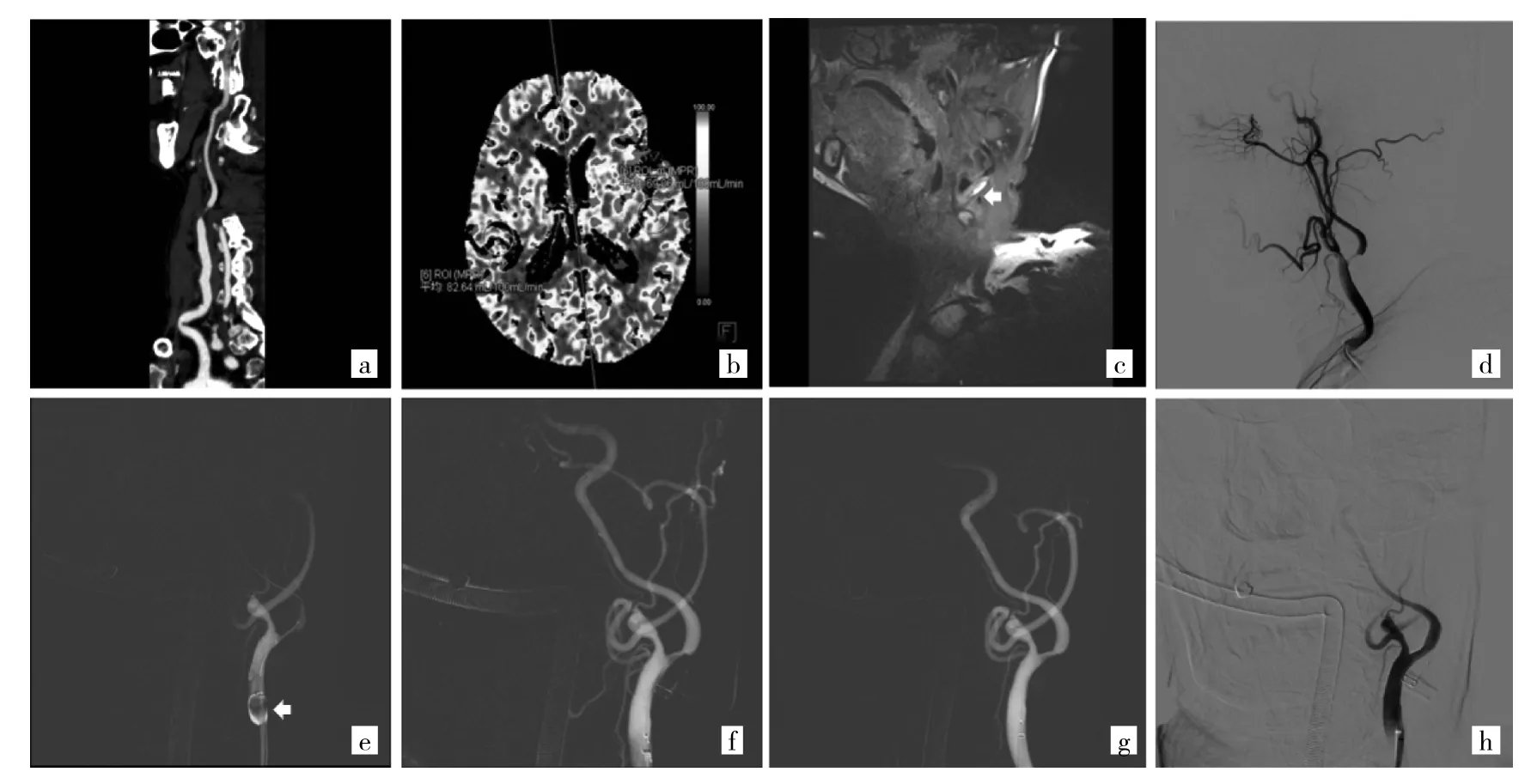
图1 例1的术前和术中影像学资料[a:术前颈部CT血管成像提示左侧颈内动脉起始部重度狭窄;b:术前头颅CT灌注成像提示左侧局部脑血流量较对侧降低;c:术前颈部斑块高分辨MRI的T1WI序列可见斑块内明显高信号,考虑存在斑块内出血(白色箭头所示);d:数字减影全脑血管造影(DSA)提示左侧颈内动脉起始部重度狭窄>95%,颈内动脉血流速度减慢(和同侧颈外动脉相比);e-h:在球囊导引导管(BGC)保护下(白色箭头所示)使用直径2.0 mm小球囊对病变进行预扩张,将6 mm Spider保护伞植入颈内动脉C1段远端平直处,给予4 mm×30 mm球囊以10 ATM压力预扩张,扩张满意后植入6~8 mm×30mm开环支架(Acculink,美国雅培公司),造影提示颈内动脉狭窄明及血流速度明显改善(和同侧颈外动脉相比)]
2.2.2 例2 男,67岁。因“发作性单眼黑朦半月余1次”于2020年1月7日入院。入院查体:神志清,言语清晰,理解力、计算力及记忆力均正常,四肢肌力V级,双侧巴氏征(-)。外院DSA提示左侧颈内动脉起始部次全闭塞。入院后左侧颈内动脉起始部斑块MRI提示脂质斑块(图2a-b),CT灌注成像提示左侧半球明显低灌注(图2c),入院后5 d在插管全麻BGC保护下行CAS(图 2d-h)。

图2 例2的术前和术中影像学资料[a:术前头颅CT灌注成像提示对比剂平均通过时间较对侧明显延长;b:术前颈部斑块高分辨MRI的T1WI序列可见狭窄处血管壁明显高信号,考虑存在脂质坏死(白色箭头所示);c:数字减影全脑血管造影(DSA)提示左侧颈内动脉起始部重度狭窄>95%,颈内动脉血流速度减慢(和同侧颈外动脉相比);d-h:微导管在300 mm 0.014微导丝引导下到达狭窄远端,交换出微导管后在球囊导引导管(BGC)保护下(图e白色箭头所示)使用直径2.0 mm小球囊对病变进行预扩张,将6 mm Spider保护伞植入颈内动脉C1段远端平直处,给予4 mm×30 mm球囊以8 ATM压力预扩张,植入6~8 mm×30 mm闭环支架(Xact,美国雅培公司)后,再次给予4 mm×30 mm球囊以8 ATM压力后扩造影提示支架贴壁良好,颈内动脉狭窄程度及血流速度明显改善(和同侧颈外动脉相比)并可见保护伞内充盈缺损(图g白色箭头所示),回收后可见伞内脂质样物质]
3 讨论
目前症状性颈内动脉次全闭塞采用何种治疗方式仍有争议。NASCET和欧洲颈动脉外科手术试验(Euro-pean carotid surgery trial,ECST)两项研究的汇总分析提示症状性颈内动脉次全闭塞患者经过单纯药物治疗后卒中复发率低且并未从颈动脉剥脱术中(carotid endarterectomy,CEA)获益[9-10]。因此,2017 欧洲血管外科学会的临床实践指南仍然将单纯药物治疗作为症状性颈内动脉次全闭塞的首选治疗方式[11]。近年来研究显示经过单纯药物治疗,症状性颈内动脉次全闭塞仍有较高的卒中复发率[2-3],并且2019年的两项Meta分析指出CAS和CEA均可以显著减少症状性颈内动脉次全闭塞患者的30 d[12]和1年[7]的卒中复发率。因此对于颈内动脉次全闭塞的患者,当侧支循环代偿不足导致血液动力学改变并伴有临床缺血症状时,目前更倾向于手术治疗。
随着介入技术及器械的进步,目前CAS已经被广泛用于治疗症状性颈内动脉次全闭塞。Yan等[5]的一项回顾性研究中指出CAS和CEA相比显示出较低的再狭窄率,但CAS组患者MRI弥散加权序列阳性率明显高于CEA组,达到57.4%。这个结果不难理解,因为在CAS的操作过程中,小球囊预先扩张阶段无任何保护措施,因此极有可能出现微栓子脱落至远端血管导致缺血事件,特别是对于预扩部位有脂质斑块、斑块内出血或溃疡斑块等易损斑块时,栓子脱落的发生率将会更高。国内一项研究证实使用CAS治疗症状性颈内动脉次全闭塞时,近端球囊保护装置(MO.MA,意大利Invatec公司)能明显减少脑梗死的发生率及脑梗死灶的数量[13]。但是MO.MA使用过程中存在患者不能耐受缺血、不能即时造影、操作比较繁琐的缺点。近年来BGC被广泛应用于急性颅内大动脉闭塞性缺血卒中的血管内治疗,通过充盈球囊,形成操作区的静态或逆向血流,操作完毕后回抽血液预防栓子逃逸至远端血管导致栓塞事件[8]。本研究通过BGC近端保护下利用小球囊预先缓慢扩张病变,然后将保护伞送至病变远端血管平直处,随后进行接下来的血管内操作,整个过程中BGC和保护伞交替发挥对远端血管的保护作用,所有患者手术均获得成功。相比于MO.MA,BGC有其独特的优势:(1)相同外径的BGC的内径要大于MO.MA,有着更强抽吸脱落血栓的能力;(2)BGC是单球囊的导引导管,操作简单。
4例患者在球囊扩张过程中发生了低血流动力学状态(收缩压<90 mmHg或心率<50次/min),低于季蕾等[14]报道的82.7%。这4例患者均未造成神经缺血症状,提示血管扩张后血流速度改善,微栓子清除率增强,降低了脑缺血事件的发生风险。
综上所述,本研究所有患者在围术期及术后3个月的随访中均未发生心脑缺血事件,提示在BGC保护下使用CAS治疗症状性颈内动脉次全闭塞的患者是安全可行的,但是本研究样本量较小,其是否能更好地预防脑栓塞需要临床随机对照研究进一步证实。
