胞核中核转运受体蛋白Karyopherin alpha 2水平与胃癌预后的关系研究
2021-06-19张玲娜甘梅富周梦雅翁寿向李玉晶蒋菲
张玲娜 甘梅富 周梦雅 翁寿向 李玉晶 蒋菲
胃癌是常见的消化道肿瘤,发病率和死亡率均较高,目前手术根治是主要治疗胃癌的方法。早期胃癌患者术后生存率较高,但如果确诊时已处于晚期,即使经过合理的综合治疗,5年生存率也往往不太理想。胃癌影响因素众多,不同胃癌患者的预后差异很大,病理形态学在预测预后和指导治疗方面存在一定局限性,因此寻找具有预测意义的标志物有助于评价不同时期胃癌患者的预后。Karyopherin alpha 2(KPNA2)基因位于染色体17q23-q24,其编码产物是一种含529个氨基酸的核转运受体蛋白。近来有多项研究表明,KPNA2与肿瘤形成与发展相关(特别是细胞核内KPNA2水平),在多种组织来源的肿瘤细胞(乳腺癌、非小细胞肺癌、膀胱癌、卵巢癌、食管鳞癌等)中呈高表达,与肿瘤的分级、分期等呈正相关[1-2]。目前关于KPNA2表达与胃癌相关性的研究报道仍较少,笔者通过检测KPNA2在胃癌组织中的表达情况,探究KPNA2水平与胃癌各临床病理参数及预后的关系。
1 对象和方法
1.1 对象 收集2010年1月至2014年11月在浙江省台州医院胃肠外科手术并具有完整临床资料和随访资料的103例原发胃腺癌患者,男74例(71.8%),女29例(28.2%),年龄39~89岁(中位62岁)。随访至2018年12月。本研究经本院医学伦理委员会批准。
1.2 方法
1.2.1 组织芯片制备 对所有患者的HE染色切片重新阅片。选取1个肿瘤组织区域,1个癌旁组织区域,1个正常组织区域(距离肿瘤>5 cm的切缘部位),对照石蜡标本标记,用穿刺针(孔径1 mm)穿入,采集组织置于蜡块矩阵中,将其排列整齐后进行包埋;少部分高分化组织肿瘤区域太小,无法制成芯片,直接选用原蜡块。
1.2.2 免疫组化(Envision法) 组织芯片或原蜡块切片3 μm,常规脱蜡,3% H2O2处理后进行EDTA抗原修复,分别滴加一抗 KPNA2(1∶200稀释,美国 Santa Cruz公司,1 ml)和p53(福州生物科技有限公司,即用型6 ml)室温孵育2 h,其他按照说明书操作,由2位有经验的病理科主治医师在显微镜下观察。KPNA2判读标准[3]:在>10%的上皮细胞中观察到完全核染色判为阳性;≤10%的上皮细胞核阳性或者仅细胞质阳性、不着色判为阴性。p53判读标准[4]:肿瘤区域核染色阳性细胞比例≤10%为阴性,>10%为阳性。
1.2.3 KPNA2与p53 mRNA水平的相关性分析 使用可视化TCGA在线数据分析网站GEPIA2(http://gepia2.cancer-pku.cn)分析胃癌组织中KPNA2与p53 mRNA水平的相关性,P<0.05为存在相关性,相关系数r>0为正相关,反之为负相关;r绝对值越大,相关性越强。
1.3 统计学处理 采用SPSS Statistics 22统计软件。非正态分布的计量资料以M(P25,P75)表示,组间比较采Mann-Whitney U检验;计数资料以例数(百分比)表示,组间比较采用χ2检验或Fisher精确检验。KPNA2表达与患者生存之间的关系采用Kaplan-Meier生存曲线分析及log-rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 KPNA2在胃癌、癌旁与正常组织中的表达 免疫组化结果显示,KPNA2在胃组织中主要表达于细胞质和细胞核(图1,见插页)。胃癌组织中KPNA2核阴性54例(52.4%),阳性49例(47.6%);癌旁组织核阳性10例(9.7%);正常组织核阳性8例(7.8%)。胃癌组织与癌旁组织、正常组织KPNA2阳性例数差异均有统计学意义(均P<0.05),而癌旁组织与正常组织比较差异无统计学意义(P>0.05)。

图1 免疫组化检测KPNA2在胃组织中的表达(a:KPNA2在胃正常上皮细胞核中阴性表达;b:KPNA2在癌旁细胞核阴性表达;c:KPNA2在胃癌组织中核阳性表达;DAB染色,×20)
2.2 KPNA2表达水平与胃癌各临床病理参数的关系 103例胃癌患者中,肿瘤直径0.6~10.3 cm(中位4 cm);组织学分级、组织学分类、神经侵犯、脉管内癌栓、浸润深度、淋巴结转移、TNM分期等情况见表1。将KPNA2免疫组化结果与各临床病理参数及p53表达水平进行分析,结果显示KPNA2表达与患者年龄、肿瘤大小、神经侵犯、脉管内癌栓、肿瘤的浸润深度、淋巴结有无远处转移、TNM分期、p53表达等均相关(均P<0.05),与患者性别、组织学分级、组织学分类、淋巴结有无转移、切缘情况、Lauren分型等均无关(均P>0.05)。另外,在GEPIA2平台分析了胃癌组织中KPNA2与p53 mRNA表达水平的相关性,结果显示两者呈正相关(r=0.24,P<0.05)(图 2)。
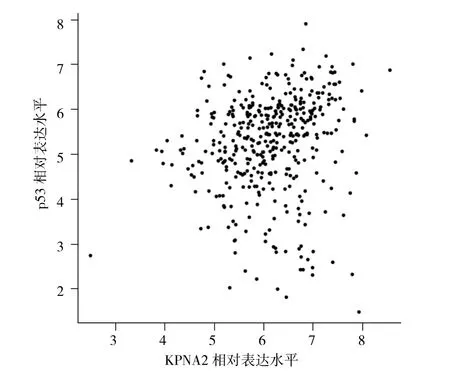
图2 胃癌组织中KPNA2与p53 mRNA表达水平的散点图
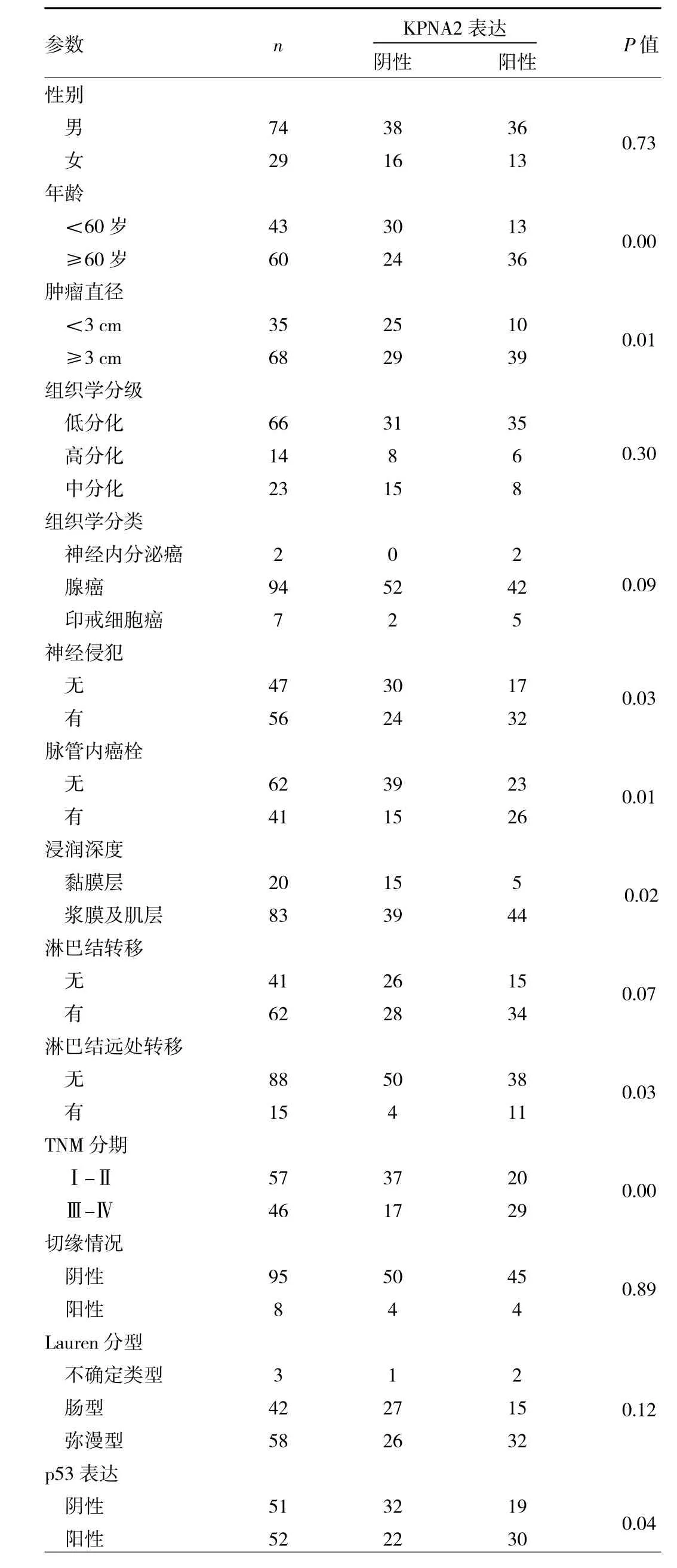
表1 KPNA2蛋白表达与临床病理参数相关性分析(例)
2.3 KPNA2表达与胃癌患者生存的关系 随访时间0~90个月,中位时间27.5个月,Kaplan-Meier生存曲线分析显示,KPNA2核阳性表达患者的生存时间为(56.7±5.8)个月,阴性表达患者为(72.8±4.5)个月,log-rank 检验分析结果显示差异有统计学意义(χ2=5.631,P=0.018),见图 3。

图3 KPNA2不同表达情况患者的生存曲线
3 讨论
KPNA2是importin α家族的成员,通过识别和结合靶蛋白质的核定位信号,而后与其他相关蛋白质结合形成核转运复合体,实现靶蛋白质的核转位。KPNA2的中心疏水结构域有两个核定位信号结合位点,能与具有核定位信号的入核蛋白结合;N端同时还有一个功能域结合importin β。Importin β将KPNA2和入核蛋白组成的复合物带入细胞核,并在核内与Ran-GTP结合从而释放KPNA2。KPNA2与Ran-GTP、CAS蛋白结合返回胞质区[1]。近来有较多研究表明,KPNA2特别是细胞核内KPNA2水平与细胞增殖、迁移及肿瘤形成发展相关,与肿瘤的分级、分期、脉管浸润以及与预后不良相关[5-6]。
关于KPNA2促进肿瘤进展,影响预后的机制,在不同肿瘤里面可能不尽相同:乳腺癌中KPNA2可通过雌激素/c-Myc/miR-26b途径介导雌激素刺激的细胞生长;非小细胞肺癌中KPNA2高表达诱导E2F1和OCT4入核引发肿瘤[7];上皮性卵巢癌可能上调或促进C-Myc、p-Akt、GSK-3β 等,下调 FOXO3a、p21Cip1 和 p27kip1等,从而促进肿瘤的迁移、侵袭及上皮间质转化[8];肝细胞中KPNA2受miR-139负向调节,p53可抑制肝癌中的CAS和KPNA2以抑制肿瘤细胞的生长,KPNA2介导转录因子PLAG1向细胞核转运[1,9];大肠癌中Wip1与KPNA2相互作用,调节AKT/GSK-3β信号转导和肿瘤转移相关因子的激活[10];食管鳞癌中KPNA2高表达诱导E2F1入核,促进细胞增殖[11];胃癌中报道有通过KPNA2/NBS1/Snail激活Wnt/β-catenin信号,另外受miR-26b的调节也可促进细胞迁移和侵袭[1,12-13]。另外,关于p53与KPNA2,有报道称肠癌中p53激活剂和Wip1抑制剂可下调KPNA2表达[10];膀胱癌细胞株中敲低KPNA2之后,p53表达量上升[14];口腔鳞癌中KPNA2可调节p53入核[15]。关于胃癌中KPNA2与p53的关系还未见报道。
本研究发现胃癌组织细胞核中KPNA2阳性率高,KPNA2表达与患者年龄、肿瘤大小、神经侵犯、脉管内癌栓、肿瘤的浸润深度、TNM分期等均相关(均P<0.05),KPNA2核阳性表达患者的生存时间不及阴性表达患者。同时还发现KPNA2与p53在蛋白水平和mRNA水平上均有相关性(均P<0.05),表示KPNA2促进胃癌发生、发展的过程中,p53可能也扮演了重要的角色。值得注意的是,由于野生型p53蛋白不稳定,室温保存以及后续操作过程中往往会降解掉,因此免疫组化检测到的阳性往往是发生突变的p53;而mRNA水平检测是基于新鲜组织的,可同时包括突变和野生型的p53,两者可能会有一定的差异。目前,本课题组关于KPNA2与p53在胃癌发展机制中的相关研究还在进行中。
总之,本研究表明KPNA2核表达与一些胃癌临床病理参数及预后较差相关,与p53表达相关,提示KPNA2可能是胃癌患者的预后分子标志物以及潜在的治疗靶标。
