中国荷斯坦牛HSPB8 基因与热应激反应性状相关性研究
2021-06-19胡丽蓉刘嘉莉罗汉鹏杨明路黄锡霞王雅春
张 帆,胡丽蓉,刘嘉莉,康 玲,罗汉鹏,杨明路,徐 青*,郭 刚,初 芹,黄锡霞,王雅春*
(1.新疆农业大学动物科学学院,新疆乌鲁木齐 830052;2.中国农业大学动物科学技术学院,北京 100193;3.北京交通大学生命科学与生物工程研究院,北京 100044;4.北京首农畜牧发展有限公司,北京 100029;5.北京市农林科学院,北京 100089)
热应激每年给奶牛业带来巨大损失,已成为困扰全世界奶牛产业的难题之一。热应激环境下,多数动物会产生热休克反应,机体表达大量的热休克蛋白(Heat Shock Proteins,HSPs)。热休克蛋白种类繁多,按分子量分为小分子热休克蛋白(sHSP)、HSP40、HSP60、HSP70、HSP90、HSP110 及泛素 7 个家族。在sHSP 家族中,HSPB8 蛋白亦称为HSP22、H11 激酶,在氧化应激[1-2]、线粒体自噬[3-5]、细胞凋亡[5-6]、炎症反应[7-9]中均有重要的功能。HSPB8 作为一种分子伴侣,能够与骨形态发生蛋白(Bone Morphogenetic Protein,BMP)结合,激活PI3K/Akt 通路,抑制细胞凋亡[10-11];与BAG3(Bcl-2-associated Anti-Apoptotic Gene 3)、HSP70、SYNPO2(Synaptopodin 2)结合,加快变性或错误折叠的蛋白质修复和降解[12-15];与微管相关蛋白-2(Microtubule Associated Protein 2,MAP2)结合以维持细胞骨架完整[16-18],保护热应激下的细胞。此外,热应激时机体为减少产热会增加糖代谢,减少脂代谢,细胞的能量需求量也会增加。而HSPB8 蛋白通过阻止二硫苏糖醇诱导的胰岛素聚集和热诱导的柠檬酸合酶聚集,使三羧酸循环正常进行,保证细胞的能量平衡[19-20]。因此,HSPB8 蛋白在细胞抗热应激中发挥重要作用,在热应激条件下过表达HSPB8 蛋白可以在一定程度上增加细胞的耐热性[21-22]。
在果蝇和水牛的研究中都发现热应激可以引起HSPB8基因表达显著上调[19,23-24];2018 年,Sengar 等[25]研究发现牛热应激后表达显著上调的1 个miRNA(btamiR-2898),在HSPB8基 因3'UTR 区域有2 个结合位点,进一步在外周血单核细胞(Peripheral Blood Mononuclear Cells,PBMC)中证实了热应激引起btamiR-2898 的过表达能够调控目标基因的表达。Verma等[26]在沙希华牛群中发现HSPB8基因第一外显子区g.507 G>A 突变不同基因型个体间的耐热性存在显著差异,并认为该位点的AG 基因型可作为沙希华牛耐热性选择的遗传标记。
本文从细胞水平研究了HSPB8基因的表达及其与中国荷斯坦牛热应激反应性状之间的相关性,为研究热应激反应与奶牛重要候选基因遗传多样性的关系、筛选奶牛耐热性相关遗传标记、培育耐热品种提供理论参考。
1 材料与方法
1.1 热应激条件下HSPB8基因的表达变化
1.1.1 细胞热应激处理 奶牛外周血单核细胞(Peripheral Blood Mononuclear Cells,PBMC)和牛肾细胞(Madin-Darbv Bovine Kidney,MDBK)为课题组保存的细胞模型[27]。细胞常规培养[27]24 h 后,实验组42℃水浴处理1 h,对照组37℃处理1 h,每组12 个重复。
1.1.2HSPB8基因mRNA 表达分析 利用NCBI 网站检索目标基因HSPB8和内参基因GAPDH的mRNA 序列,设计引物:HSPB8-F:TAAAATGTTGGGGGTCGGGG;HSPB8-R:TGCAATGGAGCATGACCTGT;GAPDH-F:GGCGCCAAGAGGGTCAT;GAPDH-R:AGGCATTG CTGACAATCTTGAG,进行细胞总RNA 的提取、反转录及定量PCR 检测。
1.2HSPB8基因多态筛查
1.2.1 DNA 池的构建 选取70 头无亲缘关系的中国荷斯坦牛公牛,冻精样品由北京奶牛中心提供。采用高盐法[28]提取基因组DNA,NanoDrop 2000 检测浓度后调整为100 ng/µL。随机将样品分成3 组(20、20、30 头),根据DNA 浓度等量混合构建3 个DNA 池,4℃保存备用。
1.2.2 基因多态筛查 参考已知序列(NC_037344.1)共设计3 对引物(表1),涵盖HSPB8基因全部编码区、部分内含子区及上下游调控区各500 bp。
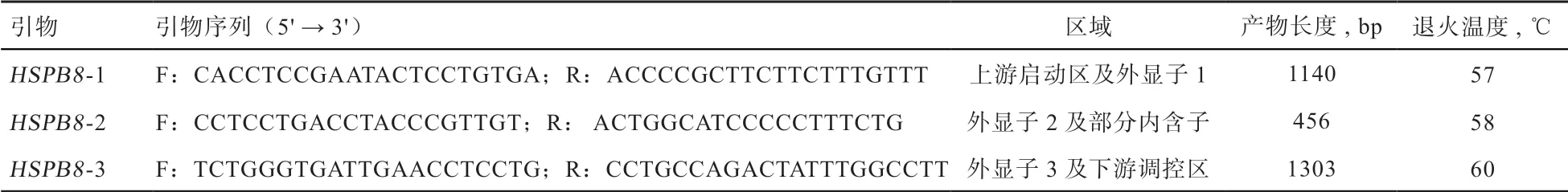
表1 HSPB8 基因多态筛查用引物信息
PCR 反应体系25 µL:DNA 池(100 ng/µL)0.5 µL,2×Taq Master Mix 12.5 µL,上下游引物(10 µmol/µL)各1 µL,ddH2O 10 µL。PCR 产物经2%琼脂糖凝胶检测后送至生工生物工程(上海)股份有限公司测序,根据测序峰图与参考序列比对来判定多态性。
1.3HSPB8多态性与热应激反应性状的关联分析
1.3.1 热应激反应性状表型及估计育种值(EBVs)估计 热应激对奶牛造成的影响与体温升高的幅度有关[29-30],耐热性较好的个体体温调节能力强,热应激时体温变化幅度小,应激反应小。奶牛有多种度量体温的方法,其中直肠温度具有稳定性高且易检测的优点,往往被作为体温指标的重要首选。此外,当奶牛出现热应激反应时,会表现出呼吸频率加快、心率加快,同时出现张嘴呼吸伴随流涎。因此,除直肠温度外,呼吸评分和流涎指数也往往被作为衡量热应激反应的生理指标[31]。
2013—2017 年夏季(THI>72),共测定北京地区12 541 头中国荷斯坦母牛的直肠温度、评分及流涎指数3项生理指标,方法参考文献[31]。课题组共整理70 819 条数据(含系谱),其中1 665 头实验牛(基因分型)每头含有6 条表型数据,直接使用表型值与SNP 进行关联分析并不严谨。EBVs 在计算过程中去除了系统环境效应和永久环境效应对表型值的影响,使用热应激性状的EBVs 与基因多态性进行相关性分析相对表型值来说,结果更准确、更灵敏[32]。
采用多性状动物模型借助DMU 软件DMUAI 模块[33-34]估计EBVs。系谱来自北京奶牛中心,包括1990—2017年共450 975 头牛。模型为:

其中,Yilkpmn为直肠温度、呼吸评分或流涎指数表型;FYMi为固定效应,在直肠温度评估中为场年组合效应,在呼吸评分和流涎指数评估中为场年评分人的组合效应;Ml为挤奶时间(前/后)效应;Timek为测定时间(上午/下午)效应;PARITYp为胎次(1、2、3、4、5、≥6)效应;DIM为泌乳天数效应;DIM2为泌乳天数二次项;TEM为环境温度;Am为加性遗传效应;PEm为永久环境效应。
1.3.2 母牛DNA 的提取及基因分型 从上述有表型数据的母牛中随机选取1 665 头,来自北京地区9 个牧场。颈静脉采血,肝素钠抗凝,使用DNA 试剂盒(天根,DP318)提取基因组DNA,浓度检测后调整至50 ng/µL备用。对筛选到的HSPB8基因的2 个SNPs,重新设计引物(表2),采用竞争性等位基因特异性PCR(Kompetitive Allele Specif ic PCR,KASP)分型[35],由中玉金标记(北京)生物技术股份有限公司完成。

表2 SNP 位点KASP 分型用引物信息
1.3.3 统计分析 使用Haploview(version 4.2)软件分别对HSPB8基因的SNPs 进行连锁不平衡分析,采用SAS 9.2 软件对直肠温度、呼吸评分和流涎指数的EBVs 与SNP 进行单个位点和单倍型组合关联分析,线性模型为Y=µ+G+e,其中Y表示各性状EBVs,µ是总体均值,G为基因型效应,e为随机残差效。采用Bonferroni 法进行同一SNP 不同基因型的多重比较。
2 结果与分析
2.1 热应激对HSPB8基因mRNA 表达量的影响 如图1 所示,在PBMC 细胞中,与对照组相比,热应激组HSPB8基因的表达量上调了2.17 倍(P<0.01);而在MDBK 细胞中,HSPB8基因的表达量上调更加明显,与对照组相比差异达到了6 倍(P<0.01)。

图1 热应激对HSPB8 基因表达的影响
2.2 中国荷斯坦牛HSPB8基因多态性分析 采用DNA池测序法对HSPB8基因进行多态性筛选,共检测到2个SNPs(表3),一个位于内含子2 区域,另一个位于3'UTR 区(图2)。

表3 中国荷斯坦牛HSPB8 基因多态位点

图2 HSPB8 基因多态位点测序峰图
2.3HSPB8基因SNPs 与热应激反应性状的相关性 基因分型结果如表4 所示,卡方检验表明,在中国荷斯坦牛群体 中g.58406728G>A 和g.58406042A>G 这2 个位点均处于Hardy-Weinberg 平衡状态(P>0.05)。二者均属于中度多态标记,多态信息含量(PIC)为0.37。对g.58406728G>A 位点而言,G 等位基因是优势等位基因,AG 基因型为优势基因型。而g.58406042A>G 位点,A等位基因属于优势等位基因,AG 基因型为优势基因型。
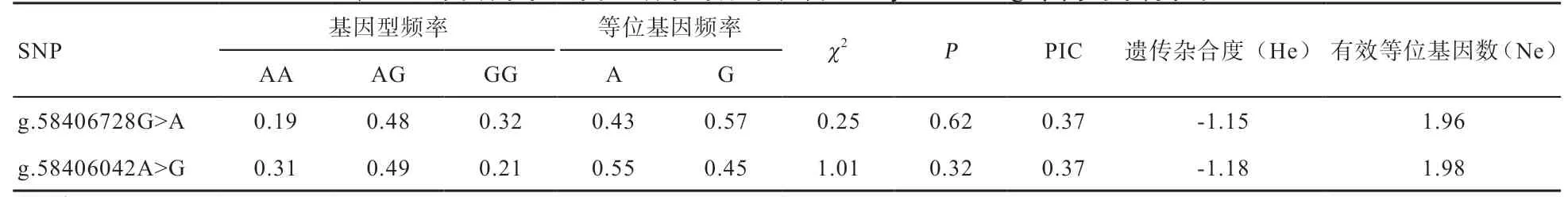
表4 基因频率和基因型频率的分布以及Hardy-Weinberg 平衡的卡方检验
分别用这2 个SNPs 位点与3 个热应激反应性状直肠温度、呼吸评分和流涎指数的EBVs 进行单标记关联分析,结果如表5 所示。可以看出,g.58406728G>A位点与流涎指数EBVs 性状显著相关,其中,GG 型个体的EBVs 显著高于AA 型和AG 型个体,分别高0.097和0.083;AA 型个体的EBVs 数值最低,但与AG 型差异不显著。

表5 HSPB8 基因多态与直肠温度EBVs、呼吸评分EBVs 和流涎指数EBVs 的关联分析
g.58406042A>G 位点分析结果显示其与直肠温度性状呈显著相关。AA 型个体的EBVs 极显著低于GG 型;而杂合子AG 型EBVs 居中,与2 个纯合子差异不显著。
2.4HSPB8基因SNPs 连锁不平衡分析 单倍型分析结果显示,2 个SNPs 具有较紧密的连锁关系,D'=0.957,r2=0.912,二者均为标签SNP(图3)。H1、H2 为优势单倍型,二者频率之和为0.978(表6)。当二者均为有利突变时,其中单倍型组合为H3H3,但是H3H3的个体数量太少,仅有4 头牛,不具有群体代表性,会导致所估计的总体均值具有较大误差,因此未纳入后续分析中。此外,为更准确估计各单倍型组合的总体均值,本研究以个体百分比大于5%为标准,筛选出了3 种优势单倍型组合(即H1H1、H1H2、H2H2)与表型性状EBVs 进行关联分析,分析结果如表7 所示。

表6 单倍型频率
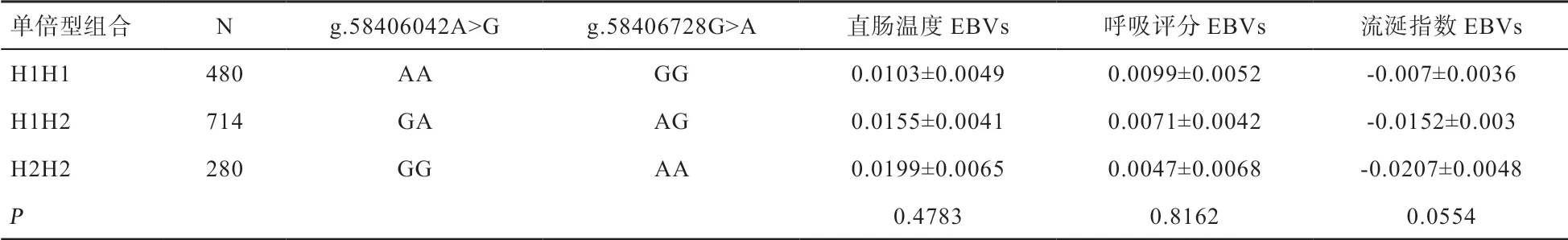
表7 单倍型组合相关性分析

图3 HSPB8 基因2 个SNPs 连锁不平衡估计
3 讨 论
3.1 热应激诱导HSPB8基因的表达 本研究中,牛MDBK细胞和PBMC 细胞经热刺激处理后,HSPB8基因表达量都极显著上调。Boardman[23]和Kirbach[36]分别对果蝇和大鼠的组织进行热处理,均发现HSPB8基因表达显著上调,这也与本研究结果一致。根据目前的研究显示,HSPB8基因受热应激诱导显著上调可能与热休克因子1(Heat Shock Factor 1,HSF1)过磷酸化激活有关。Vydra 等[37]使用雌激素磷酸化HSF1 发现,HSF1与HSPB8基因启动子区域的热休克原件(Heat Shock Elements,HSEs)结合能力增加,并导致HSPB8基因过表达。Anckar 等[38]也发现热应激诱导HSF 过度磷酸化,增强与HSPB8基因启动子区域HSEs 的结合。但HSF1 的激活过程十分复杂,有人认为热休克蛋白水平和细胞蛋白损伤程度的平衡可以作为应激的敏感因子激活HSF1[39]。2006 年,Shamovsky 等[40]研究发现HSF1 可以由一种核糖核蛋白复合物激活,这种复合物中包含一类RNA 分子,这类RNA 在细胞中可能作为温度感受器发挥作用,当温度变化时,其构像发生变化,并最终导致HSF1 的激活[41]。
3.2 中国荷斯坦牛HSPB8基因多态与热应激反应 本研究在中国荷斯坦牛群中发现HSPB8基因的2 个SNPs,一个位于内含子2,一个位于3'UTR 区。Nishant 等[26]在沙希瓦华牛群体中发现2 个SNPs,分别是g.507G>A和g.881T>C,与本研究检测到的突变位点没有重叠,这可能与品种的特异性有关。本研究发现HSPB8基因的多态位点与奶牛热应激反应性状间存在显著的相关性。其中,位于内含子2 上的位点g.58406728G>A 与流涎指数EBVs 显著相关。本研究对流涎指数的评分标准包括流涎与否和口鼻干湿情况,理论上流涎指数越低代表牛越耐热,AA 型和AG 型的EBVs 显著低于GG 型,意味着AA 型和AG 型个体的耐热性可能高于GG 型个体,这也意味着A 等位基因有作为耐热育种标签的潜力。
此外,位于3'UTR 区的位点g.58406042A>G 则与直肠温度EBVs 显著相关,AA 型EBVs 值极显著低于GG 型。直肠温度是个体对于环境温度变化生理调节反应的直接表现,热应激耐受型奶牛的直肠温度显著低于敏感个体[9],因此判断AA 型个体较GG 型个体更耐热,在育种中可以作为热应激耐受型个体的重要参考遗传标记。目前有研究表明位于3'UTR 上的SNP 可以通过改变miRNA 与其结合能力来影响基因的表达[42]。Sengar等[25]也发现奶牛热应激反应状态下表达上调的miRNA(bta-miR-2898)能够靶向结合HSPB8基因3'UTR 区进而调控基因的表达。
本研究中检测的2 个SNPs 位点分别与奶牛流涎指数EBVs、直肠温度EBVs 显著相关,这可能与直肠温度和流涎的发生和发展具有异相性有关。当热应激不严重时,奶牛主要通过皮肤出汗进行散热,此时牛群的流涎指数可能会趋向同质,即很少出现流涎的现象。而当奶牛处于严重的热应激时,皮肤出汗已无法满足散热需求,这时机体会采用加快呼吸频率的方式散热,但当呼吸频率升高到一定程度时,会转为喘息,且出现流涎的现象。因此,直肠温度和流涎指数是从不同角度去评估热应激,具有不同的生物学意义。本研究中,2 个位点与不同的生理指标具有相关性,说明二者参与不同的调控过程,在奶牛热应激反应过程中均具有非常重要的意义。此外,这2 个位点与呼吸评分EBVs 均未有显著的相关关系,可能与奶牛在热应激反应时出现第二项呼吸有关。穆玉云等[43]也认为当牛体温上升到一定程度会出现第二项呼吸,使呼吸频率下降,而耐热的牛呼吸频率仍可保持着较高水平,其认为呼吸频率作为牛的耐热指标不完全准确。在单倍型关联分析中,3 种单倍型组合与直肠温度EBVs、呼吸评分EBVs、流涎指数EBVs均无显著相关性。优势单倍型均不为最优等位基因组合,而是GA 或者AG,这可能是导致单倍型与表型性状EBVs 关联不显著的原因。
4 结 论
本研究从细胞水平和分子水平表明奶牛HSPB8基因是与荷斯坦牛热应激反应相关的重要候选基因。奶牛MDBK 和PBMC 细胞经热处理后,HSPB8基因表达量均极显著上调,证明HSPB8是奶牛体内受热应激诱导的重要基因。进一步,在中国荷斯坦牛群中检测到HSPB8基因的2 个SNPs,与奶牛热应激反应指标直肠温度、呼吸评分、流涎指数估计育种值(EBVs)关联分析结果显示,位于3'UTR 区的g.58406042A>G 位点和位于内含子2 上的g.58406728G>A 位点分别与直肠温度和流涎指数EBVs 显著相关,2 个位点具有A 等位基因的个体比具有G 等位基因的个体更耐热,可用于分子标记辅助育种培育耐热中国荷斯坦牛群体。
