Wnt/β-catenin 信号通路参与毛囊发育及周期循环调控的研究进展
2021-06-19冯自强孙永峰宋玉朴周宇轩李晟毅闫晓敏许云鹏
冯自强,孙永峰*,宋玉朴,周宇轩,张 磊,李晟毅,闫晓敏,许云鹏
(1.吉林农业大学动物科学技术学院,吉林长春 130118;2.江西省畜牧技术推广站,江西南昌 330000)
毛囊(Hair Follicle,HF)是表皮毛发的起源地,是皮肤重要的附属结构之一,其结构控制着毛发的组织结构,决定了皮毛的品质与产量。毛囊的生长发育过程受到多个信号通路的参与,彼此紧密联系且互相制约,共同调控毛囊的形态变化[1-2]。Wnt/β-catenin 信号通路(简称Wnt 信号通路)是具有调节动物生长发育、平衡体内组织、维持器官稳态的关键信号通路[3]。Wnt/β-catenin 信号通路分为依赖β-catenin 转导的经典信号通 路(Canonical Wnt/β-catenin signaling pathway)和不依赖β-catenin 转导的非经典信号通路。Wnt/β-catenin信号通路参与创口愈合、癌细胞发生、毛囊形态变化等多个生理过程的调控,目前已经成为一种基本的生长控制途径[4]。经大量研究发现,Wnt/β-catenin 信号分子、受体、配体、转录因子及其相应靶基因的遗传突变、基因差异表达、表达模式变化以及蛋白修饰都会影响毛囊发育及被毛形成[3-12]。Wnt/β-catenin 信号通路在毛囊生理生化过程中发挥关键作用。因此,本文主要对毛囊的形态结构和生理过程、Wnt/β-catenin 信号通路的构成、Wnt/β-catenin 信号通路其对动物毛囊生长和发育的调节机制进行简要综述。
1 毛囊的形态结构和生理过程
1.1 毛囊的形态结构 毛囊是由多种细胞类群组成的复杂亚器官结构,依据发生的时间早晚和结构差异可分为初级毛囊(Primary Hair Follicle,PHF)和次级毛囊(Secondary Hair Follicle,SHF)[13-14]。初级毛囊形态发生启动早于次级毛囊,结构上毛球较大,毛囊长且粗,存在2 个发达的皮脂腺(Sebaceous Gland,SG),毛干通常有髓质;次级毛囊结构上毛球较小,毛囊短且细,有1 个不发达的皮脂腺或无,毛干没有髓质[15]。成熟的毛囊主要分为相对稳定的漏斗部和峡部以及周期循环的毛囊下部。
毛囊(图1)从内到外依次为毛根(皮肤以内的毛发部分)/毛干(皮肤以外的毛发部位)、毛囊内根鞘(Inner Root Sheath,IRS)和外根鞘(Outer Root Sheath,ORS)以及结缔组织,末端膨大生长成毛球部,容纳毛乳头和毛母质[16-17]。毛根是毛发的根部,被上皮和结缔组织构成的鞘状毛囊包围。毛干可分内、中、外3 层。内层位于毛发中心,称髓质;中层称皮质,为毛发结构的主要部分;外层称角质部,又叫毛表皮。IRS 从内到外依次为鞘小皮层、赫氏层和亨氏层,从毛母质部位逐渐伸展至皮脂腺导管开口处,在皮脂腺水平位置中逐渐消失,只剩下毛干的鞘小皮和毛皮质层显露在表皮外部[14,18]。ORS 则包裹毛根和IRS,类似于表皮的基底层和棘细胞层。毛囊干细胞(Hair Follicle Stem Cells,HFSCs)存在于ORS 形成的隆突中,具有多向分化、自我更新和体外增殖能力强和慢周期性等成体干细胞的共性[19]。毛球部主要由毛母质细胞、毛乳头细胞(Dermal Papilla Cells,DPCs)和黑素细胞构成。毛母质细胞是形成毛干、IRS 的前体细胞,具有干细胞的特性,在毛发生长过程中不间断地进行分裂、增殖、分化,通过接收毛乳头发出的分子信号分化成为不同类型的细胞系。DPCs 是一群由毛母质细胞包裹着的凝集于毛囊基底部位的真皮源性间叶细胞[20-21],具有调控毛囊周期转换、诱导HFSCs 增殖分化及毛囊再生的能力。黑素细胞合成黑色素并将其转运到毛干进行着色。
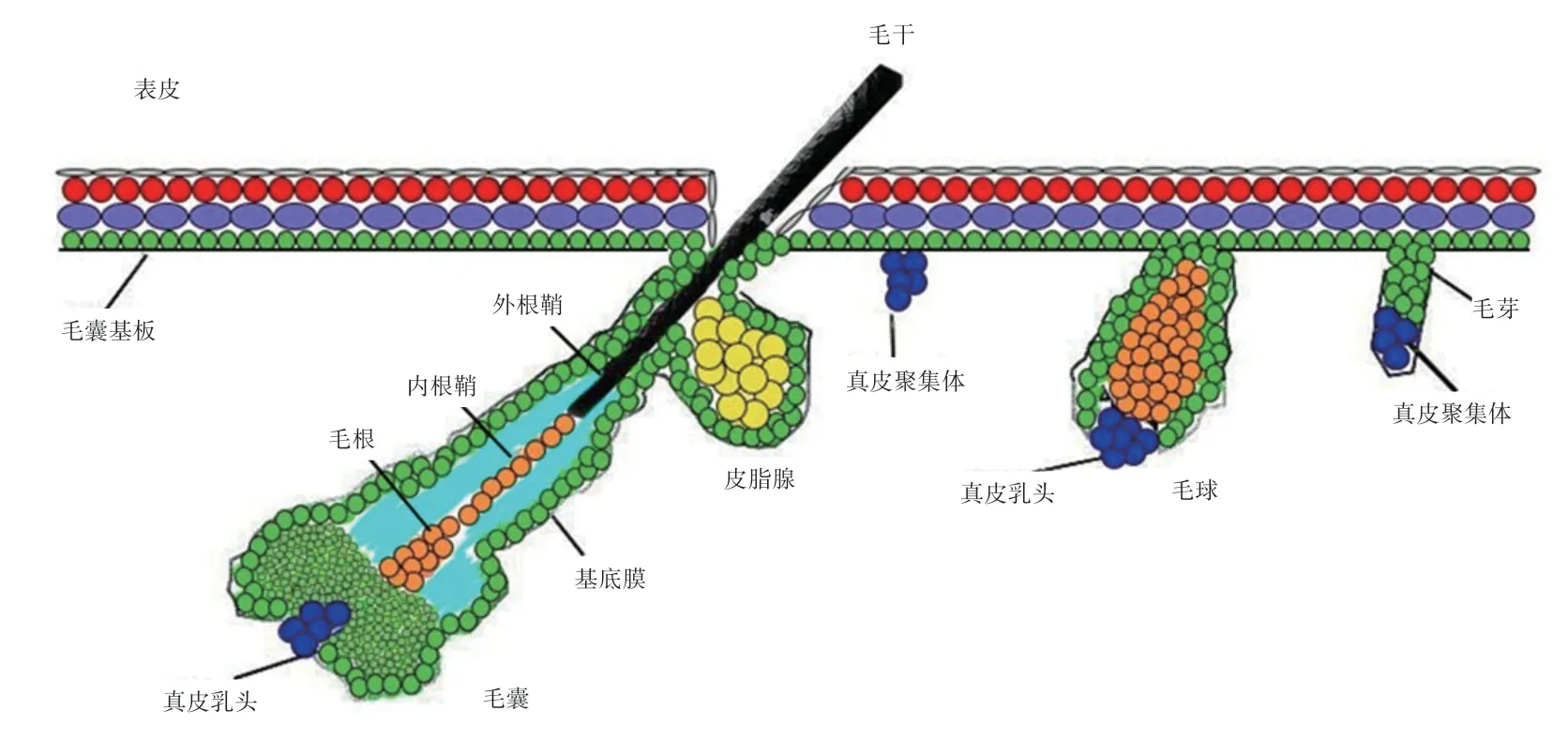
图1 毛囊形态结构示意图
1.2 毛囊发生的生理过程 毛囊形态发生开始于胚胎初期,涉及一系列中胚层-外胚层相互作用。其中,中胚层来源的真皮层间充质细胞为毛囊发生的诱导者,发出初始信号;外胚层来源的表皮上皮细胞接收信号,是毛囊发生的响应者[5,9,22]。根据毛囊形态变化可将该过程划分为感应诱导、器官发生和细胞分化3 个阶段[23]。
1.2.1 感应诱导阶段 感应诱导阶段是毛囊形成的第一步,由真皮细胞发出毛囊原始发生的信号,使激活因子(Wnt/β-catenin、SHH、Noggin 等)和抑制因子(BMP、DKK 等)之间相互作用[18,22,24],形成一种动态平衡,并诱导表皮基底细胞增殖形成排列有序的毛囊基板。
1.2.2 器官发生阶段 毛囊基板形成后,毛囊基板在Wnt/BMP 信号相互调控下,Wnt/β-catenin 信号通路的靶基因Eda/Edar 诱导BMP 抑制剂和SHH 信号表达,推动毛囊发育进行,诱导间充质成纤维细胞不断增殖,促使毛囊基板下形成真皮凝聚体(Dermal Condensate)[18,25]。
1.2.3 细胞分化阶段 毛囊基板细胞不断增殖,形成毛芽,并发出诱导毛芽继续向真皮层增殖分化的SHH 信号[26],随后真皮凝聚体发育成毛乳头。毛乳头释放特异性生长信号,开始诱导HFSCs 分化为各类毛囊细胞。HFSCs 向下缓慢增殖包裹毛乳头形成毛球,类似洋葱状结构[27]。之后,毛乳头附近的HFSCs 继续增殖分化,促进毛母质细胞增殖分化形成毛干、IRS 等结构,最终毛囊成熟。毛囊完全发育成熟后,依次进入形态特征上差异较大的生长期(Anagen)、细胞凋亡驱使的退行期(Catagen)和相对静止的休止期(Telogen)3 个阶段[28-30]。
生长期早期毛囊类似休止期毛囊结构,由真皮完全包裹。随着毛囊不断生长,逐渐形成完整的结构,毛乳头体积增大并上移,毛母质细胞快速增殖,分化为毛囊IRS 和毛干,并逐渐包裹毛乳头形成完整的毛球。毛球从真皮层进入皮下脂肪层,IRS 逐渐生长到皮脂腺开口处,毛干远离皮肤表皮形成毛发。退行期毛囊结构发生一系列退化行为,2/3 的毛囊开始快速退化,毛球和上皮细胞凋亡速率增加以及毛囊近端体积减小,毛母质细胞、毛干、ORS、IRS 等开始凋亡,毛乳头向毛囊远端移动,毛囊缩短。当退行期结束后毛囊进入休止期。休止期毛囊被真皮成纤维细胞完全包裹住,并且尚未到达皮下组织,没有IRS 结构。在休止期期间,隆突部下方的毛乳头处于静止状态,毛囊细胞凋亡停止,不发生显著的凋亡、增殖或分化,毛基质消失,毛囊停止生长。每个休止期结束之后开始进入下一轮的生长期,此时DPCs 能继续提供诱导信号,利用休止期驻留的干细胞为新生毛囊上皮提供燃料,开始新一轮的毛囊生长。毛囊的周期性生长表明其具有长期维持自我更新的能力[26],不断经历退化和再生,控制毛发的生长与脱落。但每个阶段持续时间的长短与毛发类型、部位、物种等因素有关[18]。
2 Wnt/β-catenin 信号
2.1 Wnt 信号通路的发现与发展 1973 年,Sharma 等[31]发现果蝇无翅基因wingless;1982 年,Nusse 等[32]在乳腺癌病毒诱导小鼠乳腺癌中克隆出原癌基因int,两者为同源基因,因此合称为Wnt[2]。Wnt 无论在果蝇还是在哺乳动物上都具有高度的同源性,是一条在生物进化中极为传统的通路[33]。随着研究深入,共有19 个Wnt 家族成员基因在动物中被发现[34-35]。
Wong 等[36]研究表明,Wnt 信号通路分为经典信号通路和非经典信号通路。非经典Wnt 信号通路分为Wnt/PCP(Planar Cell Polarity Pathway,PCP)信号通路和Wnt/Ca2+信号通路[37],与细胞极性和钙离子信号相关。Wnt 的受体分为3 类,即受体卷曲蛋白(Frizzled,Fz)、辅助受体低密度脂蛋白相关受体蛋白 5/6(Low-Density Lipoprotein Receptor-Related Protein-5/6,LRP5/6)和 ROR、RYk 家族。经典和非经典Wnts 共同使用Frizzled家族的受体,LRP5/6 结合经典Wnt 配体,ROR1、ROR2 和RYK 则结合非经典Wnt 配体[38]。目前对非经典Wnt 信号通路的研究并不完善,与动物毛囊生长发育关联性的研究较少,本文主要介绍经典Wnt/β-catenin信号通路。
2.2 经典Wnt/β-catenin 信号 经典Wnt/β-catenin 信号通路由Wnt 蛋白、β-catenin、散乱蛋白(Dishevelled、Dvl 或Dsh)和结肠腺瘤性息肉病蛋白(Adenomatous Polyposis Coli,APC)复合物等组成[47]。β-catenin 在其中起核心作用,所以又叫Wnt/β-catenin 信号通路,β-catenin 在核内聚集水平的改变决定着Wnt 通路的激活或抑制,调节细胞行为[11,38-40]。
2.2.1β-catenin 的结构特征β-catenin 是1980 年发现的定位于胞浆的可溶性蛋白[41],质量为92~95 ku,其基因CTNNB1定位于染色体3P21.3-P22,由16 个外显子组成,含781 个氨基酸,其mRNA 包含3 362 个核苷酸[42-44]。β-catenin 蛋白序列如图2 所示。β-catenin蛋白的多肽链包含3 个发挥不同功能的结构域:含有150 个氨基酸的N 端、含有100 个氨基酸的C 端以及含有550 个氨基酸的中间重复区(ARM 区域)[45]。N 端含有多个保守的丝氨酸、苏氨酸残基,可被糖原合成酶激酶-3β(glycogen synthase kinase -3β,GSK-3β)和酪蛋白激酶1(casein Kinase 1,CK1)磷酸化[46-47],磷酸化的β-catenin 可被β-catenin 重复相容蛋白(β-trans-ducin repeats-containing proteins,β-Trcp)识别并泛素化,最终被迅速降解。C 端呈较强的酸性,含有Tcf 家族转录因子结合位点,是下游靶基因激活转录不可缺少的结构。ARM 区域是β-catenin 最保守的区域,由42 个氨基酸残基的12~14 个ARM 重复序列构成,每个ARM 序列相互作用形成超螺旋结构,大多数正电荷分布在超螺旋结构的凹陷中,使β-catenin 与多种Wnt/β-catenin 信号通路配体蛋白结合,共同参与Wnt 信号转导通路[41-43,48]。

图2 β-catenin 蛋白序列示意图
2.2.2β-catenin 的功能β-catenin 是一种双功能胞内糖蛋白,是发挥Wnt 蛋白功能的主要载体,参与胚胎形成及个体发育等多个生物学过程[7]。β-catenin 不仅是上皮细胞间的黏附分子(膜骨架蛋白功能),还是Wnt/β-catenin 信号通路转导途径中重要的组成部分(信号分子功能),是控制细胞命运的重要调控因子[49-51]。
β-catenin 在动物细胞内有2 种不同的存在形式:其一,细胞中大部分β-catenin 与α-catenin 及跨膜蛋白E-钙粘素(E-cadherin)形成复合物,以β-catenin 与E-cadherin 细胞内膜处连接,通过α-catenin 黏附在肌动蛋白构成的细胞骨架上,形成细胞间稳定的连接,对于发育过程细胞稳定和迁移有着重要意义[45,52-53];其二,少量β-catenin 游离在胞浆或在细胞核内存在,是Wnt途径的主要因子。
2.3 经典Wnt/β-catenin 功能途径β-catenin 的转录调节功能主要通过Wnt 配体触发(图3)。
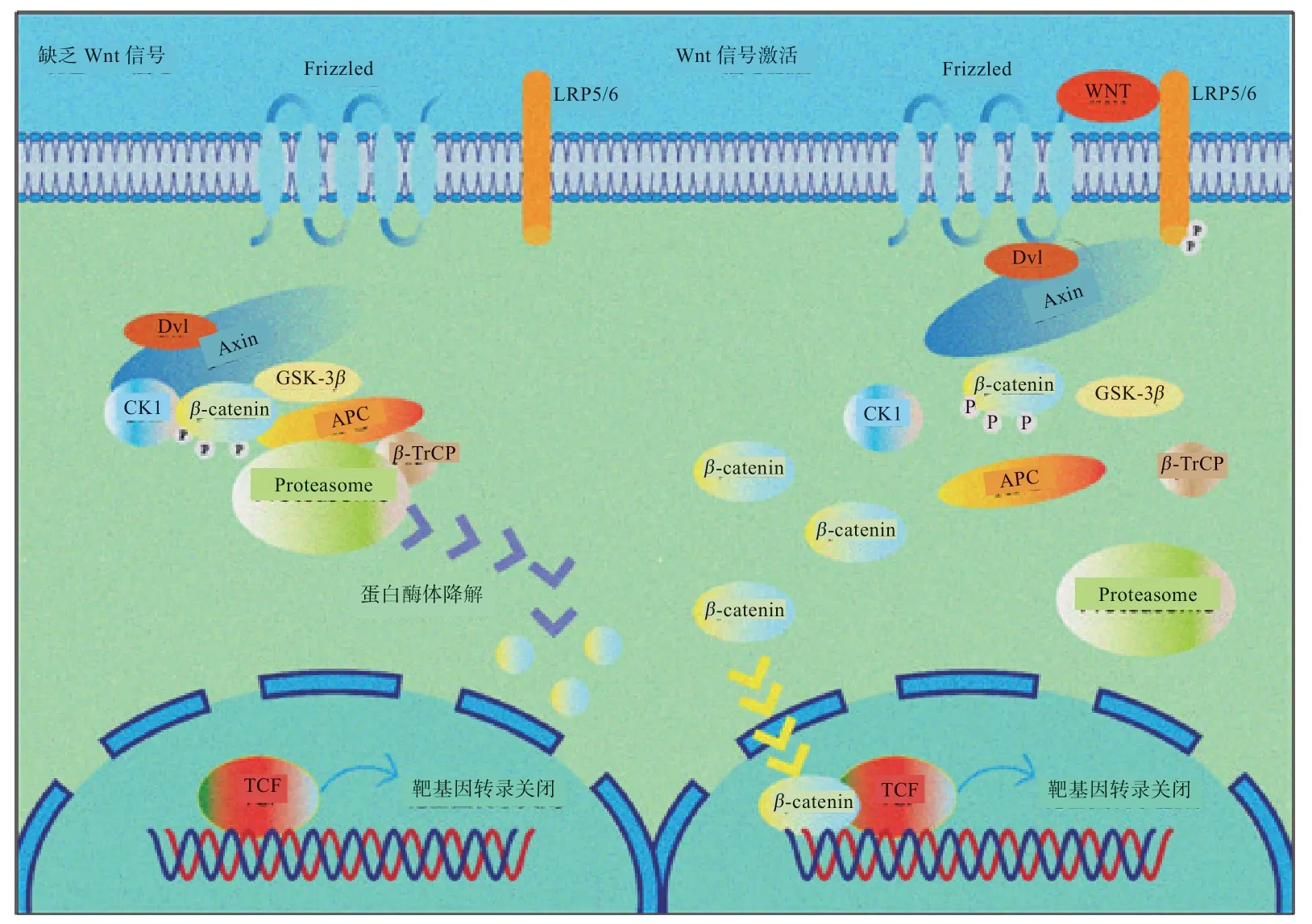
图3 Wnt/β-catenin 信号通路
2.3.1 激活Wnt 信号 当细胞内存在Wnt 配体时,Wnt/β-catenin 信号通路被激活,Wnt 配体与Frizzled和LRP5/6 共受体结合,形成复合体之后,激活Dsh,阻止细胞内APC、GSK-3β、核心蛋白轴蛋白(Axis inhibition,Axin)及β-catenin 组成的复合体激酶磷酸化β-catenin[46],引起β-catenin 降解途径被抑制。之后细胞质内β-catenin 堆积并移位入核,与细胞核内的转录辅因子淋巴增强因子(Lymphoid Enhancer Factor,LEF)/T 细胞因子(T-Cell Factor,TCF)转录家族结合形成复合物并引起构象改变,激活下游靶基因转录,传递生长刺激信号,对细胞的生物学效应进行调节[18,34]。
2.3.2 缺少Wnt 信号 当细胞内无Wnt 配体,缺少Wnt信号刺激时,由Axin 介导,APC、CK1 和GSK-3β构成的蛋白降解复合物与细胞质内游离的β-catenin 结合[12]。细胞质中β-catenin 的氨基酸N 端区域依次被CK1 和GSK-3β磷酸化。磷酸化后的β-catenin 被结合体中存在的E3 泛素连接酶(Ubiquitin lig-ase,E3)上的β-Trcp识别并泛素化,使其发生靶向持续降解。因此,细胞质内游离β-catenin 含量水平持续显著降低,无法移位入核。在细胞核内的LEF/TCF 复合体与转录抑制因子TLE(Transdu-cin-like enhancer)结加强合,导致Wnt靶基因转录活性显著降低,无法激活[9,11]。
在这一系列调控过程中,Wnt 蛋白、Dsh 等是该通路的正反馈调节因子,促进靶基因转录;而APC、GSK-3β等是负反馈调节因子,阻遏靶基因转录。其实质是细胞内β-catenin 水平、位置以及功能的变化,改变下游靶基因表达,刺激或抑制细胞的增殖。
3 Wnt/β-catenin 信号通路对毛囊发育的调控作用
研究发现,Wnt/β-catenin 信号通路在胚胎生长发育和肿瘤细胞发生及形成等方面具有多种生物学功能[54-55]。随着基因敲除、基因定位突变等基因技术的成熟,Wnt 通路被证实对毛囊生长过程有着重要的调节作用,与毛囊正常生理活动有密切联系,是一个关键的信号转导通路。Wnt 信号是毛囊发育的第一信号,广泛参与毛囊形态发生的各个时期,特别是在胚胎初期毛囊中调控细胞迁移、增殖、凋亡、再生、更新方面发挥关键性的作用[56]。越来越多的证据表明,Wnt 通路及其下游效应因子β-catenin在不同阶段的毛囊生理过程有着高度的动态调节作用,在毛囊基板发生、毛乳头功能、毛囊周期性及HFSCs增殖分化等生理过程发挥关键的调控作用[8,21,55-56]。
3.1 Wnt/β-catenin 信号通路调控毛囊基板形成 Wnt/β-catenin 信号通路与毛发发生有密切的联系,对毛囊整个形态变化过程都很重要,尤其在毛囊发生发育的初级阶段发挥关键调控作用[22,57-60]。已知广泛的真皮Wnt信号激活传导对于模式化诱导毛囊基板是必需的,是启动毛囊诱导程序的初始发育信号。研究发现,β-catenin在胚胎发育过程中促进毛囊基板的初始形成,在即将形成基板的上皮中明显上调[61],是成熟皮肤干细胞分化所必需的,同时与毛乳头生长和毛囊周期循环也有着密切的关系[62-63]。上调Wnt 抑制因子Dkk1 会导致基板的标记基因表达模式丢失,影响初始毛囊基板生长,阻碍毛囊形成[62,64]。敲除毛乳头中Wnt/β-catenin 信号关键介导蛋白β-catenin 后,毛发明显变短、变薄,形态改变,基质细胞增殖率降低,毛乳头中基因表达模式改变,影响毛囊生长[17]。而高表达的Wnt/β-catenin 信号能促进毛囊基板的形成[62,64],并在毛囊形态发生和再分化过程起调控作用[61]。
以上研究表明,Wnt 信号对于毛囊基板诱导是必需的,在毛囊基质细胞的增殖、基板初始形成以及基板的发育中都是必要条件。对于后续发挥毛囊基底部的毛乳头功能更有深远的意义。
3.2 Wnt/β-catenin 信号通路调控毛乳头功能 位于毛囊基底部向内凹陷的毛乳头是一种特殊的间充质成分,具有诱导毛囊形态发生、调节毛囊发育及周期循环和协调毛发生长的功能。研究发现,DPCs 具有较强的干细胞特性,是多种干细胞的储存库,在毛发生长过程中指导基质祖细胞分化,在毛发周期的再生过程中引导干细胞膨胀[14,45]。其多能性标记物包括Oct-4、Nanog、Sox2、ZEB1、Snail、CD133、In-tegrin-β1 及ALDHA1,同时有ALP、β-catenin、Versican、NCAM、Lef-1 等与毛囊诱导能力相关的特异性标记物,在特定条件下可向多种细胞分化[9,14,45]。
在毛囊形态发生过程中,Wnt 信号能特异性调控皮肤凝结物和早期DP 功能,是诱导DC 和毛囊DP 的前体细胞团是必不可少的[65]。在发育完全的毛囊DP 中,β-catenin 基因失活会导致产生发干的祖细胞及其后代的增殖显著降低,以及毛囊过早进入退行期并阻止再生[17]。在Kaushal[66]研究发现,通过他莫昔芬(4-OHT)激活生长期和休止期毛囊中的β-catenin 后,DPCs 总数显著增加。而在Wu 等[40]研究中,用XAV-939 抑制Wnt/β-Catenin 信号后,DPCs 的基础增殖降低。B 淋巴细胞诱导成熟蛋白1(Blimp1)是一种转录抑制因子,是毛乳头诱导信号通路(包括TGF-β和Wnt/β-catenin)关键的靶点和介体,可调节包括皮肤在内的多种组织中的细胞生长和分化。研究发现,表皮的β-catenin 过表达后,能够覆盖Blimp1 突变小鼠的毛囊缺陷,加强毛乳头和相邻毛囊上皮细胞之间的密切关系[67]。
大量证据表明,毛乳头中的β-catenin 信号促进DPCs增殖,进而对毛囊的稳态有着深远影响。此外,毛乳头能分泌类胰岛生长因子(Nsulin-like Growth Factor,IC1F)、VEGF(Vascular Endothelial Growth Factor,VEGF)、AKP(Alkaline Phosphatase,AKP)、FGF5(Fibroblast Growth Factor 5,FGF5)、BMP4(Bone Morphogenetic Protein 4,BMP4)等多种生长因子及信号分子[14],通过自分泌和旁分泌方式来共同参与对毛囊周期性变化各个阶段的调控,介导毛囊真皮部分与表皮部分的信号交互[68],调控毛囊生长,刺激HFSCs 的增殖分化,与HFSCs 之间进行双向信息交流和相互诱导,加快毛囊的形成。
3.3 Wnt/β-catenin 信号通路调控毛囊干细胞增殖和分化 起源于早期表皮祖细胞的HFSCs,位于毛囊上段隆突部中部和皮脂腺导管开口下方的细胞群体,周围富含血管和神经,是立毛肌的附着处,并与ORS 相连接。同时在顶端提供快速分裂的细胞,使毛囊进一步向下生长,参与表皮和皮脂腺的形成,也是毛囊细胞的来源。标记HFSCs 后,发现其可以多向分化成所有种类的毛囊细胞类型,在一轮循环后的休止期,仍然存在于隆突部区域。表明HFSCs 可以主导毛囊周期性并分化为毛囊器官,具有多能性,并能够长期性维持自我更新的能力[18]。研究发现,HFSCs 中β-catenin 过表达可增强HFSCs 的增殖能力,反之β-catenin基因特异性沉默后HFSCs 增殖能力明显降低,提示β-catenin 在HFSCs 增殖中发挥重要作用[54]。毛囊调控的基因网络研究表明,Wnt/β-catenin 信号通路广泛参与HFSCs 增殖和多向分化的各个过程[14],决定HFSCs 命运。小鼠毛囊中β-catenin缺失,导致HFSCs 无法适应毛发角质形成细胞的命运,而是分化成表皮角质形成细胞,影响毛囊生长[62]。
Lef1 是Lef/Tcf 家族成员之一,是HFSCs 的分化以及毛囊IRS 形成所必需的转录因子[69]。细胞内Wnt/β-catenin 信号通路被激活后,游离β-catenin 堆积并移位入核,竞争性的与细胞核内的LEF/TCF 转录家族结合形成复合物,激活下游靶基因活性[70]。只有当Wnt/β-catenin 信号存在时,Lef1 才能促进HFSCs 分化为组成毛囊的各类细胞,可见Wnt/β-catenin 信号通路调节HFSCs 的生物学效应。
以上研究表明,Wnt/β-catenin 信号通路在调控HFSCs 增殖、控制分化命运以及相关靶基因的转录具有至关重要的作用,并对毛囊周期循环有重要意义。
3.4 Wnt/β-catenin 信号通路调控毛囊周期循环 HFSCs的增殖分化是毛囊进入生长期的重要条件。在HFSCs增殖分化作用下,促进毛母质细胞形成毛干、IRS 等毛囊结构,毛囊完全发育成熟,呈现周期性循环生长。研究表明,β-catenin 的表达规律与毛囊发育的周期具有相关性,主要表现在毛囊发育初期和成熟的毛囊中,β-catenin 在启动毛囊发育中发挥关键作用,是毛囊毛发周期循环过程中必须的调控因子[34,45]。毛囊在第1 个循环生长周期过程中,过表达Wnt 途径会生成更多的毛发,也会因为β-catenin 缺失导致毛囊消失[34]。在正常毛囊生长期中,β-catenin 呈强表达,特别在毛囊毛母质细胞和毛乳头中,这与正常毛囊结构生长期生理变化相对应。DDK4 是Wnt/β-catenin 信号通路抑制因子,在毛囊成熟进入周期循环之后,表达量下降,在生长期表达较弱,在退行期表达升高。从β-catenin 和DKK4 的表达可以看出,β-catenin 在毛囊生长期发育以及对毛囊周期都是必不可少的。在敲除毛乳头中的β-catenin 后,Wnt 通路传递受阻,使毛囊过早从生长期进入退行期,并且在退行期结束后毛囊周期也将停止,扰乱正常的毛囊周期循环过程[71]。当毛囊正常处于休止期时,β-catenin可以促使毛囊从休止期进入第2 轮生长期,激活并维持HFSCs 的增殖作用[17]。在休止期后期,Wnt 信号逐渐上调,传导毛发生长所必需的促有丝分裂信号,促使毛囊由休止期向生长期过渡,启动毛囊周期循环。
可见,Wnt/β-catenin 信号通路能够调控毛囊的周期性生长、促使毛囊周期的稳定,促进毛囊进入新的循环,以及在这个过程中毛囊的再生和自我更新,这些对于维持毛囊周期性稳态有非常重要的作用。
这些研究确立了Wnt/β-catenin 信号通路在毛发毛囊生长中的关键作用,揭示了毛发周期性循环更新中Wnt/β-catenin 信号通路在控制与协调毛囊发育和结构之间相互作用的重要功能,是毛囊发育必不可少的通路。
4 展 望
尽管关于Wnt/β-catenin 信号通路在调节毛囊发育的作用已经有较多研究,但很多问题仍是Wnt 信号领域研究者亟待解决的任务。如Wnt/β-catenin 信号通路在调节不同物种间毛囊作用的差异并没有完全细致归纳和划分。关于很多非模式动物的研究十分匮乏,只停留在一个较低水平。此外,Wnt/β-catenin 信号通路上不同的Wnt 配体、受体以及抑制因子在不同毛囊类型、周期阶段、细胞环境和所处组织中的不同作用尚未完全研究。非经典Wnt 信号通路对毛囊发育的研究较少,转导级联的许多不同方面仍有待证实,需更好地解释与其他途径的串扰,并充分表达其背后的分子反应。未来研究方向应更多地关注Wnt/β-catenin 信号通路在不同物种毛囊胚胎期中的启动和毛囊周期循环内的表达,多条信号通路与Wnt/β-catenin 信号通路之间的交互作用,探究新的研究方式,完善Wnt/β-catenin 信号通路在调节毛囊发育的作用的研究。
