山腊梅叶挥发油对血管性痴呆大鼠认知障碍的改善作用
2021-06-17王延伍沙沙徐婷饶光玲刘晓龙李亚锋钱海兵
王延 伍沙沙 徐婷 饶光玲 刘晓龙 李亚锋 钱海兵


摘要 [目的]探討山腊梅叶挥发油对血管性痴呆(vascular dementia,VD)大鼠认知功能障碍的影响及其机制。[方法]将SD大鼠随机分为假手术组、模型组、银杏叶组、山腊梅叶挥发油高剂量和低剂量组,除假手术组外,皆采用双侧颈总动脉永久性结扎法(2VO)复制VD模型。通过Morris水迷宫试验和旷场试验测定大鼠的认知功能,HE染色观察海马CA1区病理变化,并检测血清中超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量。[结果]与假手术组比较,模型组大鼠逃避潜伏期延长(P<0.01)、平台穿越次数减少(P<0.01)、垂直得分和水平得分下降(P<0.05)、SOD活性降低(P<0.01)、MDA含量增高(P<0.01);与模型组比较,山腊梅叶挥发油高、低剂量组大鼠逃避潜伏期缩短(P<0.05)、穿越原平台次数增多(P<0.05)、垂直得分和水平得分增高(P<0.05),血清指标SOD活性升高(P<0.05)、MDA含量下降(P<0.05);HE染色结果显示,山腊梅叶挥发油高、低剂量组海马CA1区神经元细胞较完整,排列相对密集有序。[结论]山腊梅叶挥发油具有改善大鼠血管性痴呆认知障碍的作用,其机制可能与纠正大鼠脑组织氧化/抗氧化失衡,保护脑组织免于氧化损伤,并减轻海马区损伤有关。
关键词 山腊梅叶;挥发油;血管性痴呆;认知障碍;改善作用
中图分类号 R285文献标识码 A
文章编号 0517-6611(2021)02-0170-05
doi:10.3969/j.issn.0517-6611.2021.02.046
开放科学(资源服务)标识码(OSID):
Improving Effect of Volatile Oil from Chimonanthus nitens Oliv.Leaves on Cognitive Disorder in Rats with Vascular Dementia
WANG Yan,WU Shasha,XU Ting et al (Guizhou University of Traditional Chinese Medicine,Guiyang,Guizhou 550025)
Abstract [Objective]To investigate the effect and mechanism of essential oil from Chimonanthus nitens Oliv.leaves on cognitive disorder in rats with vascular dementia.[Method]SD rats were divided randomly into sham operation group,model group,ginkgo leaf group,high and low dose of essential oil from Chimonanthus nitens Oliv.leaves groups.Except the sham operated group,all the other groups received twovessel occlusion (2VO) method to establish VD models.Morris water maze and open field test were used to determine the cognitive function of rats.HE staining was used to observe the pathological changes in the CA1 region of the hippocampus.Activity of superoxide dismutase (SOD) and malonaldehyde (MDA) content were detected to explore the mechanism of the essential oil from Chimonanthus nitens Oliv.on VD.[Result]Compared with sham operation group,the rats in model group had longer average escaping latency period (P<0.01),fewer number of crossplatform (P<0.01),fewer vertical and horizontal scores (P<0.05),higher MDA content (P<0.01) and lower SOD activity (P<0.01).Compared with model group,the rats in high and low dose of essential oil from Chimonanthus nitens Oliv.leaves groups had shorter average escaping latency period (P<0.05),more number of crossplatform (P<0.05),more vertical score and horizontal scores (P<0.05),higher SOD activity (P<0.05),lower MDA content (P<0.05).HE staining results showed that the morphological structure of vertebral cells in hippocampal CA1 area were regular,orderly and normal,the structure of cells was intact.[Conclusion]The essential oil from Chimonanthus nitens Oliv.leaves can improve the cognitive disorder of vascular dementia in rats.The potential mechanism may be related to antioxidant and reduction of hippocampal injury.
Key words Chimonanthus nitens Oliv.leaves;Essential oil;Vascular dementia;Cognitive disorder;Improving effect
血管性痴呆(vascular dementia,VD) 是由各类脑血管疾病致使脑功能受损而引起的后天智力障碍综合征。近年来VD的发病率逐年上升,是仅次于阿尔兹海默症(Alzheimers disease,AD)的第二大常见痴呆类型[1-2]。 VD的认知变化远远大于AD等其他疾病,主要为注意力、信息处理和执行功能等缺陷,且抑郁和冷漠等症状在VD患者中表现尤为突出[3]。一系列认知障碍及精神心理活动的转变严重影响老年人的生活质量。目前尚无食品药品监督管理局(FDA)批准的VD治疗方案,临床上的VD药物主要为仅针对症状性治疗的药物,暂不能减缓VD的进展或逆转VD的过程[4],这也使从民族药物中尝试发现具有治疗VD作用的药物成为当下研究的热点之一。山蜡梅为贵州地区少数民族用药,研究表明,山蜡梅叶不仅在抗炎、抗氧化、抗病毒、抗菌、解热等方面有作用,也可影响中枢神经系统[5-6]。近年来的研究发现,挥发油成分对于认知功能障碍具有一定的改善作用[7-10],且李姝臻等[5]研究也发现腊梅叶具有改善痴呆小鼠学习能力的功能,基于此,该研究将基于氧化损伤探讨山腊梅叶挥发油对大鼠血管性痴呆认知功能障碍的改善作用及其机制。
1 材料与方法
1.1 材料
1.1.1 试验动物。
成年雄性SD大鼠,体重(280±20)g,购买于长沙市天勤生物技术有限公司,许可证号:SCXK(湘)2014-0011。动物适应性喂养7d后开始试验。
1.1.2 试验药物。
山臘梅叶在2019年7月采自贵州省贵阳市乌当区,采回的药材经贵州中医药大学药学院刘晓龙博士准确鉴定为腊梅科腊梅属山腊梅(Chimonanthus nitens Oliv.)。每次称取粉碎后的山腊梅叶300 g置于3 000 mL烧瓶中,加1 000 mL去离子水,用挥发油提取器按水蒸气蒸馏法提取5 h,所得的山腊梅叶挥发油为具有浓郁香味的淡黄色透明油状物,用无水硫酸钠脱水,密封避光保存备用,其提取率为0.14%。银杏叶片,规格0.21 g/粒,产品批号190102,广州一力罗定制药有限公司。
1.1.3 主要试剂及仪器。
MDA测定试剂盒(南京建成生物工程研究所,批号 20181226);SOD测定试剂盒(南京建成生物工程研究所,批号 20181220);HE染色试剂盒(北京索莱宝科技有限公司,批号 20180820);DRT-TW电热套(郑州长城科工贸有限公司);Morris水迷宫系统(中国医学科学院药物研究所,DNS-2);旷场试验系统(贵州中医药大学提供);80-1医用离心机(江苏新康医疗器械有限公司);InfiniteM200酶标仪(北京新风机电技术公司);YZB/0009-2003组织包埋机(浙江省金华市科迪仪器设备有限公司);RM2265组织切片机(浙江省金华科迪仪器设备有限公司)。
1.2 方法
1.2.1 模型建立与筛选。
采用双侧颈总动脉永久性结扎法(2VO)[11-12]予大鼠复制VD模型,假手术组大鼠除不结扎血管外,其余操作同VD模型大鼠。在造模完成后第1天进行神经行为学评分以鉴定造模是否成功,评分标准按Longa等[13]制定的5级评分法改进:0分,无神经功能缺损,提尾悬空时,大鼠两前肢可向地面伸直;1分,轻微神经功能缺损,提尾悬空时,大鼠一侧前肢不能充分伸展;2分,中度局灶性神经功能缺损,大鼠向一侧环行运动;3分,重度局灶性神经功能缺损,大鼠行走时向一侧倾倒;4分,丧失行走能力。评分达到1~4分鉴定为造模成功[14-15]。
1.2.2 分组及给药。
除假手术组外,符合1~4分的合格大鼠根据随机数字表法分为模型组、山腊梅叶挥发油高、低剂量组(19.60、4.90 mg/kg,相当于生药量的14.0、3.5倍)和银杏叶片组(6.72 mg/kg,相当于成人临床用量的7倍),无造模仅分离血管的为假手术组。每组8只。各组大鼠均灌胃给药,灌胃体积为10 mL/kg,假手术组、模型组给予同等剂量的生理盐水,每天1次,28 d后开始水迷宫试验,水迷宫和旷场试验期间持续给药。
1.2.3 Morris水迷宫试验(Morris water maze,MWM)。
MWM系统由圆柱形水池、自动录像设备和分析系统构成。水池直径150 cm、深度50 cm,均分为4个象限且四周有视觉提示,池中设置一个直径9.5 cm、高度28.0 cm的透明圆柱形站台,并使其位于第三象限中间位置,其顶部没于水下1 cm处,水温(25±1)℃。给药28 d后,将各组大鼠进行MWM测试:第1~3天为训练期,每天进行2次定位练习,不记录成绩;第4天将各组大鼠随机从第一象限的入水点面向池壁放入水中,记录其逃避潜伏期和游泳路径;在第5天撤除站台,记录2 min 内大鼠在池内的游泳轨迹和跨越平台次数等指标。
1.2.4 旷场试验(open field test,OFT)。
MWM结束后,提前2 h 将大鼠放在OFT实验室适应环境。取一个5×5方格的旷场,随机将各组大鼠放入旷场方格内固定点,在旷场上方安置摄像机,记录大鼠5 min内运动情况,测定大鼠的水平活动得分和垂直活动得分等指标。每完成一次测试立即用75%乙醇擦拭敞箱,去除大鼠气味影响,待敞箱干燥后再进行下一次旷场试验。
1.2.5 大鼠血清SOD活性、MDA含量检测。
OFT结束后,实验大鼠在麻醉状态下腹主动脉取血,室温静置30 min使血液分层。3 000 r/min下离心10 min,分装血清,按试剂盒说明书操作,在550 nm的波长下测量各孔OD值即吸光度,绘制酶标曲线,计算样本浓度。
1.2.6 大脑组织HE染色。
取血后,快速断头取出大鼠脑组织,浸泡于4%多聚甲醛中固定48 h,按常规方法脱水包埋处理。将组织制作成5 μm厚度切片,常规HE染色,分别观察各组大鼠大脑海马组织CA1区病理改变。
1.3 统计学分析 采用SPSS 17.0软件进行t检验,结果以均数±标准差(±S)表示,P<0.05为差异有统计学意义。
2 结果与分析
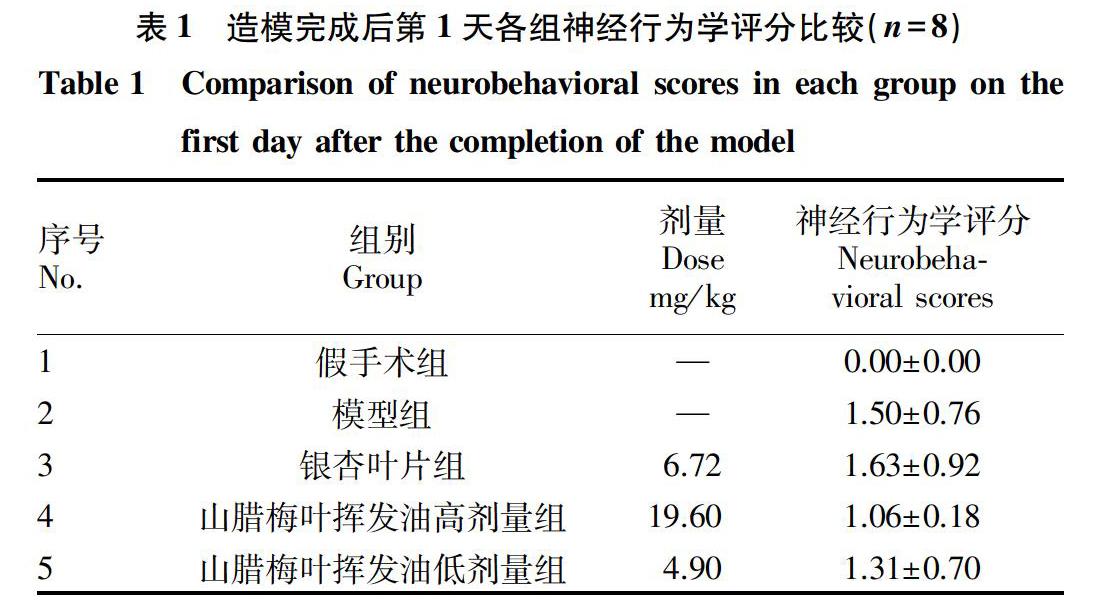
2.1 各组大鼠神经行为学评分比较 从表1可以看出,模型组、银杏叶片组、山腊梅叶挥发油高剂量组和山腊梅叶挥发油低剂量组4组大鼠的神经行为学评分均高于假手术组,差异具有统计学意义(P<0.05),提示大鼠VD模型复制成功;4组之间两两比较,差异均无统计学意义(P>0.05),表明以上4组分组均衡。综上所述,各组大鼠均可用于该试验研究。
2.2 水迷宫试验结果比较
各组大鼠MWM逃避潜伏期轨迹图见图1。5组大鼠逃避潜伏期比较(图2A),模型组大鼠逃避潜伏期较假手术组显著延长(P<0.01);与模型组比较,银杏叶片组、山腊梅叶挥发油高和低剂量组大鼠到达平台的潜伏期明显缩短(P<0.01)。5组大鼠穿越原平台次数比较(图2B),模型组大鼠穿越原平台次数明显少于假手术组(P<0.01);与模型组比较,银杏叶片组、山腊梅叶挥发油高和低剂量组大鼠穿越原平台次数明显增多(P<0.05),其中,山腊梅叶挥发油高剂量组差异极显著(P<0.01)。表明大鼠VD模型复制成功且山腊梅叶挥发油高、低剂量组均能改善VD大鼠的学习、记忆及认知能力。
2.3 各组大鼠旷场试验结果比较
5组大鼠旷场轨迹图见图3。对比各组垂直得分(图4A),模型组大鼠垂直得分明显低于假手术组(P<0.05);与模型组比较,銀杏叶片组、山腊梅叶挥发油高、低剂量组大鼠垂直得分明显增高(P<0.05),其中,山腊梅叶挥发油高、低剂量组差异极显著(P<0.01)。对比各组水平得分(图4B),模型组大鼠水平得分明显低于假手术组(P<0.01);与模型组比较,银杏叶片组、山腊梅叶挥发油高、低剂量组大鼠水平得分明显增高(P<0.05),其中,山腊梅叶挥发油高、低剂量组差异极显著(P<0.01)。表明大鼠VD模型复制成功且山腊梅叶挥发油高、低剂量组均能改善VD大鼠的探索运动能力。
2.4 各组大鼠血清SOD活性比较
从图5A可以看出,模型组大鼠血清中SOD活性明显低于假手术组(P<0.01),表明模型组大鼠氧自由基清除能力降低;与模型组比较,银杏叶片组、山腊梅叶挥发油高、低剂量组大鼠血清中SOD活性明显升高(P<0.05),表明山腊梅叶挥发油高、低剂量组均能提高VD大鼠氧自由基清除能力。
2.5 各组大鼠血清MDA含量比较
从图5B可以看出,模型组大鼠血清中MDA含量较假手术组显著升高(P<0.01);银杏叶片组、山腊梅叶挥发油高、低剂量组大鼠血清中MDA含量则明显低于模型组(P<0.05),表明山腊梅叶挥发油高、低剂量组均能降低VD大鼠脑组织脂质过氧化程度。
2.6 各组大鼠海马组织CA1区病理切片比较
常规HE染色后,在光学显微镜(×200)下观察海马CA1区,结果显示(图6),假手术组椎体细胞排列整齐,结构完整,细胞数目多,细胞核圆形居中清晰可见;模型组大鼠海马CA1区椎体细胞结构排列稀疏错杂,细胞数目较其他组明显减少,并且大部分细胞坏死,核仁模糊;银杏叶片组和山腊梅叶挥发油高剂量组大鼠海马CA1区神经元细胞较完整,排列较密集规整,细胞数目较多,有散在少量坏死神经元。山腊梅叶挥发油低剂量组较银杏叶片组和山腊梅叶挥发油高剂量组次之。表明山腊梅叶挥发油高、低剂量组均能减轻VD大鼠脑组织海马CA1区损伤程度。
3 讨论与结论
痴呆在老年慢性疾病中占有突出地位[16],VD是AD之后最常见的痴呆原因之一,约15%的病例是由VD引起[3]。VD是痴呆中唯一一种可药物预防的疾病[2],但目前尚无针对VD的正规治疗方法及特异性药物,故研发安全有效的治疗药物十分必要。
MDA是脂质过氧化反应的重要产物,能较好反映体内自由基程度,SOD是机体清除自由基的重要酶类之一,可间接反映机体抗氧化水平的强弱。脑部缺血缺氧,会引起细胞膜和细胞质的脂质过氧化,从而产生大量自由基,导致SOD被消耗,MDA大量产生[17-19]。氧化应激反应是引发脑血管损伤的主要原因之一,脑内自由基的大量堆积最终会导致脑细胞受损,加重VD病情[20]。故大鼠体内MDA、SOD的生成水平能间接反映VD的病情程度。此次试验结果表明,模型组大鼠有明显的氧化应激损伤,而治疗组在山腊梅叶挥发油的干预下减轻了氧化应激反应对机体的损伤,说明山腊梅叶挥发油能够通过减少氧化应激损伤而发挥VD的防治和治疗作用。
海马组织是储存记忆的重要部位,被认为是认知功能及记忆的关键结构,其中CA1是脑缺血缺氧最敏感的区域[21]。研究发现,血管性痴呆大鼠海马区神经元大量凋亡丢失,而海马缺血性损伤是VD的重要病理基础之一[22-24]。海马CA1区与空间探索和认知功能有着密切联系,故在该试验中主要以海马CA1区作为病理切片的观察对象。此次试验结果表明,模型组大鼠海马CA1区大量神经细胞坏死且排列稀疏错乱,治疗组在山腊梅叶挥发油的干预下减轻了海马CA1区神经细胞损伤程度,说明山腊梅叶挥发油对神经细胞有一定的保护作用。
氧化损伤被认为是VD发生的机制之一,该试验结果中山腊梅叶挥发油高、低剂量组均能提升VD大鼠脑组织内SOD活性,有效降低MDA含量,清除大鼠脑组织内氧自由基,减轻了氧化应激对中枢神经系统的损伤,一定程度上保护了大鼠脑海马CA1区的神经元细胞,从而改善大鼠的认知功能障碍,提高了VD大鼠学习、记忆、认知、探索运动等能力。这可能是山腊梅叶挥发油改善VD大鼠认知功能的机制之一,但进一步机制尚需深入研究,也为山腊梅叶的深度开发提供了研究方向和基础。
参考文献
[1]
韩鲜艳.血管性认知障碍的危险因素分析及其与脑血流动力学的相关性研究[D].南京:东南大学,2016.
[2] 孙惠萍,詹小兰,孙张弛.纳米脂质体包载辅酶Q10改善血管性痴呆小鼠学习记忆功能的实验研究[J].中国医院药学杂志,2020,40(4):406-411.
[3]OBRIEN J T,THOMAS A.Vascular dementia[J].Lancet,2015,386(10004):1698-1706.
[4] SINHA K,SUN C C,KAMARI R,et al.Current status and future prospects of pathophysiologybased neuroprotective drugs for the treatment of vascular dementia[J].Drug discovery today,2020,24(4):793-799.
[5] 李姝臻,钱海兵.民族药腊梅叶总黄酮对老年痴呆小鼠的影响[J].时珍国医国药,2014,25(2):330-331.
[6] 王玉婷,丁虹,邱春玉,等.山腊梅叶醇提物对慢性应激抑郁模型小鼠行为学及脑内单胺类神经递质的影响[J].中成药,2015,37(5):1087-1090.
[7] MOHAMMED SUR T,AKBABA H,HASSAN S A,et al.Neuropharmacological profile of Hypericum scabrum L.essential oil in rats[J].Journal of essential oil research,2020,32(1):79-87.
[8] SCUTERI D,ROMBOL L,MORRONE L A,et al.Neuropharmacology of the neuropsychiatric symptoms of dementia and role of pain:Essential oil of bergamot as a novel therapeutic approach[J].International journal of molecular science,2019,20(13):3327-3340.
[9] SATOU T,HANASHIMA Y,MIZUTANI I,et al.The effect of inhalation of essential oil from Rosmarinus officinalis on scopolamineinduced Alzheimer's type dementia model mice[J].Flavour and fragrance journal,2018,33(3):230-234.
[10] 蒋征奎,李晓,陈卓.石菖蒲挥发油对链脲佐菌素致大鼠痴呆模型学习记忆能力的影响[J].中国老年学杂志,2018,38(2):263-265.
[11] 王群,王拥军.啮齿类血管性痴呆动物模型[J].中国卒中杂志,2015,10(4):279-283.
[12] 梁慧英,廖琳,游国清,等.电针对血管性痴呆大鼠记忆力及海马BDNF、PSD-95蛋白表达的影响[J].中国康复医学杂志,2019,34(8):902-906,949.
[13] LONGA E Z,WEINSTEIN P R,CARLSON S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[14] 井杰.耳针对血管性痴呆大鼠认知功能改善的动态评价研究[D].合肥:安徽中医药大学,2014.
[15] 杨超,程红亮,薛晓婕,等.针刺对血管性痴呆大鼠TNF-α水平及神经行为学的影响[J].長春中医药大学学报,2018,34(4):645-648.
[16] KORCZYN A D,VAKHAPOVA V,GRINBER L T,et al.Vascular dementia[J].Journal of the neurological sciences,2012,322(1/2):2-10.
[17] 赵奕.通督调神针刺法治疗血管性痴呆的临床研究[D].广州:广州中医药大学,2013.
[18] 胡跃强,唐农,吴林,等.中医综合治疗方案配合治疗血管性痴呆110例临床观察[J].中医杂志,2015,56(6):487-491.
[19] 闫安,谢云亮.当归多糖对脑缺血再灌注损伤大鼠脑组织氧化应激水平及炎症因子表达的影响[J].中国实验方剂学杂志,2018,24(2):123-127.
[20] 李建瑞,马冉冉,樊新红,等.血清MDA、SOD、IL-1β、IFN-γ在血管性痴呆中的表达及与神经功能、预后的关系[J].海南医学,2020,31(4):433-437.
[21] 李晓晓.骨髓间充质干细胞移植对慢性脑缺血大鼠认知功能及海马区EphB2的影响[D].郑州:郑州大学,2013.
[22] 沈瑞乐.丁基苯酞对慢性脑缺血老龄大鼠海马区Chat的影响[D].郑州:郑州大学,2007.
[23] ZHAO T F,FU Y X,SUN H,et al.Ligustrazine suppresses neuron apoptosis via the Bax/Bcl2 and caspase3 pathway in PC12 cells and in rats with vascular dementia[J].IUBMB Life,2018,70(1):60-70.
[24] 陈婷婷,周雪,徐旖旎,等.天麻超微粉调控胆碱能系统改善血管性痴呆大鼠学习记忆能力[J].中国实验方剂学杂志,2020,26(15):26-32.
