针刺通过调节GABA-Gln 代谢对失眠大鼠症状的改善及对自发活动的影响
2021-06-17邢春蕊陈应奇刘英莲
邢春蕊,陈应奇,孙 曌,刘英莲
(1.海口市人民医院健康管理体检科, 海口 570802; 2.海南医学院中医学院,海口 570802)
随着社会快速发展,生活节奏不断加快以及工作压力的增加,现代人失眠发病率不断上升。 失眠是一种睡眠障碍类疾病,表现为入睡困难、睡眠维持时间短、早醒等[1]。 长时间失眠可导致一系列健康和心理问题,可诱发心脑疾病、糖尿病等,并可伴发抑郁症,严重影响患者身体健康和生活质量[2-3]。目前临床上治疗失眠主要有药物疗法和非药物疗法,长期使用药物治疗,易产生耐药性及药物成瘾性,存在较大隐患。 中医认为,睡眠是一个节律性生理过程,正常睡眠与人体阴阳及五脏气血密切相关,失眠主要由机体阴阳失衡、气血不足、脏腑功能失调及痰淤阻滞所致[4]。 针灸可以调虚实、平阴阳、通经脉,通过针刺特定穴位治疗失眠,经济、安全,且无副作用,被患者广泛接受[5]。 针刺治疗失眠临床疗效显著,但其具体作用机制报道较少,本研究采用针刺特定穴位,评价其对对失眠大鼠症状的改善及自发活动的影响,并对其具体作用机制进行探讨,以期为临床治疗失眠提供理论基础。
1 材料和方法
1.1 实验动物
45 只 SD 大鼠,雄性,SPF 级,7 周龄,体重(200±20)g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006],饲养于海南斯达制药有限公司实验动物中心[SYXK(琼)2016-0006],保持环境温度20℃~25℃,相对湿度45%~65%,适应性饲养1 周。 本研究经海南医学院中医学院动物伦理委员会批准(201803060027),实验过程给予人道关怀,符合3R 原则。
1.2 主要试剂与仪器
地西泮片(批准文号:国药准字H11020898,北京益民药业有限公司,每片2.5 mg);对氯苯丙氨酸(p-chlorophenylalanine, PCPA)、谷氨酸(glutamate,Glu)、γ-氨基丁酸(γ-aminobutyric acid, GABA)标准品(美国Sigma 公司);质谱级甲醇(美国Fisher 公司); 兔抗大鼠谷氨酸脱羧酶( glutamate decarboxylase, GAD) 多 抗、 谷 氨 酰 胺 合 成 酶(glutamine synthetase, GS)多抗[英国艾博抗(上海)贸易有限公司];HRP 标记的山羊抗兔IgG(北京中衫金桥生物技术有限);Synapt G2 超高效液相色谱-四级杆飞行时间串联质谱仪(美国Water 公司);实时荧光定量PCR 仪、Varioskan LUX 酶标仪(美国 Thermo Fisher 公司);DYY-6C 电泳仪(美国Bio-RAD 公司)。
1.3 实验方法
1.3.1 建模及分组
取35 只大鼠,采用腹腔注射PCPA 法[6]建立失眠大鼠模型,按400 mg/kg 大鼠体重称取PCPA,研磨成细粉,加入适量生理盐水,待研磨成泡沫状后,用生理盐水配制成100 mg/mL 的混悬液备用,临用前震荡调匀。 造模开始后,于每日上午 8 ∶00~10 ∶00腹腔注射PCPA,每天1 次,连续2 d。 模型判定标准[7]:第一次注射PCPA 后28~30 h,大鼠出现性情烦躁、昼夜节律紊乱、兴奋性和攻击性增强,大便灰白等表示造模成功。 造模成功大鼠30 只随机分为失眠组、针刺组、西药组,每组各10 只。 剩余10 只为对照组,腹腔注射等量生理盐水。
1.3.2 干预方法
造模成功后12 h 开始干预。 所有大鼠,每日上午8:00~10:00,进行治疗。
对照组和失眠组:仅抓取、固定,灌胃生理盐水。
针刺组:抓取固定大鼠后,取穴位置参照《实验针灸学》[8],将局部皮肤消毒,取针于双侧申脉、照海穴平刺,针有下沉感后捻转补泻,先补照海,后泻申脉,留针15 min。 灌胃生理盐水。
西药组:仅抓取、固定,根据人与大鼠体表面积计算给药量,灌胃地西泮0.9 mg/kg。
各组大鼠均每日干预1 次,连续7 d。
1.3.3 旷场实验检测大鼠自发活动
末次干预后24 h,旷场实验检测大鼠自发活动。采用100 cm×100 cm×50 cm 旷箱,底面分成25 个边长4 cm 的正方形,旷场上方放置摄像头,将大鼠放在正中格,观察大鼠5 min 水平活动情况和垂直活动情况,水平活动得分以爬行总格数计;垂直活动得分以直立次数计。 每只大鼠测试前使用乙醇喷洒旷箱消除上只气味。
1.3.4 戊巴比妥钠协同睡眠实验
通过预实验确定戊巴比妥钠引起100%大鼠睡眠的阈上剂量为45 mg/kg,以翻正反射消失1 min为睡眠,30 s 内翻转3 次为睡眠结束,记录大鼠睡眠潜伏期(从注射开始至大鼠入睡所需的时间)和睡眠持续时间。
1.3.5 RT-qPCR 法检测视交叉上核生物钟基因水平
末次干预12 h,麻醉大鼠,断头取脑,用生理盐水冲洗干净,分离下丘脑,取出视交叉上核,保存于液氮中。 取液氮中保存视交叉上核50 mg,冰上研磨,加入TRIzol 裂解液,裂解细胞,提取总RNA,检测RNA 的浓度和纯度,按照逆转录试剂盒说明书逆转录cDNA,进行实时荧光定量PCR。 反应体系:模板 cDNA 2 μL,2×qPCR Mix 10 μL,上下游引物各0.5 μL,加双蒸水至总体积 20 μL。 反应条件:95℃预变性10 min,95℃变性5 s,55℃退火30 s,72℃延伸30 s,45 个循环,以 β-actin 为内参基因,采用2-△△CT法计算目的基因相对表达水平。 引物序列:clock上游序列:5′-CTGACTATGCTAGCTAGCTAG-3′;下游序列:5′-AGTAGCTAGCTGATCGTAGCT-3′。per2 上游序列:5′-CGTGATGCTGCTAGCTGAC-3′;下游序 列:5′-ACATGTCCTAAGCTCAGCC-3′。β-actin上游序列:5′-ATAGATAGTGCACTGTACA-3′;下游序列:5′-ACTAAGTGCATGCATGCAT-3′。
1.3.6 高效液相检测下丘脑GABA、Glu 含量
处死大鼠后[9],分离下丘脑,用生理盐水冲洗干净,-80℃保存。 取0.1 g 下丘脑组织,加入甲醇进行匀浆,加入10 μL 内标静置30 min,去除蛋白。将组织匀浆2000 r/min 离心10 min,取上清,加入0.1 mL 甲醇,2000 r/min 离心 10 min,取上清。 采用高效液相色谱法检测脑中GABA、Glu 含量。 色谱条件:色谱柱为Acquity UPLC HSS PFP 柱(2.1 mm×100 mm,1.8 μm);柱温:30℃;流动相:含 0.1%甲酸的5 mmol/L 乙酸铵水溶液-甲醇溶液;流速为0.4 mL/min;进样量 2 μL。 质谱条件:电喷雾离子源,正离子模式,选择离子扫描(m/z) 104.072(GABA),203.035(Glu),离子源温度为120℃,脱溶剂温度为500℃,脱溶剂气体流速为800 mL/min。
1.3.7 Western blot 法检测下丘脑GAD、GS 蛋白表达水平
一部分下丘脑保存于液氮中。 取液氮保存下丘脑50 mg,加入RIPA 裂解液,冰上裂解,离心后去上清,用BCA 法蛋白定量,100℃水浴10 min,蛋白变性,蛋白上样,进行SDS-PAGE 电泳,电泳结束后将蛋白转至PVDF 膜,5%脱脂奶粉室温封闭2 h,加入 1 ∶2000 稀释的 GAD、GS、β-actin 一抗,4℃孵育过夜,TBST 洗膜,加入HRP 标记的山羊抗兔二抗(1 ∶5000),室温孵育2 h,TBST 洗膜,加入ECL 显影、定影,采用Image 图像软件分析蛋白灰度值,结果以目的蛋白/β-actin 表示。
1.4 统计学方法
采用SPSS 24.0 统计学软件分析数据,计量资料以平均数±标准差()表示,多样本计量资料比较采用单因素方差分析,两两样本比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况
对照组大鼠精神活泼,活动规律;失眠组出现明显失眠特征,表现为白天夜晚活动频繁、睡眠减少、精神疲惫,对外界声光刺激异常敏感;针刺组和西药组一般行为状态较失眠组有所改善,精神较好、活动较规律。
2.2 各组大鼠自发活动比较
水平运动和垂直运动得分比较,差异有统计学意义(P<0.001,P<0.001)。 与对照组比较,失眠组、针刺组和西药组水平运动和垂直运动得分降低(P<0.001,P< 0.01,P< 0.01,P< 0.001,P< 0.001,P<0.01);与模型组比较,针刺组和西药组水平运动和垂直运动得分升高(P<0.001,P<0.001,P<0.001,P<0.001);针刺组和西药组水平运动和垂直运动得分比较,差异无统计学意义(P>0.05,P>0.05)。 见表 1。
2.3 各组大鼠睡眠潜伏期和睡眠时间比较
各组大鼠睡眠潜伏期和睡眠时间组间比较,差异有统计学意义(P<0.001,P<0.001)。 与对照组比较,失眠组、针刺组和西药组大鼠睡眠潜伏期延长,睡眠时间缩短(P<0.001,P<0.001,P<0.01,P<0.001,P<0.05,P<0.05);与失眠组比较,针刺组和西药组大鼠睡眠潜伏期缩短,睡眠时间延长(P<0.001,P<0.001,P<0.01,P<0.001);针刺组和西药组大鼠睡眠潜伏期和睡眠时间比较,差异无统计学意义(P>0.05,P>0.05)。 见表2。
2.4 各组大鼠生物钟基因mRNA 水平比较
视交叉上核clock、per2 mRNA 相对表达量组间比较,差异有统计学意义(P<0.001,P<0.001)。 与对照组比较,失眠组、针刺组和西药组视交叉上核clock、per2 mRNA 相对表达量降低(P< 0.001,P<0.001,P<0.001,P<0.001,P<0.01,P<0.05);与失眠组比较,针刺组和西药组视交叉上核clock、per2 mRNA 相对表达量升高(P< 0.001,P< 0.001,P<0.001,P<0.001);针刺组和西药组视交叉上核clock、per2 mRNA 相对表达量比较,差异无统计学意义(P>0.05,P>0.05)。 见表 3。
2.5 各组大鼠下丘脑 Glu、GABA、Glu/GABA 水平比较
下丘脑Glu、GABA、Glu/GABA 水平组间比较,差异有统计学意义(P<0.001,P<0.001,P<0.001)。与对照组比较,失眠组、针刺组和西药组下丘脑Glu水平升高,GABA 水平降低,Glu/GABA 升高(P<0.001,P< 0.001,P< 0.001,P< 0.001,P< 0.05,P<0.05,P<0.001,P<0.05,P<0.05);与失眠组比较,针刺组和西药组下丘脑Glu 水平降低,GABA 水平升高,Glu/GABA 降低 (P< 0.001,P< 0.001,P<0.05,P<0.05,P<0.05,P<0.01);针刺组与西药组下丘脑 Glu、GABA、Glu/GABA 比较,差异无统计学意义(P>0.05,P>0.05)。 见表 4,图 1。
2.6 各组大鼠下丘脑GAD、GS 蛋白水平比较
下丘脑GAD、GS 蛋白相对表达量组间比较,差异有统计学意义(P<0.001,P<0.001)。 与对照组比较,失眠组、针刺组和西药组下丘脑GAD 蛋白相对表达量降低,GS 蛋白相对表达量升高(P<0.001,P<0.001,P<0.01,P<0.001,P<0.001,P<0.001);与失眠组比较,针刺组和西药组下丘脑GAD 蛋白相对表达量升高、GS 蛋白相对表达量降低(P<0.001,P<0.001,P<0.01,P<0.001);针刺组和西药组下丘脑GAD、GS 蛋白相对表达量比较,差异无统计学意义(P>0.05,P>0.05)。 见表 5,图 2。

表1 各组大鼠水平运动和垂直运动得分比较(¯x±s, n=10, min)Table 1 Comparison of the horizontal and vertical movement scores of rats in each group

表2 各组大鼠睡眠潜伏期和睡眠时间比较(¯x±s, n=10, min)Table 2 Comparison of sleep latency and sleep time of rats in each group

表3 各组大鼠生物种基因mRNA 水平比较(¯x±s, n=10)Table 3 Comparison of mRNA levels of biological species in each group of rats
3 讨论
睡眠是人体正常生理过程重要组成部分,具有解除疲劳和恢复体力作用,是维持身体健康和巩固记忆的重要环节。 中医认为,人体五脏阴平阳秘,气机升降条达,营卫运行通畅,方可心神得养、寐寤正常。 失眠发病机制复杂,导致失眠的病因包括情志失调、劳倦、体虚等多种因素,但其基本病机与阴阳失衡及脏腑功能失调扰乱心神有关,治疗失眠当补虚泻实,以平衡阴阳、调理气血、清心安神为主要原则[10-11]。 中医治疗失眠主要有中药方剂、针灸及推拿等方法,针灸疗法具有诸多优点,已成为临床治疗失眠的主要手段之一。 目前认为针刺具有特异性和非特异性生物学效应,而针刺的特异性生物学效应尚不十分明确,安慰/假针刺作为针刺对照研究,须不具备针刺特异性疗效,其合理性尚存在争议,故本研究未设置安慰/假针刺组,而将未针刺的失眠大鼠作为针刺组的对照,通过比较针刺组与失眠组相关指标变化,探讨针刺对失眠大鼠的改善作用。
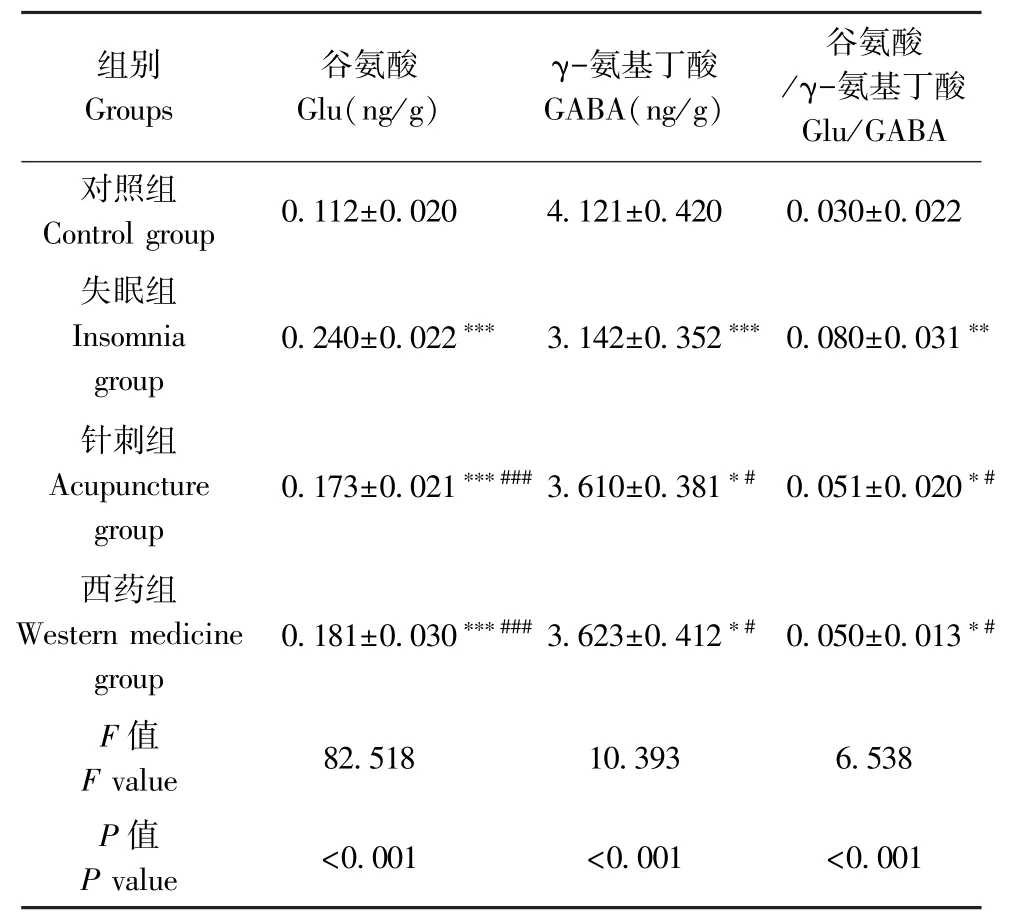
表4 各组大鼠下丘脑GABA、Glu、Glu/GABA水平比较(¯x±s, n=10)Table 4 Comparison of GABA, Glu and Glu/GABA levels in hypothalamus of rats in various groups

图1 下丘脑色谱图Figure 1 Chromatogram of hypothalamus
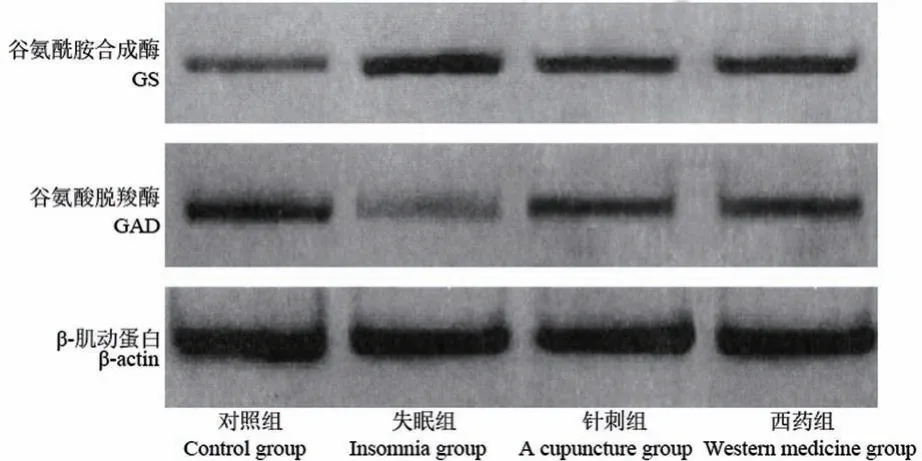
图2 下丘脑GAD、GS 蛋白表达Figure 2 GAD and GS protein expression levels in hypothalamus
睡眠-觉醒周期是人体最基本的生物节律,在一定年龄阶段,人类睡眠-觉醒周期相对恒定,失眠患者由于存在睡眠障碍,睡眠相对不足且觉醒时间相对延长,导致睡眠-觉醒周期发生紊乱。clock基因是重要的生物钟基因,发生突变可导致神经高度兴奋引起睡眠减少。per2 是哺乳动物体内重要的节律因子,其表达与长周期有关,该基因突变可引起睡眠时间减少,觉醒时间延长。 临床研究显示,针刺对机体昼夜节律具有一定调整作用,失眠患者通过针灸治疗,睡眠时间相对延长[12]。 动物模型实验也证实针灸可恢复倒相活动大鼠的自发活动节律,使其失眠症状得到一定程度恢复[13]。 中医认为,失眠与阴阳跷脉失调、卫气运行不畅有关,“申脉”、“照海”均与跷脉相交,申脉通阳跷脉,照海通阴跷脉,阴阳跷脉分别于照海、申脉而出,终会于目,司目之开合。 针刺二穴,阴阳相应,跷脉功能得以恢复,从而调节失眠[14]。 本研究基于跷脉理论,通过针刺申脉、照海二穴位,调和阴阳,促进跷脉功能恢复,结果显示针刺组较失眠组大鼠自发活动改善明显,戊巴比妥钠协同镇静实验显示针刺治疗后睡眠潜伏期明显缩短,睡眠时间明显延长,同时生物钟基因clock和per2 表达明显升高,与西药改善大鼠失眠效果相当,提示针刺对失眠大鼠具有一定改善作用,可调节其自发活动节律,促使紊乱的睡觉-觉醒周期得以恢复。
Glu、GABA 分别是是哺乳动物中枢神经系统最重要的兴奋性/抑制性神经递质,其代谢主要通过Glu/GABA-谷氨酰胺(glutamine,Gln)代谢环路进行循环[15]。 Glu 不能透过血脑屏障,通过三羧酸循环合成Gln,参与神经调节,Glu 可通过Glu-Gln 循环灭活,也可通过脱羧生成GABA,共同维持睡眠-觉醒周期。 GAD 是Glu/GABA-Gln 代谢环路中将Glu转化为GABA 的主要代谢酶,GAD 表达降低,引起Glu 向GABA 转化出现障碍;GS 负责将Glu 转化为Gln,维持不同神经元之间Glu 的突触传递。 Glu/GABA 代谢平衡是维持大脑正常生理活动的基础,Glu 与GABA 神经兴奋/抑制功能失调,Glu 过度积累易引起兴奋性神经毒性,与神经疾病疾病密切相关[16]。 研究显示,失眠患者体内 Glu/GABA 失衡,失眠动物模型体内Glu、GABA 含量较正常组明显改变[17-18]。 本研究失眠组大鼠Glu 含量较正常组明显升高,GABA 含量降低,Glu/GABA 升高,提示失眠大鼠体内存在Glu/GABA 失衡现象;经针刺治疗后,Glu/GABA 有一定程度恢复,且GAD 表达降低,GS 表达升高,提示针刺对失眠大鼠的改善作用可能是通过调节Glu/GABA-Gln 代谢环路中GAD 和GS蛋白表达,从而恢复Glu/GABA-Gln 代谢平衡发挥作用。
综上所述,针刺对失眠大鼠具有一定改善作用,其可能是通过调节GAD 和GS 蛋白表达,恢复Glu/GABA-Gln 代谢平衡,从而改善睡眠状态,为临床治疗失眠提供一定理论基础。
