蒙药香青兰总黄酮对帕金森病模型小鼠的神经保护作用
2021-06-17周丽丽莫超然刘心朗孙毅红贾建新杨占君
周丽丽,莫超然,刘心朗,孙毅红,贾建新,杨占君
(内蒙古科技大学包头医学院,内蒙古包头 014040)
帕金森病(Parkinson’s disease, PD)是常见的神经退行性疾病之一,临床表现为静止性震颤、运动迟缓、肌强直和姿势步态异常[1],其主要病理学特征为黑质致密部和纹状体多巴胺能神经元渐进性丢失和路易小体的形成[2]。 目前,针对PD 患者的主要治疗手段均可改善预后,但其确切地发生发展机制尚不清楚[3-4]。
氧化应激被认为是PD 发病机制中的一个重要因素[5]。 在正常情况下,机体存在氧自由基清除系统,脑组织内主要有超氧化物歧化酶(Superoxide Dismutase, SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase, GSH-Px)等保护机体免遭氧自由基的损伤。 脂质降解的毒性产物丙二醛(Malondialdehyde,MDA)的含量能够体现机体清除自由基的作用。 帕金森病患者多巴胺能神经元变性的基本形式是细胞凋亡[6],许多基因及其产物可以参与多巴胺能神经元变性的凋亡过程。
蒙药香青兰(Dracocephalum moldavica L.)是蒙古族习用数百年的天然药材,香青兰中的成分极其复杂,现已测得含有微量元素、挥发油、氨基酸、有机酸、多糖类、黄酮、甾体、萜类等[7]。 其中,黄酮类化合物含量丰富,且具有较强的抗氧化性[8]。 前期研究证明, 香青兰总黄酮( total flavones of Dracocephalum moldavica L., TFDM)在脑缺血再灌注损伤中具有抗氧化和抑制细胞凋亡的作用[9-10],但其是否与PD 发病相关仍未见明确报道。 因此,本实验研究TFDM 对PD 模型小鼠的运动功能、多巴胺能神经元丢失与细胞凋亡的影响。
1 材料和方法
1.1 实验动物
40 只 8 周龄 SPF 级雄性 C517BL/6J 小鼠(22±2)g,购自北京维通利华有限公司[SCXK(京)2019-0010]。 实验动物均饲养在内蒙古科技大学包头医学院SPF 级动物房中[SYXK(京)2017-0033],室温(22 ± 1)℃,昼夜循环 12 h,小鼠可自由进食、饮水。 动物房所有动物实验遵循我国《实验动物护理和使用指南》和“3R”原则执行。 动物实验由内蒙古科技大学包头医学院医学生物学研究所动物实验伦理审查委员会通过(2016-033)。
1.2 主要试剂与仪器
1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine,MPTP)购自美国sigma 公司;香青兰植物由内蒙古科技大学包头医学院杨占君教授鉴定;TFDM 由包头医学院公共卫生学院提供;SOD、MDA、GSH-Px 试剂盒购自武汉新启迪生物科技有限公司;β-actin、Caspase-3、Bcl-2、Bax、酪氨酸羟化酶(tyrosine hydroxylase,TH)抗体购自Affinity Biosciences.;组织裂解液、蛋白酶抑制剂、IgG-HRP 抗体购自北京索莱宝生物技术有限公司;免疫组化试剂盒、ECL 化学发光试剂盒购自北京中杉金桥科技有限公司;BCA 蛋白定量试剂盒购自Thermo;转棒式疲劳仪(型号:XR1514-RZPM)购自上海欣软信息科技有限公司。
1.3 实验方法
1.3.1 TFDM 的提取和含量测定
采集香青兰植物的地上部分研磨成粗粉,取300 g 植物粗粉放入三颈烧瓶,加入1500 mL 65%乙醇,浸泡过夜。 第2 天,将三颈烧瓶放入70℃水浴、当烧瓶内温度达到60℃时,连续搅拌2 h。 然后通过真空浓缩过滤得到香青兰总黄酮醇溶液,利用旋转蒸发仪减压蒸馏蒸发掉乙醇溶液和水,最终得到香青兰总黄酮,经过紫外分光光度计测量总黄酮含量。
1.3.2 动物分组及给药
40 只小鼠随机分为正常对照组(8 只)与模型组(32 只),模型组小鼠腹腔注射 30 mg/(kg·d)MPTP,正常对照组(normal control)注射等体积生理盐水,连续7 d。 继续饲养,将模型组小鼠随机分为模型组(model)、TFDM 低(TFDM-L,10 mg/kg)、中(TFDM-M,20 mg/kg)、高(TFDM-H,30 mg/kg)给药治疗组,每天每组小鼠给与相应药物灌胃处理;正常对照组和模型组均给与等体积生理盐水灌胃处理,连续1 个月。
1.3.3 行为学评价实验
(1)转棒实验
将小鼠置于转棒式疲劳仪上,给予30 s 的适应时间,然后启动转棒式疲劳仪,使转棒转速在30 s内达到26 r/min,记录小鼠第一次从棒上跌落的时间(潜伏期)。 每只小鼠测3 次,每次间隔30 min,取平均值。
(2)爬杆实验
取50 cm 长,1 cm 粗铁杆作为爬杆,爬杆上缠绕医用胶布防止打滑,各组小鼠在实验前1 周每天一次训练,于最后一次给药治疗结束进行检测。 检测时,将小鼠放置于爬杆上端,以小鼠双前上肢接触杆底平台认定为爬完全程,记录爬完全长所需时间,每只爬杆3 次,取平均值。
1.3.4 组织取材
麻醉小鼠后,快速取出完整的脑组织,一部分在冰上取黑质区域(结合小鼠脑组织图谱,黑质区位于前囟 2.46 ~4.04 mm,中线外 0.24 ~1.34 mm[11])于-80℃保存待用;一部分于4%多聚甲醛固定浸泡过夜。 采血针腹主动脉取血,全血静止30 min、4000 r/min,离心 15 min,取上清于-80℃保存待用。
1.3.5 ELISA 检测
取出-80℃血清,分别按照SOD、MDA、GSH-Px试剂盒说明进行操作,每组血清全部按照1:10 稀释进行检测。
1.3.6 免疫组织化学实验
将固定好的脑组织进行石蜡包埋切片,切片进行二甲苯脱蜡、梯度乙醇水化后、抗原修复10 min,内源性过氧化物酶反应15 min,PBS 洗3 次× 10 min,然后滴加一抗(TH 1 ∶1000,Caspase-3 1 ∶500,Bcl-2 1 ∶500, Bax 1 ∶500)4℃ 孵育过夜。 第二天,滴加二抗(IgG 1 ∶1000)室温孵育 20 min,PBS 洗 3 次×10 min,DAB 显色3 min,苏木素复染30 s,乙醇脱水、二甲苯透明,中性树胶封片。 在光学显微镜下观察并采集图像,利用Image J 软件分析统计阳性细胞数目。
1.3.7 Western blot 检测
取出 - 80℃脑组织加入组织裂解液研磨、超声破碎,再加入蛋白酶抑制剂冰上反应30 min,12000 r/min 4℃低温离心15 min,取上清,BCA 法测定蛋白浓度。 电泳100 V 2.5 h,转膜400 mA 2 h,5% 脱脂奶粉封闭 1.5 h,孵育一抗(β-actin 1 ∶1000、TH 1 ∶1000、Caspase-3 1 ∶1000、Bcl-2 1 ∶1000、Bax 1 ∶1000)4℃过夜。 第二天,TBST 洗涤 3 次×10 min,孵育二抗(IgG 1 ∶3000)2 h,TBST 洗涤 3 次×10 min,ECL 发光液显影并采集蛋白条带,通过 Image J 软件处理分析统计。
1.4 统计学方法
2 结果
2.1 香青兰总黄酮化合物的分离提取和含量测定
经旋转蒸发仪减压蒸馏得到粉末状的香青兰总黄酮化合物提取物,电子天平称量为50.5 g;利用紫外分光光度计测量得到总黄酮含量为322.8 mg/g。
2.2 TFDM 对PD 模型小鼠运动功能的影响
在转棒实验中,与正常对照组相比,模型组小鼠下落潜伏期显著降低(P<0.01),与模型组相比,TFDM 中、高剂量治疗组下落潜伏期显著增高(P<0.05),低剂量治疗组没有显著变化(P>0.05),见图1a;在爬杆实验中,与正常对照组相比,模型组PD 小鼠的爬杆时间明显增高(P<0.05),与模型组相比,TFDM 中、高剂量治疗组爬杆时间显著降低(P<0.05),低剂量治疗组没有显著变化(P>0.05),见图1b。
2.3 TFDM 对PD 小鼠血清中氧化应激因子的影响
ELISA 检测结果显示,与正常对照组相比,模型组血清中 MDA 的含量显著升高(P<0.01),同时GSH-Px、SOD 的表达显著降低(P<0.05);与模型组相比,TFDM 各治疗组MDA 的含量明显降低(P<0.05),GSH-Px 的表达明显升高(P<0.05),而中、高剂量治疗组SOD 的表达明显升高(P<0.05),低剂量治疗组SOD 的表达没有明显变化(P>0.05),见表1。
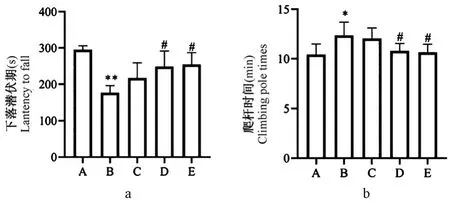
图1 TFDM 对帕金森模型小鼠运动功能影响(n=8,¯x ± s)Note. A, Normal control group. B, Model group. C, TFDM-L. D,TFDM-M. E, TFDM-H. a, Rota Rod test. b, Climbing Pole test.Compared with control group, *P<0.05, **P <0.01. Compared with model group, #P<0.05.Figure 1 Effects of TFDM on motor function in Parkinson’s model mice in each group
表1 TFDM 对PD 小鼠血清中氧化应激因子的影响( ,n=8)Table 1 Effects of TFDM on oxidative stress factors in serum of PD mice

表1 TFDM 对PD 小鼠血清中氧化应激因子的影响( ,n=8)Table 1 Effects of TFDM on oxidative stress factors in serum of PD mice
注:A:正常对照组;B:模型组;C:低剂量组;D:中剂量组;E:高剂量组。 与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05。Note. A,Normal control group. B,Model group. C,TFDM-L. D,TFDMM. E, TFDM-H. Compared with control group, *P<0.05, **P<0.01.Compared with model group, #P<0.05.
组别Groups SOD (U/mL) GSH-Px (mIU/mL) MDA (nmol/mL)A 85.03 ± 4.46 20.07 ± 0.62 1.14 ± 0.03 B 57.84 ± 3.59* 14.67 ± 0.49* 2.70 ± 0.33**C 62.72 ± 2.62 19.06 ± 0.62# 2.03 ± 0.16#D 66.89 ± 4.10# 18.38 ± 0.60# 1.67 ± 0.12#E 70.43 ± 3.66# 17.17 ± 0.58# 1.51 ± 0.11#
2.4 TFDM 对 TH 和凋亡相关蛋白 Caspase-3、Bcl-2、Bax 表达的影响
2.4.1 免疫组织化学
在细胞质可见 TH、Caspase-3、Bcl-2 和 Bax 蛋白的阳性表达,免疫组化图像上细胞的胞核显色为蓝色,胞质显色为深棕黄色,确定为蛋白阳性表达细胞。与正常对照组相比,模型组TH、Bcl-2 蛋白表达水平显著降低,阳性细胞数目明显减少(P<0.05),同时Caspase-3、Bax 表达水平显著增加,阳性细胞数目明显增加(P<0.05);与模型组相比,TFDM 中、高剂量治疗组TH、Bcl-2 蛋白表达水平明显上调,阳性细胞数目增加(P<0.05),同时 Caspase-3、Bax 表达水平明显下降,阳性细胞数目减少(P<0.05),低剂量治疗组没有明显变化(P>0.05),见图 2a、2b、2c、2d。

图 2 TFDM 对 TH、Caspase-3、Bcl-2 和 Bax阳性细胞表达的影响( ,n=4)Note. A, Normal control group. B, Model group. C, TFDM-L. D,TFDM-M. E, TFDM-H. a, b, c and d respectively represent the statistical results of TH, Caspase-3, Bcl-2, Bax immunohistochemical images and positive cells statistics The arrow positive cells that indicate protein expression. Compared with control group, *P<0.05. Compared with model group, #P<0.05.Figure 2 TFDM effects on TH, Caspase-3,Bcl-2 and Bax positive cells expression
2.4.2 Western bolt
与正常对照组相比,模型组TH、Bcl-2、Bcl-2/Bax蛋白表达水平显著降低(P<0.05),同时Caspase-3、Bax 表达水平显著增加(P<0.05);与模型组相比,TFDM 中、高剂量治疗组 TH、Bcl-2、Bcl-2/Bax 蛋白表达水平明显上调(P<0.05),同时 Caspase-3、Bax 表达水平明显下降(P<0.05),低剂量治疗组没有明显变化(P>0.05),见图 3b、3c、3d、3e、3f。
3 讨论
帕金森病已成为继阿尔兹海默症后第二常见的中老年神经退行性疾病,而且发病率随着年龄的增长而增加[12]。 目前,针对PD 患者的治疗药物主要分为消耗多巴胺或模拟多巴胺受体效应的药物[13],而这类药物只能改善临床运动症状,不能阻止或逆转疾病进展,长期使用还会导致严重的运动并发症。 因此,降低不良反应,寻找新的、行之有效的治疗策略是目前研究的重点。
香青兰,又名青兰、摩眼子、枝子花等,属唇形科青兰属植物,性味辛苦凉,具有清热燥湿、凉肝止血的功效。 有研究显示TFDM 具有较强的抗炎性、抗氧化作用,并对低氧环境所致的肺损伤具有保护作用[14-15]。 TFDM 可能通过抑制细胞的凋亡和自噬对心肌细胞缺氧复氧损伤有显著保护作用[16-17]。TFDM 还具有减缓动脉粥样硬化的作用[18]。
MPTP 因其高度的脂溶性可进入脑内并在单胺氧化酶B 的作用下转化为1-甲基-4-苯基吡啶(MPP+),低浓度可诱发脑黑质细胞凋亡、多巴胺能神经元渐进性丢失,诱导动物PD 的发生发展[19-20]。大量研究显示,PD 模型小鼠的运动功能异常且多巴胺能神经元数目减少[21-22]。 爬杆实验和转棒实验主要检测PD 小鼠的运动协调能力[21]。 本实验研究结果显示,MPTP 制备的PD 模型小鼠多巴胺能神经元减少,多巴胺分泌减少,导致兴奋性神经递质乙酰胆碱功能亢进,引起肌张力持续增高、运动迟缓,导致小鼠的运动功能发生障碍,证明PD 的模型建立成功。 经过TFDM 治疗小鼠的爬杆时间缩短、下落潜伏期增加,证明小鼠的运动速度增加,运动协调能力提高,说明香青兰总黄酮能够改善PD小鼠的运动功能。 免疫组化结果显示TFDM 治疗小鼠的多巴胺能神经元表达明显增多,证明香青兰总黄酮可以减缓多巴胺能神经元的渐进性丢失,说明香青兰总黄酮对PD 有神经保护作用。
正常生理条件下,脑组织内的活性氧(ROS)可被机体抗氧化酶和抗氧化物质清除。 当PD 发生时,随抗氧化物质含量下降,神经元清除自由基能力降低,从而引起黑质脂质过氧化增强,MDA 含量增加[23]。 也有学者证实帕金森病患者黑质部GSH水平下降40%[24],SOD 活性也有所降低。 本研究结果显示,TFDM 可以减轻氧化应激的损伤,使MDA含量降低的同时提高SOD、GSH-Px 的活性。
凋亡是由多种分子调控的复杂过程,这些分子包括 Bax、Caspase-3,或者是 Bcl-2 和 Bcl-xl 等。Caspase 家族是细胞凋亡过程中的关键元件,当细胞接受凋亡刺激时激活Caspase-3,进而诱导细胞发生凋亡,凋亡开始即呈级联放大效应。 Bcl-2 家族是细胞凋亡最重要的调节因子之一[25]。 Bcl-2 可以抗细胞凋亡,Bax 可以促细胞凋亡[26],在调控条件下,Bcl-2 家族中抗凋亡和促凋亡蛋白的表达相对稳定[27]。 两蛋白间的比例决定是否发生细胞凋亡[28],当Bcl-2/Bax 比值较低则细胞凋亡较重,反之则细胞凋亡较轻[29]。 本研究结果显示,TFDM 可以通过降低Caspase-3、Bax 蛋白表达水平的同时增加Bcl-2 蛋白的表达水平来抑制细胞凋亡对PD 小鼠的影响。 由于细胞凋亡是一个复杂的过程,TFDM具体通过哪个环节对PD 小鼠起到神经保护作用还不明确,还有待进一步的研究。
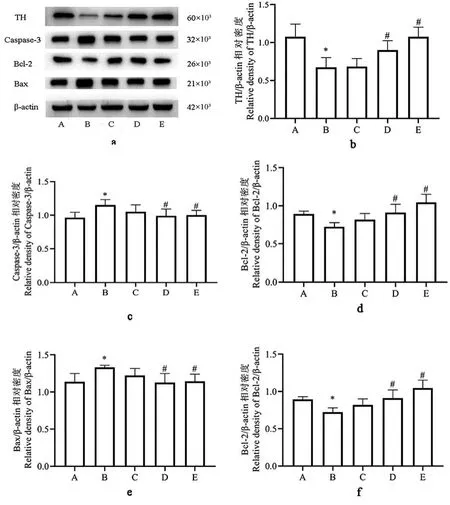
图 3 TFDM 对 TH、Caspase-3、Bcl-2、Bax 和 Bcl-2/Bax蛋白表达的影响( ,n=4)Note. A, Normal control group. B, Model group. C, TFDM-L. D,TFDM-M. E, TFDM-H. a, Group protein Western blot image bands. b, c, d, e, and f, The statistical results of TH, Caspase-3, Bcl-2, Bax and Bcl-2/Bax protein expression level. Compared with control group, *P <0.05. Compared with model group,#P<0.05.Figure 3 TFDM effects on TH, Caspase-3, Bcl-2,Bax and Bcl-2/Bax protein expression
综上所述,TFDM 对PD 模型小鼠具有改善运动功能障碍和减少多巴胺能神经元丢失的作用,并可能通过抑制Caspase-3 蛋白活性、上调Bcl-2 和下调Bax 蛋白表达在PD 模型小鼠发挥神经保护作用。
