泡桐花多糖的体内外抗氧化活性
2021-06-17陈晓兰圣志存陈海峰贾纪萍冒玉娟
陈晓兰,圣志存,陈海峰,贾纪萍,李 冉,雒 丹,陈 未,冒玉娟
(江苏农牧科技职业学院,江苏泰州 225300)
泡桐(Paulownia fortunei),又名白花泡桐、大果泡桐,空桐木等,隶属玄参科(Scrophulariaceae)泡桐属(Paulownia),属于落叶乔木,广泛分布我国各地,其药用价值从古代就有记载[1],且叶、花、果实均可作药用,民间常煎煮用于治疗肺热咳嗽、疖肿、疮癣等病证。泡桐花,泡桐植物常作药用部位之一,春季花开时采收,晒干或鲜用。现代医药研究表明,泡桐花含有丰富的多糖、黄酮、生物碱、皂苷、有机酸、挥发油、酚类及鞣质类成分等有益人体的生物活性物质[2],具有抗炎[3]、抑菌[4]、调节免疫[5]等作用。当前,关于泡桐花的营养药用价值,国内外众多研究者做了相关深入研究,但大多集中于泡桐花的化学或营养成分[4,6-7]、黄酮的提取工艺[8]或含量测定[9];而有关生物活性方面,免疫活性方面研究则较多[6,10-11],鲜见有关泡桐花多糖及其抗氧化活性方面的研究报道。
多糖是多羟基醛和多羟基酮通过糖苷键连接的高分子聚合物,具有抗氧化、调节免疫等诸多有益生理活性,是功能食品基料的主要来源之一[12]。因此有必要对泡桐花多糖体外、体内的抗氧化功能进行全面系统研究。
本研究以泡桐花多糖为研究对象,通过超氧阴离子、羟自由基清除能力以及抗H2O2氧化溶血率测定评价体外抗氧化活性。以小鼠为试验动物,通过体内抗氧化活性试验,测定泡桐花多糖对小鼠血清及心、肝、肾、回肠组织器官的SOD、GSH、MDA含量以及T-AOC水平的影响,以期为泡桐花资源深层探索提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
泡桐花 扬中牧乐药业有限公司提供;邻苯三酚(AR)、邻二氮菲(AR) 北京索莱宝科技有限公司;Vc(AR,≥99%)、硫酸亚铁(AR) 国药集团化学试剂有限公司;SOD、GSH、T-AOC、MDA ELISA试剂盒 合肥莱尔生物科技有限公司;ICR小鼠(体重18~22 g) 扬州大学比较医学中心,动物生产许可证号:SCXK(苏)2012-0004。
T-500B高速多功能粉碎机 永康市哈瑞工贸有限公司;BSA223S-CW电子天平 德国赛多利斯公司;UV-2400紫外可见分光光度计 北京世纪科信科学仪器有限公司;Anthos 2010酶标仪 上海鼎谦生物科技有限公司。
1.2 实验方法
1.2.1 体外抗氧化试验
1.2.1.1 泡桐花多糖的提取与溶液制备 晒干泡桐花,机械粉碎过60目标准筛。取适量粉末样品,按料液比1:30(g/mL),70 ℃水浴提取2 h。反应结束,过滤去渣,滤液真空减压浓缩之反应前体积的十分之一,加入3倍体积的95%乙醇,醇沉过夜,离心得沉淀,即为粗多糖[13]。沉淀蒸馏水复溶,苯酚硫酸法[14]测定多糖含量(≥70%),稀释配制成0.5、1.0、2.0 mg/mL的多糖溶液,待测。
1.2.1.2 超氧阴离子自由基清除能力测定 超氧阴离子自由基清除测定采用邻苯三酚自氧化法[15]。
1.2.1.3 羟基自由基清除能力测定 羟基自由基清除测定采用邻二氮菲-Fe2+氧化法[16]。
1.2.1.4 抗H2O2氧化溶血率测定 ICR小鼠眼球采血,肝素抗凝,4 ℃,3000 r/min离心,收集红细胞,生理盐水洗涤3次,制成0.5%红细胞悬浮液。取试管48支,分为泡桐花多糖样品组、空白组和本底对照组以及Vc对照组。取0.5%红细胞悬液4.0 mL,依次加入不同浓度泡桐花多糖4.0 mL,50 mmol/LH2O22.0 mL,混匀,37 ℃水浴反应1 h,加生理盐水16 mL,3000 r/min离心5 min,取上清液紫外分光光度计测定415 nm处吸光度值,计算氧化溶血抑制率。
氧化溶血抑制率 = [A0- (A1- A2)] /A0× 100
式中:A0表示空白对照组吸光度(生理盐水代替泡桐花提取液),A1表示样品组吸光度;A2表示样品本底吸光度(蒸馏水代替红细胞悬浮液)。
1.2.2 体内抗氧化试验 将50只ICR小鼠预饲养7 d后随机分成5组,即空白对照(BC)组、泡桐花多糖低(PFFP-L)、中(PFFP-M)、高剂量(PFFP-H)组、Vc对照组,每组10只,雌雄分开饲养。其中,泡桐花多糖组小鼠低、中、高剂量依据前期免疫预实验,控制每天灌胃剂量分别为5、10、20 mg/mL泡桐花多糖溶液0.2 mL,等量体积蒸馏水、Vc(1 mg/mL)分别作为空白和阳性对照。实验期间,小鼠自由摄食和饮水,灌胃30 d后,禁食12 h,眼球采血,立即37 ℃静置 2 h,4 ℃过夜,于4 ℃,3000 r/min离心10 min,分离血清,待测。采血后的小鼠处死解剖,取出心、肝、肾、回肠于预冷的生理盐水漂洗,除去血液,滤纸吸干表面水分,各组织器官与生理盐水按1:9的比例低温匀浆,制备匀浆液,3000 r/min 离心10 min,留上清液,待测。
1.2.3 指标测定 a.体重变化:分别于给药后的0、7、14、21和28 d称重,称重前禁食12 h。比较各组体重的变化。b.抗氧化活性测定:以各组小鼠血清、心脏、肝脏、肾脏、回肠为试验样品,严格按照试剂盒说明书进行SOD、GSH、MDA含量以及T-AOC指标测定。
1.3 数据处理
所有测定结果均重复3次,以平均值±标准差表示;采用SPSS 21.0 ANOVA对数据进行方差分析,Duncan法进行多重比较,以P<0.05 表示有统计学差异。
2 结果与讨论
2.1 体外抗氧化试验
不同浓度泡桐花多糖溶液体外抗氧化指标测定如表1所示。由表1可知,不同剂量的泡桐花多糖溶液对超氧阴离子、羟基自由基清除率以及抗H2O2氧化溶血率指标均呈剂量依赖型。泡桐花多糖浓度为0.5 mg/mL时,超氧阴离子、羟基自由基清除率分别为54.36%、74.62%,均大于半数效应50%;多糖浓度为1 mg/mL时,羟基自由基清除率超过Vc对照组(1 mg/mL);多糖浓度为2 mg/mL时,抗H2O2氧化溶血率超过阳性对照组Vc(1 mg/mL)。自由基学说认为生物体的衰老和各种疾病的过程是机体的组织细胞不断产生的自由基积累结果,自由基可以引起细胞中的多种物质发生氧化,损害生物膜,还能够使蛋白质、核酸等大分子交联,影响其正常功能[17]。目前已经证实,清除多余自由基的能力是机体内本身所具备的,正常情况下,人体内存在过氧化氢酶(CAT)、SOD、谷胱甘肽过氧化物酶(GSH-Px)等一些抗氧化酶类和抗氧化剂,使自由基的生成和清除处于动态平衡[18-19];但人体随着年龄的增长或处于高负荷运动等不利环境条件时,会引起过多的自由基生成,从而导致自由基形成与消除失衡,使机体组织受损[20]。研究表明,适当补充抗氧化剂可以减缓自由基氧化机体带来的危害,因此, 寻找有效清除自由基的抗氧化食药资源对人类健康具有重要意义。泡桐花多糖部分体外抗氧化指标测定结果与Vc相当,可能预示泡桐花多糖是一种极具价值的亟待开发天然抗氧化剂,值得进一步探索利用。

表1 泡桐花多糖体外抗氧化指标测定Table 1 Determination of antioxidant indexs in vitro of Paulownia fortune flower polysaccharide
2.2 体内抗氧化试验
2.2.1 泡桐花多糖对小鼠体重的影响 因雌雄小鼠体重和生长速度有差异,因此雌雄小鼠进行分开统计。泡桐花多糖对小鼠体重的影响结果如表2、表3所示。结果表明,雌雄小鼠给药前及给药后的4个时间点,各给药组之间小鼠体重均无显著性差异(P>0.05),因此认为泡桐花多糖样品对小鼠体质量无影响。

表2 泡桐花多糖对雌性小鼠体重的影响(n=5)Table 2 Effect of Paulownia fortune flower polysaccharide on the weights of female mice (n=5)

表3 泡桐花多糖对雄性小鼠体重的影响(n=5)Table 3 Effect of Paulownia fortune flower polysaccharide on the weights of male mice (n=5)
2.2.2 泡桐花多糖对小鼠血清和组织器官中SOD的影响 SOD是需氧生物体内上千种酶中唯一以氧自由基为底物的酶,对底物有绝对的专一性,它能催化H+和O2相结合生成H2O2,因而SOD含量水平的高低可作为机体评价抗氧化能力的标志[21-22]。如图1所示,与空白组对比可知,泡桐花多糖中、高剂量组能显著增加血清SOD含量(P<0.05),分别增加了226.63%、149.07%,且中、高剂量酶含量接近Vc;低剂量则与空白组无显著差异(P>0.05)且显著低于Vc对照组(P<0.05)。组织器官SOD含量,与空白组对比,泡桐花多糖低剂量组SOD含量普遍略高于空白组,但仅心脏有显著差异(P<0.05)。中、高剂量组心脏、回肠组织器官含量均显著增加(P<0.05);中剂量组分别增加了42.38%、68.32%;高剂量组分别增加了99.05%、83.59%(P<0.05);肝脏、肾脏含量则差异变化不显著(P>0.05)。
2.2.3 泡桐花多糖对小鼠血清和组织器官GSH的影响GSH是机体内最重要的非酶性过氧化物,可以保护细胞中蛋白质分子的巯基(-SH)免遭氧化,同时具有清除活性氧、H2O2、LOOH等自由基作用,因而GSH量的多少是衡量机体抗氧化能力大小的重要因素[23-24]。如图2所示,与空白组对比,泡桐花多糖低、中、高剂量组均能增加血清中GSH含量,且呈剂量依赖型,但均低于Vc对照组。组织器官GSH含量测定结果显示,泡桐花多糖低、中、高剂量含量均高于空白组。与空白组相比,低剂量组肝脏、回肠GSH显著(P<0.05)增加,分别增加了60.03%、69.40%;中、高剂量组心脏、肝脏、回肠差异均显著(P<0.05),中剂量分别增加了55.31%、104.89%、70.43%;高剂量分别增加了110.62%、135.49%、163.52%,且高剂量组显著高于Vc(P<0.05);所有剂量组肾脏中GSH量增加但不显著(P>0.05)。

图2 泡桐花多糖对小鼠血清和组织器官GSH的影响(n=4)Fig.2 Effect of Paulownia fortune flower polysaccharide on GSH in the serum and tissues of mice (n=4)
2.2.4 泡桐花多糖对小鼠血清和组织器官MDA的影响 MDA是由自由基与多不饱和脂肪酸反应形成过氧自由基和过氧化脂质,两者代谢合成MDA,常用的膜脂过氧化指标,因此,通过主要末端产物MDA的含量的检测可以反映机体脂质过氧化和受损的程度[25-26]。如图3所示,与空白组相比,泡桐花多糖血清低、中、高和Vc对照组均能显著降低MDA含量(P<0.05),分别降低了56.50%、61.73%、62.13%、65.12%。心脏组织所有剂量组MDA含量均显著降低(P<0.05);其他组织器官实验组,仅有肾脏中、高剂量和回肠高剂量组显著降低(P<0.05),分别降低了33.73%、34.92%、25.80%。但同时发现,泡桐花多糖血清和所有脏器组织MDA含量并未随给药剂量的增加而呈剂量依赖显著降低,各低、中、高剂量组间差异无显著变化(P>0.05)。

图3 泡桐花多糖对小鼠血清和组织器官MDA的影响(n=4)Fig.3 Effect of Paulownia fortune flower polysaccharide on MDA in the serum and tissues of mice (n=4)
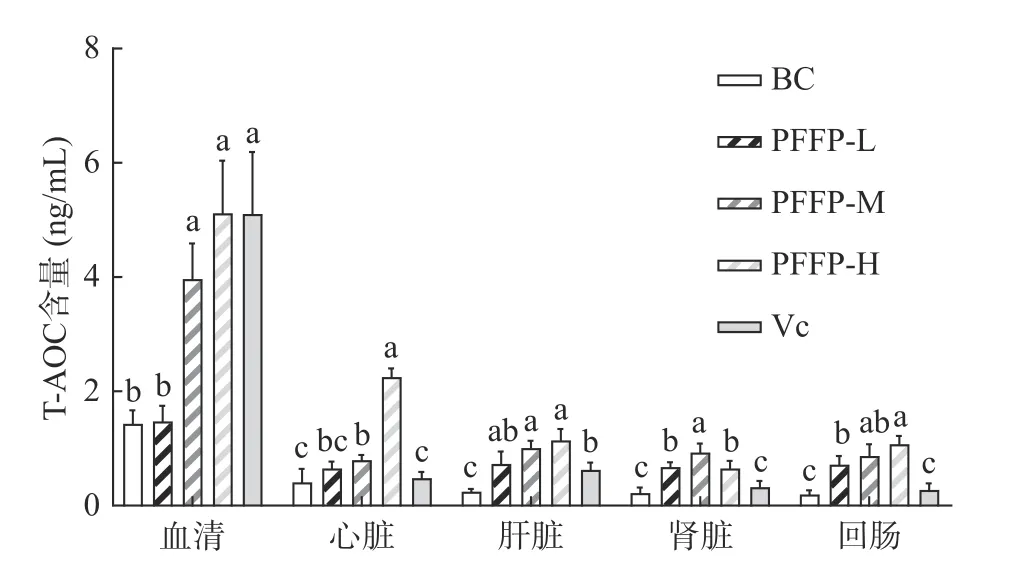
图4 泡桐花多糖对小鼠血清和组织器官T-AOC水平的影响(n=4)Fig.4 Effect of Paulownia fortune flower polysaccharide on T-AOC in the serum and tissues of mice (n=4)
2.2.5 泡桐花多糖对小鼠血清和组织器官中T-AOC的影响 机体的抗氧化防御途径主要有消除自由基和活性氧、分解过氧化物、除去催化作用的金属离子,包括酶促与非酶促两个体系部分,两者构成总抗氧化水平[27-28]。酶促体系主要包括SOD、GSH-Px、CAT、谷胱甘肽S-转移酶(GST)等抗氧化酶[29];非酶促反应体系中主要为维生素、氨基酸和金属蛋白质[30]。如图4所示,泡桐花多糖高、中剂量均能显著增加血清和各个组织器官T-AOC水平(P<0.05),且组织器官高于阳性对照组Vc;血清则高剂量效果与Vc相当。与空白组相比,低剂量组仅肝脏、肾脏、回肠表现差异显著(P<0.05),血清和心脏则不显著(P>0.05)。综合而言,灌胃一定剂量的泡桐花多糖
样品,小鼠血清和主要脏器的总抗氧化能力均能显著增加,证实泡桐花多糖资源值得进一步挖掘利用。
3 结论
对泡桐花水提醇沉多糖的体内外抗氧化作用进行了较为系统的评价。体外抗氧化实验结果表明,泡桐花多糖对超氧阴离子、羟基自由基、抗H2O2溶血率均有较为显著的清除或抑制作用。多糖浓度为0.5 mg/mL时,泡桐花多糖对超氧阴离子、羟基自由基的清除率均超过半数效应50%;1 mg/mL时,羟基自由基指标结果强于阳性对照Vc;2 mg/mL时,泡桐花多糖抗H2O2溶血率超过阳性对照Vc(1 mg/mL)。体内抗氧化实验表明,泡桐花多糖能够提高小鼠血清、心脏、肝脏、肾脏、回肠组织SOD和GSH含量、T-AOC水平和降低MDA含量,且呈一定的剂量依赖性,说明泡桐花多糖具有良好的体内抗氧化作用,可作为新型天然抗氧化剂探索应用于医药保健、功能食品等领域。
