IL-23/IL-17轴与直肠癌根治术后患者肠功能的相关性*
2021-06-17陈其珠黄国定黄琰菁
陈其珠,黄国定△,黄琰菁
1.海南西部中心医院肿瘤内科,海南儋州 571700;2.海南省人民医院肿瘤内科,海南海口 570311
根治性手术是治疗直肠癌的有效方法,可完整切除肿瘤组织及周围淋巴组织,降低肿瘤术后转移率及复发率,对延长患者生存时间具有重要意义[1]。但直肠癌根治术后常并发肠道菌群失调,不少患者根治术后短期内面临排便次数增加、大便失禁等多种肠道症状,部分患者可能在术后一段时间无法很好地恢复[2]。因此,寻求可准确评估、预测直肠癌根治术后患者肠功能恢复情况的技术或实验指标十分必要。白细胞介素(IL)-23、IL-17均是促炎症细胞因子,参与肺、脑及胃肠道等多种组织慢性炎症,IL-23的缺失可降低辅助性T细胞17(Th17)分泌特征因子IL-17的能力。近年研究证实,IL-23/IL-17轴参与多种肿瘤发生、发展[3-4]。研究显示,慢性炎性反应、感染等均是直肠肿瘤发生的重要因素,其中炎性反应与直肠癌发生、发展密切相关[5]。故推测IL-23/IL-17轴与直肠癌根治术后患者肠功能的恢复有一定联系。本研究主要观察IL-23、IL-17在直肠癌患者中的水平,分析二者与直肠癌根治术后患者肠功能的关系,为未来指导直肠癌术后患者肠功能的评估与干预提供依据,现报道如下。
1 资料与方法
1.1一般资料 回顾性分析2017年1月至2019年12月在海南西部中心医院完成直肠癌根治术治疗及随访的81例直肠癌患者病历资料。81例患者中男48例,女33例;年龄40~67岁,平均(48.63±3.06)岁;体质量指数(BMI)16.9~25.8 kg/m2,平均(22.83±1.06)kg/m2;合并基础疾病:高血压11例,糖尿病10例,血脂异常5例;肿瘤下缘距齿状线2.5~9.2 cm,平均(6.78±2.01)cm。
1.2纳入、排除标准 纳入标准:(1)直肠癌符合《中医肛肠科常见病诊疗指南》[6]中直肠癌的诊断标准,且经镜检及穿刺病理学检查确诊;(2)患者均在海南西部中心医院接受腹腔镜直肠癌根治术治疗并完成术后随访,随访时间≥3个月;(3)临床资料、影像学资料均完整;(4)患者对本次研究资料采集及阅览知情且同意。排除标准:(1)合并心、肝、肾、肺等重要脏器病变或功能不全;(2)患有自身免疫性疾病;(3)伴凝血功能障碍;(4)合并血液系统疾病;(5)合并溃疡性结肠炎、克罗恩病等其他影响肠道功能的疾病。
1.3方法
1.3.1直肠癌根治术后患者肠功能恢复评估及分组方法 参照2005年由TEMPLE等[7]研发的纪念斯隆-凯特林癌症中心(MSKCC)肠道功能问卷评估患者术后3个月肠功能恢复情况,主要包括排便感觉异常、便频、便急、饮食对排便影响4个维度,共计18个条目,其中第1个条目为“过去4周里,您通常排便几次?”不属于任何因子,该条目根据排便次数划分为5个等级,按照排便次数由多到少顺序赋值1~5分;其余各个条目采用Likert 5级评分,“总是”记为1分、“经常”记为2分、“有时”记为3分、“很少”记为4分、“从不”记为5分;该量表总分为18~90分,分数越高,患者肠功能越好,总分≥54分判定为术后肠功能恢复良好,反之为恢复不良。将术后肠功能恢复良好的患者纳入恢复良好组,其他纳入恢复不良组。
1.3.2血清IL-23、IL-17、IL-6检测方法 采集所有直肠癌患者术后10 d清晨空腹外周静脉血3~4 mL,于室温下放置30~60 min,以3 000 r/min离心10~15 min(离心机型号:BY-160C型;北京白洋医疗器械有限公司),分离血清,并置于-20 ℃环境中冷冻备用。采用酶联免疫吸附法检测患者血清IL-23、IL-17、IL-6水平,试剂盒均由美国R&D公司提供,检测操作均严格按照试剂盒说明书进行。
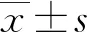
2 结 果
2.1直肠癌根治术后患者肠功能恢复情况 直肠癌根治术后,59例患者肠功能恢复良好,占72.84%(59/81),MSKCC评分为(68.58±5.12)分;22例肠功能恢复不良,占27.16%(22/81),MSKCC评分为(49.06±4.85)分。
2.22组直肠癌患者的相关资料比较 2组患者性别、基础疾病、年龄、BMI和肿瘤下缘距齿状线距离差异无统计学意义(P>0.05);直肠癌根治术后肠功能恢复不良组患者血清IL-6、IL-17、IL-23水平高于恢复良好组,差异有统计学意义(P<0.05)。见表1。

表1 2组患者的相关资料比较

组别nBMI(x±s,kg/m2)肿瘤下缘距齿状线距离(x±s,cm)IL-6(x±s,ng/mL)IL-23(x±s,pg/mL)IL-17(x±s,pg/mL)恢复良好组5922.91±1.086.77±2.0056.69±5.3649.02±4.2158.65±5.69恢复不良组2222.61±1.066.79±2.0262.03±5.4165.67±4.6977.85±6.36χ2/t1.1170.0403.97815.34813.081P0.2670.968<0.001<0.001<0.001
2.3直肠癌根治术后患者肠功能恢复不良影响因素的单因素Logistic回归模型分析 经单因素Logistic回归模型分析显示,血清IL-6、IL-17、IL-23水平增高可能是直肠癌根治术后患者肠功能恢复不良的影响因素(OR>1,P<0.05)。见表2。

表2 直肠癌根治术后患者肠功能恢复不良影响因素的单因素Logistic回归模型分析结果
2.4直肠癌根治术后患者肠功能恢复不良影响因素的多因素Logistic回归模型分析 将直肠癌根治术后患者肠功能恢复情况作为因变量(1=恢复不良,0=恢复良好),将IL-17、IL-23、IL-6作为自变量,建立多因素Logistic回归模型,结果显示,血清IL-17、IL-23、IL-6水平增高均是直肠癌根治术后患者肠功能恢复不良的影响因素(OR>1,P<0.05),其中IL-17、IL-23水平增高带来的影响更大(OR=1.762、1.709),可作为影响患者肠功能恢复的独立危险因素。见表3。
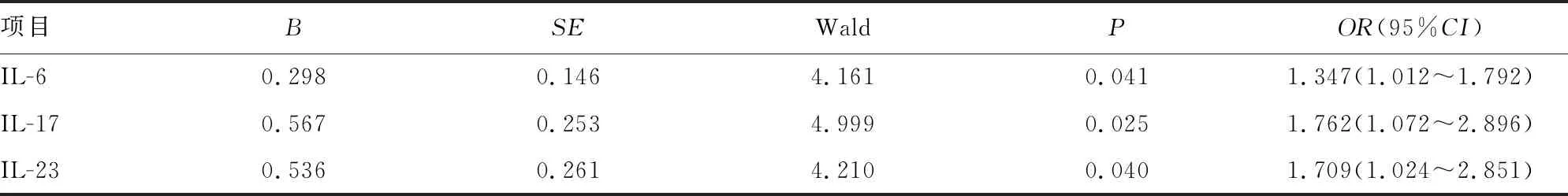
表3 直肠癌根治术后患者肠功能恢复不良影响因素的多因素Logistic回归模型分析结果
2.5直肠癌根治术后患者IL-17、IL-23、MSKCC评分的相关性 经双变量Pearson直线相关性检验显示,直肠癌根治术后患者IL-17、IL-23水平与MSKCC评分呈负相关(r=-0.614、-0.666,P<0.05);血清IL-23与IL-17水平呈正相关(r=0.752,P<0.05)。见图1。

注:A、B分别表示IL-17、IL-23与MSKCC评分的相关性,C表示IL-17与IL-23的相关性。
2.6IL-23、IL-17单独及联合检测对直肠癌根治术后患者肠功能恢复不良风险的预测价值 将直肠癌根治术后患者肠功能恢复情况作为状态变量(1=恢复不良,0=恢复良好),将血清IL-23、IL-17作为检验变量,绘制ROC曲线,结果显示,当血清IL-23、IL-17的最佳临界值分别取50.025、60.755 pg/mL时,提示术后肠功能恢复不良高风险,此时血清IL-23、IL-17单独及联合预测直肠癌根治术后患者肠功能恢复不良风险的AUC分别为0.888、0.929、0.948,均有一定预测价值。见表4、图2。

表4 IL-23、IL-17单独及联合检测预测直肠癌根治术后患者肠功能恢复不良风险的价值

图2 IL-23、IL-17单独及联合检测预测肠功能恢复不良风险的ROC曲线分析
3 讨 论
直肠癌发病率、病死率较高,手术是其主要的治疗方式。近年来,随着直肠癌根治术后患者对生存质量的要求不断提高,腹腔镜直肠癌根治术因具有微创、术后恢复快、机体不良应激作用小等优点得到广泛应用,其已被证实有利于患者术后恢复[8-9]。但大部分直肠癌根治术后患者仍需面临排便次数增加、排便不尽甚至大便失禁等多种肠道症状,给患者日常生活带来一定困扰[10]。因此,采取科学、有效的方法进行早期评估、预测直肠癌根治术后患者肠道功能恢复情况十分重要。
有研究显示,直肠癌经根治术后部分患者会伴有不同程度的肠道症状,这可能与肿瘤与肛缘的距离有关,距离越近,手术更易损伤盆底肌肉及神经,进而引发肠道症状,不利于肠道功能恢复[11]。本研究纳入的81例直肠癌患者,全部经腹腔镜直肠癌根治术治疗,术后有22例肠道功能恢复不良,发生率为27.16%,提示直肠癌根治术后患者肠道功能恢复不佳的风险高,因此,找出可预测术后肠道功能恢复不良风险的指标十分必要。有研究报道,慢性炎性反应是结直肠癌发生、发展的重要因素,与肿瘤的发生、发展密切相关,肿瘤患者初期组织炎性反应有一定抗瘤效应,但若炎性反应持续存在,则不利于预后[12]。IL-6是一种多效性炎症因子,来源于单核巨噬细胞,在慢性炎症及肿瘤发生、发展中均发挥重要作用,可诱导癌细胞产生急性期反应蛋白[13]。IL-6是参与机体对肿瘤免疫的重要介导因子,作为结直肠癌生长因子,可促进癌细胞增殖、分裂,也可延长细胞生存期,其与肿瘤发展有一定联系[14]。高水平的IL-6具有直接免疫抑制作用,使得肿瘤与宿主间关系复杂化,抑制中性粒细胞浸润,继而导致慢性炎症[15],故而推测IL-6与直肠癌根治术后患者肠功能恢复具有一定联系。本研究发现,恢复不良组患者血清IL-6水平高于恢复良好组(P<0.05),经建立多因素Logistic回归模型分析显示,IL-6水平升高可能对直肠癌术后肠功能恢复有影响,但需要注意的是IL-6表达稳定性较差,在具体使用价值方面尚待进一步明确。
IL-17是辅助性T细胞的主要效应因子,是一种主要由活化T细胞产生的致炎因子,参与皮肤、肺及胃肠道等多种组织的慢性炎症病理进程,且可增强IL-6、IL-1等炎症细胞因子表达,进而加剧炎性反应[16]。IL-23属于IL-12家族,主要由活化的树突状细胞分泌而成,可与其自身特异性受体结合后发挥作用,主要参加了Th17细胞适应内部新环境及分泌IL-17的过程[17]。王建升等[18]研究显示,IL-17、IL-23在肿瘤发生、发展过程中有一定作用,可促进结直肠癌发展,且与结直肠癌患者预后具有密切联系。此外,IL-17、IL-23均属于促炎因子,IL-23是肠道炎性反应始动者,可导致炎症细胞因子级联反应,使得肠道中IL-17表达增高,加剧炎性反应;且IL-17可增加炎症细胞因子,如IL-23的表达,进而加剧炎性反应,故推测IL-23/IL-17轴与直肠癌根治术后患者肠功能恢复有一定联系。
本研究显示,恢复不良组血清IL-17、IL-23水平均高于恢复良好组(P<0.05),血清IL-17、IL-23水平增高是直肠癌根治术后患者肠功能恢复不良的影响因素(OR=1.762、1.709)。分析原因可能为IL-23及IL-17属于促炎症细胞因子,不仅参与机体自身免疫性疾病的发生及慢性炎性反应,还参与肿瘤相关的炎性反应,其中IL-23被认为是一种与肿瘤相关的细胞因子,可增强血管形成,抑制杀伤性T细胞功能,进而促进肿瘤生长;IL-17可刺激结肠癌细胞分泌血管内皮生长因子,间接促进血管生成,还可增强IL-6、IL-23等炎症细胞因子表达,进而加剧炎性反应[19]。有研究报道,结直肠癌患者外周血IL-23、IL-17水平与癌症发生、发展密切相关,在结直肠癌患者中水平升高多预示不良预后[20]。故推测IL-23/IL-17轴与直肠癌根治术后患者肠功能恢复存在一定联系,但具体机制尚未明确,还需临床进一步证实。
本研究显示,直肠癌根治术后患者肠功能恢复与IL-23、IL-17水平呈负相关(P<0.05),血清IL-23、IL-17单独及联合检测对直肠癌根治术后患者肠功能恢复不良风险有一定的预测价值,当血清IL-23、IL-17的最佳临界值为50.025、60.755 pg/mL时,提示术后肠功能恢复不良高风险,且随着二者水平升高风险增加。但本研究发现,IL-23、IL-17联合检测的灵敏度与IL-23、IL-17单独检测的一致,特异度低于IL-23、IL-17单独检测,可见,IL-23、IL-17联合检测用于评估直肠癌根治术后患者肠功能恢复情况未见明显优势,其具体应用价值尚未明确,具体情况仍待临床进一步证实。此外,本研究还显示,血清IL-17、IL-23之间呈正相关,二者可能相互作用、相互影响,并共同参与直肠癌根治术后患者肠功能的恢复,但这一关系机制尚未明确,还需未来进一步证实。
综上所述,直肠癌根治术后患者血清IL-23、IL-17水平增高,可能预示患者术后存在肠功能恢复不良高风险,术后早期监测患者血清IL-23、IL-17水平,可能对患者术后肠功能恢复不良风险预测,指导制订早期干预计划,以及促进患者肠功能恢复具有积极意义。
