吉非替尼通过调控表皮生长因子受体影响兔膝骨关节炎软骨损伤作用的机制
2021-06-17谢大伟张来鑫李青松王静王彤
谢大伟 ,张来鑫 ,李青松 ,王静 ,王彤
作者单位:1 秦皇岛市中医医院手足外科,河北 秦皇岛 066000;2 青龙县医院妇产科,河北 秦皇岛 066500
骨性关节炎(Osteoarthritis,OA)主要的病理改变表现为关节软骨缺损及软骨下骨质增生。目前OA 的发病机制依然不够清楚,但氧化应激、炎症因子、维生素 D、肥胖等因素都被证明是 OA 的危险因素,其中炎性因子诱发的软骨细胞外基质的过度降解和软骨退化被认为是 OA 的主要因素。表皮生长因子受体(EGFR)信号通路在机体的很多生长及代谢过程都发挥着重要的调控作用,尤其是在骨骼系统中调控软骨细胞增殖、分化、凋亡等过程中的作用。吉非替尼作为一种选择性 EGFR 酪氨酸激酶抑制剂,通过选择性竞争 EGFR 酪氨酸激酶催化区域中的 Mg-ATP 结合位点,从而阻断 EGFR 信号通路,抑制非小细胞肺癌的血管生成,促进细胞凋亡,但其在关节炎的作用目前鲜少报道。本研究于 2019年 1—6月在研究吉非替尼调控兔膝 OA 模型软骨代谢过程中,进一步明确 EGFR 调控软骨细胞代谢的具体机制,来为 OA 的治疗提供理论基础。
1 材料与方法
1.1 实验动物
选择清洁级健康新西兰兔 30 只,雌性各半,6月龄,体质量范围为 2.0~2.5 kg,由上海市松江区实验动物厂提供,许可证号:SCXK(沪)2017—0008,由福建中医药大学动物中心提供清洁级饲养环境进行常规饲养 ,许可证号 SCXK(闽)2017-0001。动物实验获得秦皇岛市中医医院动物研究伦理委员会批准(20190513)。根据《关于善待实验动物的指导性意见》中动物处理方式进行实验。1.2 主要试剂及仪器
吉非替尼(山东安弘制药有限公司提供 ,批号 H20160013,批次 20161223);原位末端标记法(TdT-mediated dUTP-biotin nick end labeling assay,TUNEL)检测试剂盒(上海锐聪科技发展有限公司);Ⅱ型胶原蛋白(COL-Ⅱ)、基质金属蛋白酶 13(MMP-13)免疫组化试剂盒(武汉博士德生物制剂有限公司);肿瘤坏死因子 α(TNF-α),白细胞介素-1β(IL-1β)试剂盒(上海高创化学科技有限公司);磷酸化丝裂素活化蛋白激酶(p-P38 MAPK)、丝裂素活化蛋白激酶(P38MAPK)、p-EGFR、EGFR、GAPDH 多克隆抗体(美国 Abcam 公司);高速台式冷冻离心机(德国 sigma3-30K);OLYMPUSBX 51 显微镜(日本奥林巴斯有限公司);HPIAS-1000 高清晰彩色病理图 像 分 析系统(同济千屏)。1.3 动物分组及模型制备
将 30 只 6月龄新西兰兔采用随机数表法分为假手术组、模型组、吉非替尼组,每组 10 只。所有组均根据 Hulth-Telhag 法建立 OA 模型,利用 30 mg∕kg 戊巴比妥钠与兔耳缘静脉注射麻醉后,将兔保持仰卧位固定后,常规备皮,消毒铺巾,取兔左、右膝关节内侧行纵侧剪开长约 4 cm 的切口,假手术组仅剪开皮肤,不做任何处理,模型组及吉非替尼组均剪断前、后交叉韧带及内侧副韧带,并将内侧半月板完整的摘除,伤口缝合,采取无敷料包扎,不对伤腿进行固定。术后采用单兔单笼喂养方式,前 7 d 通过肌内注射硫酸庆大霉素 80000 U 防止伤口感染,每天强迫兔活动 30 min,4周后即可获得兔 KOA 模型。1.4 给药方法
造模 4周后开始给药,根据兔与人用药量用 Meeh Rubner 公式换算等效剂量,吉非替尼组兔给予 85 mg∕kg 灌胃给药,假手术组和模型组给予等量生理盐水灌胃,1 次∕天,连续 5周。1.5 样本采集及制备
停药 1周后,于取样前禁食10 h,耳缘静脉注射空气处死动物后,在髌骨内侧做纵行切口,逐层分开直至关节囊,将关节处反复屈伸将关节液挤压带髌上囊内侧后,往里面注射生理盐水反复抽吸后,将关节液尽量抽出后放置于试管中 ,低温高速离心 15 min 后 ,留取上清 ,保存于-80 ℃超低温冰箱中待测。同时剪开膝关节囊后,将股骨内踝关节软骨迅速取出并修成 0.5 cm×0.5 cm×0.5 cm 的组织块,经固定、脱钙后,石蜡包埋,连续切成厚约 5 μm 的切片,用于病理变化检查及 TUNEL 细胞凋亡检测。1.6 苏木精-伊红(HE)染色观察软骨组织病理变化情况及 Mankin ′s 评分
将组织切片用二甲苯溶液浸泡 5 min,浸泡 2 次;后梯度乙醇水合,然后依次浸入苏木素染液内染色 3~5 min,水洗 30~60 s;酸水浸润 20 s,水洗 30~60 s;氨水中浸润 40 s,水洗 30~60 s;最后置于伊红染液中染色 2 min,再洗去多余染液,滤纸吸干,迅速滴加适量中性树胶,盖玻片封固,显微镜下观察染色情况并分析。以 Mankin ′s 评分评定标准,对各组软骨组织 HE 染色病理变化情况进行分析。1.7 TUNEL 染色观察软骨细胞凋亡情况
按照试剂盒说明要求,依次使用二甲苯和浓度梯度乙醇溶液清洗切片,用蛋白酶 K 溶液室温处理 15 min,PBS清洗 4 次。10% 中性甲醛固定两次,分别用乙醇乙酸和 3% 过氧化氢浸润,PBS 清洗后加入 TdT 酶缓冲溶液孵育 5 min;PBS 清洗后加入预热的终止液,终止反应 20 min,PBS 清洗 2 次,滴加过氧化酶标记物抗体,孵育 20 min 后 PBS 清洗,加上二氨基联苯胺(Diaminobenzidine,DAB)显色液,显色半小时用无水乙醇和二甲苯固定,晾干,荧光封片试剂封片。两小时内荧光显微镜下观察结果。凋亡率(%)=阳性细胞∕总细胞×100%。1.8 关节液中 TNF-α、IL-1β 水平检测
采用酶联免疫吸附测定(ELISA)检测关节液中 TNF-α、IL-1β水平,由专业熟练人员严重按照试剂盒说明说进行检测。1.9 免疫组化检测软骨组织中 COL-Ⅱ、MMP-13阳性表达情况
将石蜡切片脱水、PBS 溶液漂洗、3% 过氧化氢与甲醇混合液浸泡 10 min,超纯水漂洗、抗原修复、PBS 漂洗 5 min、加入一抗 37 ℃反应 2 h、PBS 漂洗 5 min、加入二抗 37 ℃反应 40 min、PBS漂洗 5 min、DAB 室温显色 20~30 min,镜检观察有棕黄色颗粒出现时则采用自来水终止。再用苏木素复染 30 s、自来水漂洗、中性树胶封片,光镜下观察细胞样本中 COL-Ⅱ、MMP-13 的阳性表达细胞,其细胞质表现为棕黄色颗粒。每张片子 400×视野 10 个,统计阳性细胞数目,以计算阳性细胞率,阳性细胞率=阳性细胞数目∕总细胞计数×100%。1.10 蛋白质印迹法(Western blotting)检测软骨组织中 EGFR、P38MAPK 蛋白表达情况
提取各组兔软骨组织中的总蛋白,采用 Bradford 调整各组蛋白浓度一致,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、电转膜至甲醛处理过预处理过的聚偏二氟乙烯膜(PVDF 膜),密封 2 h,加入 p-P38MAPK、P38MAPK、p-EGFR、EGFR、GAPDH 一抗(1∶500)4 ℃孵育过夜,等渗缓冲盐溶液(TBST)漂洗40 min,加入 HRP 标记的二抗(1∶500)孵育 1 h,TBST 漂洗 40 min,ECL 发光液显色,暗室曝光到 X线片上,采用 Imaging System 软件分析各组条带灰度值,依据相对灰度值进行统计学分析。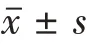
2 结果
2.1 各组病理观察及 Mankin′s 评分情况
与假手术组相比,模型组关节软骨层明显变薄,并且有溃裂和裂隙情况存在,同时软骨柱状排列消失,结构遭到严重损坏,软骨细胞明显减少,与模型组相比,吉非替尼组软骨病理损伤情况更严重 ,且三组Mankin′s 评分关系为假手术组<模型组<吉非替尼组(均P
<0.05)。见图1、表1。2.2 各组软骨细胞凋亡情况
TUNEL 染色结果显示:假手术组软骨细胞凋亡率显著低于模型组,而模型组软骨细胞凋亡率显著低于吉非替尼组(均P
<0.05)。见表1。2.3 各组关节液中 TNF-α、IL-1β 水平比较
假手术组兔关节液中 TNF-α、IL-1β 水平显著低于模型组,而模型组兔关节液中 TNF-α、IL-1β 水平显著低于吉非替尼组(均P
<0.05)。见表1。2.4 各组中软骨组织中 COL-Ⅱ、MMP-13 表达情况
免疫组化结果显示:模型组中 COL-Ⅱ阳性表达率显著低于假手术组,而又显著高于吉非替尼组(P
<0.05),模型组中 MMP-13 阳性表达率显著高于假手术组 ,而显著低于吉非替尼组(P
<0.05)。见 图2、表1。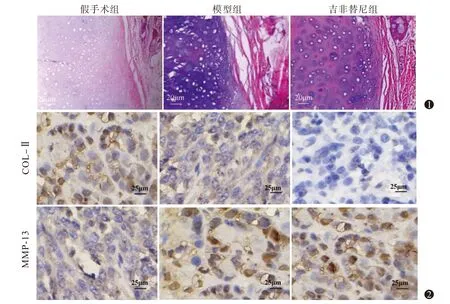
图1 各组新西兰兔软骨组织病理结果(HE染色×400) 图2 各组新西兰兔软骨组织中Ⅱ型胶原蛋白(COL-Ⅱ)、基质金属蛋白酶13(MMP-13)表达情况(免疫组织化学染色×400)
2.5 各组中 P38MAPK、EGFR 蛋白表达情况
Western blotting 结果显示,吉非替尼组中 EGFR 蛋白磷酸化水平显著低于模型组,模型组又显著低于假手术组,同时吉非替尼组中 p38MAPK 蛋白磷酸化水平显著高于模型组,模型组又显著 高于假手术组(均P
<0.05)。见图3、表1。
图3 各组新西兰兔中 P38MAPK、EGFR 蛋白表达条带图
3 讨论
目前研究已经证实,软骨细胞的凋亡、细胞外基质的降解都是导致 OA 软骨降低的主要因素,而软骨细胞的凋亡又发挥着关键的作用。关节软骨作为一种特殊的无血管且细胞数目较少的结缔组织,其软骨细胞软转换率较低,因此软骨损伤后的自我修复能力较差,而大量的动物实验及临床试验结果显示,要想提高软骨组织自我修复能力维持软骨组织的完整性至关重要。软骨细胞的更新及代谢过程极为复杂,由多种细胞因子参与,其中 EGF 信号通路能够介导多种信号传导途径,来调控软骨细胞的生物学过程,在健康人群软骨中可明显看到磷酸化 EGFR 染色较强,且仅分布在软骨表层,而随着 OA 的进程,磷酸化 EGFR 的染色显著减少。本研究发现给予兔 KOA 模型吉非替尼处理,关节软骨损伤情况进一步恶化,提示磷酸化 EGFR水平减少后,会导致关节软骨的结构、功能及机械力学等明显减弱,加速软骨病理条件下的退变。袁功武等利用遗传修饰小鼠和吉非替尼处理小鼠,均发现低 EGFR 活性的 OA 小鼠软骨细胞破坏加重,OA 进展更快,本研究与其基本一致。
细胞的凋亡是机体重要的自我保护机制,能够避免细胞坏死后的内容物损伤周围组织,而一旦这个机制出现问题,就会诱发炎症。TNF-α 作为一种重要的炎症细胞因子,能够通过级联效应加重炎症反应,还会加速软骨基质的降解,IL-1β 则是作为主要的效应因子,直接作用于软骨细胞,促进前列腺素 E2 的释放,诱发滑膜炎症及骨吸收,同时前列腺素还会加速软骨的分解,加重关节损伤。本研究结果显示兔 KOA 模型吉非替尼处理后,软骨细胞凋亡率显著升高,同时关节液中 TNF-α、IL-1β 水平也显著升高,提示我们吉非替尼可能是通过促进软骨细胞凋亡及关节处炎症反应来加重软骨退变。陈永健等研究显示,兔 KOA 模型软骨细胞凋亡率显著高于对照组,并且血清 TNF-α、IL-1β 水平也显著高于对照组,本研究与其一致。

表1 各组新西兰兔关节软骨组织细胞各指标比较
软骨基质的降解也是诱发 OA的重要因素 ,MMPs 蛋白通过特异性的裂解胶原分子,从而直接降解软骨基质,其中 MMP-13 可直接降解软骨基质中最具代表性且含量最高的 COL-Ⅱ,其他 MMPs 都需要经过 MMP-13 来发挥作用 ,因此 MMP-13 和COL-Ⅱ的水平可作为反映软骨退化情况的重要指标。本研究结果显示,兔 KOA 模型吉非替尼处理后,COL-Ⅱ阳性表达率显著降低,而 MMP-13 表达率显著升高,表明吉非替尼通过促进 MMP-13 表达,加速 COL-Ⅱ降解,从而加重软骨损伤。有研究表示MMPs 的表达受多种信号通路调控,其中 p38MAPK发挥着关键的作用,同时 EGFR 信号途径可以直接或间接的影响 MAPK 信号转导通路,通过蛋白质印迹法检测软骨组织中 EGFR、p38MAPK 蛋白表达水平,我们发现吉非替尼处理后,EGFR 磷酸化水平显著降低,而 p38MAPK 磷酸化水平显著升高,提示我们 低 EGFR 磷酸化水平 ,可能诱导p38MAPK 磷酸化 ,进而激活下游信号因子MMP-13表达 ,加速COL-Ⅱ的进行性降解,证实了 Shu 等提出的 EGFR 可能作为 p38MAPK 信号通路的上游调节因子发挥作用。
综上所述,吉非替尼作为一种特异性 EGFR 磷酸化抑制剂,可能通过抑制 EGFR 磷酸化,促进下游p38MAPK 磷酸化 ,诱导MMP-13合成增加 ,加速COL-Ⅱ降解,同时还会提高关节处炎症细胞因子水平,加重炎症反应,加速软骨细胞凋亡。因此提高EGFR 磷酸化可以作为防治 OA 的一种新手段,但EGFR 具体的调控机制仍有待深入研究。
