复合酶分步水解法制备汉麻多肽及其抗氧化特性研究
2021-06-16朱秀清李美莹孙冰玉王子玥杨宏哲
朱秀清,李美莹,孙冰玉,王子玥,杨宏哲,孟 妍,张 娜,王 冰
(哈尔滨商业大学食品工程学院,黑龙江省普通高校食品科学与工程重点实验室, 黑龙江省谷物食品与综合加工重点实验室,黑龙江哈尔滨 150076)
汉麻(CannabissativaL)又名大麻、火麻等,是大麻科大麻属的一年生草本植物,国际上将四氢大麻酚(THC)含量低于0.3%的大麻称为工业大麻,我国则称之为汉麻[1-3],汉麻籽籽仁可食用,是近几年食品、药品和保健品领域的研究热点[4]。汉麻籽仁中蛋白质含量为20%~25%,脂类含量为25%~35%,碳水化合物含量为20%~30%,脂溶性维生素含量为10%~15%,并含有丰富的矿物质,是人体优质的营养来源[5-7]。汉麻分离蛋白(Hempseed protein isolate,HPI)不含如大豆中的胰蛋白酶抑制剂、低聚糖等抗营养因子,不会影响汉麻籽蛋白的消化吸收,且氨基酸组成均衡[8-9],是一种良好的植物蛋白资源,其开发利用具有广阔的应用前景。

表1 不同蛋白酶的酶解条件Table 1 Ezymatic conditions of different proteases
近年来,生物活性肽的研究成为食品领域的焦点,与蛋白质相比,生物活性肽更易被人体消化吸收[10-11],并具有调节人体生理功能的功效[12],例如,提高抗氧化性、降血压、降血脂、抑菌等作用[13-15]。制备生物活性肽的方法有蛋白质酶解法、化学合成法和微生物发酵法等,其中酶解法具有安全性好、操作简单、条件易控制等优点而成为最常用的制备生物活性肽的方法。汉麻多肽是汉麻分离蛋白经水解制得的小分子肽,对保健食品系列的开发和人类健康的促进具有积极的推动作用。目前,国内对汉麻多肽的研究主要集中在单酶水解方面。梁凯[16]用碱性蛋白酶对汉麻籽分离蛋白进行酶解,在最佳工艺条件下的得到的水解度为21.87%。Tang等[17]用六种不同的蛋白酶分别对汉麻蛋白进行酶解,获得的水解产物具有不同的肽得率和表面疏水性,表现出不同的抗氧化活性,并呈正相关的关系。但用复合酶分步水解的方式制备汉麻多肽的研究报道较少。
本研究以HPI为原料,通过对不同蛋白酶的筛选,选择采用碱性蛋白酶和木瓜蛋白酶复合酶分步水解的方式对汉麻分离蛋白进行酶解,通过响应面优化制备汉麻多肽的最佳工艺条件,同时对汉麻多肽抗氧化能力进行评价,以期为高F值汉麻肽的制备提供理论基础,为汉麻蛋白肽的功能性开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
汉麻分离蛋白(蛋白质含量92.48%,脂肪含量0.38%) 实验室自制;碱性蛋白酶(138526 U/g)、中性蛋白酶(87162 U/g)、木瓜蛋白酶(16460 U/g)、风味蛋白酶(23541 U/g)、胰蛋白酶(78135 U/g) 诺维信生物技术有限公司;正己烷、氢氧化钠、酒石酸钾钠、硫酸铜等 均为国产分析纯;DPPH试剂 德国Ruibio公司。
PHS-25型pH计 上海仪电科学仪器股份有限公司;HH-S4型恒温温水浴锅 巩义市予华仪器有限责任公司;FA224电子天平 上海舜宇恒平科学仪器有限公司;TG16-WS离心机 湘仪实验室仪器开发有限公司;PCE-E3000恒温振荡器 苏州凯特尔仪器有限公司;Alpha-1506型分光光度计 上海市谱光仪器有限公司。
1.2 实验方法
1.2.1 汉麻多肽的制备 在室温下将5 g冷冻干燥的HPI分散在100 mL的去离子水中,搅拌均匀后在90 ℃水浴锅中预处理10 min,降温至酶解反应温度时保温5 min左右,用1.0 mol/L NaOH或1 mol/L HCl调pH至酶的最适pH后加入蛋白酶,在酶解过程中保持混合物的pH恒定,反应结束后,在沸水浴中灭酶10 min来终止反应,酶解液冷却后,在8000 r/min下离心10 min,除去不溶性残余物,将上清液的pH调节至7.0后冷冻干燥,备用。
1.2.1.1 蛋白酶的筛选 取质量浓度为5%的HPI溶液,分别加入碱性蛋白酶、胰蛋白酶、中性蛋白酶、木瓜蛋白酶及风味蛋白酶,加酶量为 10000 U/g,并在其各自的最适温度、pH等(表1)条件下,对HPI进行水解,并测定各酶解液的水解度及汉麻蛋白肽含量。
1.2.1.2 酶解方式的确定 选取两种酶解效果较好的酶制剂进行1∶1分步酶解,以水解度与汉麻蛋白肽含量为指标,研究加酶方式对酶解效果的影响。按表2的酶解条件分别考察三种加酶方式对酶解效果的影响。

表2 酶解方式对酶解效果的影响Table 2 Effect of enzymolysis mode on enzymolysis effect
1.2.1.3 碱性蛋白酶酶解的单因素实验 在HPI为5%条件下,固定反应温度55 ℃、反应时间2 h、加酶量10000 U/g,考察不同pH(7.5、8.0、8.5、9.0、9.5)对HPI水解度和肽含量的影响;固定反应时间2 h,反应pH8.5,加酶量10000 U/g,考察不同温度(45、50、55、60、65 ℃)对HPI酶解效果的影响;固定固定反应温度55 ℃、反应时间2 h、反应pH8.5,考察不同加酶量(6000、8000、10000、12000、14000 U/g)对HPI酶解效果的影响;固定反应温度55 ℃、反应pH8.5、加酶量10000 U/g,考察不同时间(1、1.5、2、2.5、3 h)对HPI酶解效果的影响。
1.2.1.4 碱性蛋白酶酶解的响应面设计 在单因素实验的基础上,根据Box-Behnken试验设计原理,选择底物浓度为5%,时间2 h,以pH、温度、加酶量三个因素为自变量,采用软件Design-Expert V8.0.6设计三因素三水平的响应面分析试验,因素与水平设计如表3所示。
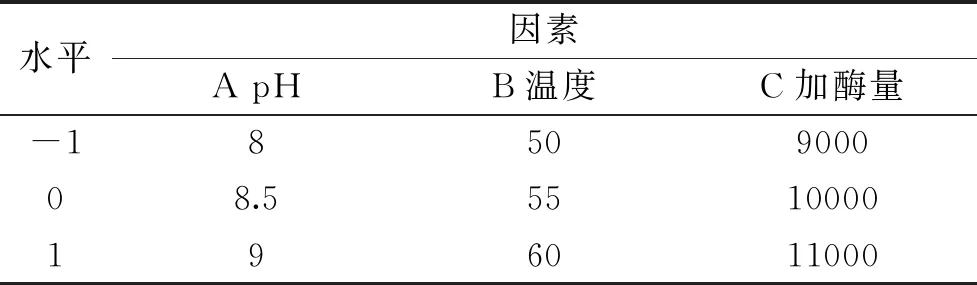
表3 响应面试验因素与水平Table 3 Factors and their levels used in response surface experiment
1.2.1.5 木瓜蛋白酶酶解的单因素实验 在碱性蛋白酶酶解灭酶后,加入木瓜蛋白酶进行酶解。固定反应温度50 ℃、反应时间2 h、加酶量5000 U/g,考察不同pH(5.5、6.0、6.5、7.0、7.5)对HPI水解度和肽含量的影响;固定反应时间2 h,反应pH6.5,加酶量5000 U/g,考察不同温度(45、50、55、60、65 ℃)对HPI酶解效果的影响;固定反应温度50 ℃、反应时间2 h、反应pH6.5,考察不同加酶量(2000、3000、4000、5000、6000 U/g)对HPI酶解效果的影响;固定反应温度50 ℃、反应pH6.5、加酶量5000 U/g,考察不同时间(1、1.5、2、2.5、3 h)对HPI酶解效果的影响。
1.2.1.6 木瓜蛋白酶酶解的响应面设计 根据Box-Behnken试验设计原理,选择时间2 h,以pH、温度、加酶量三个因素为自变量,采用软件Design-Expert V8.0.6设计三因素三水平的响应面分析试验,因素与水平设计如表4所示。

表4 响应面试验因素与水平Table 4 Factors and their levels used in response surface experiment
1.2.2 水解度的测定 水解度是指蛋白质水解断裂的肽键占蛋白质中总肽键的比例,能够表示蛋白质的水解程度。本试验采用甲醛滴定法[18]。吸取10 mL酶解液,加入蒸馏水60 mL后搅拌均匀,用0.05 mol/L氢氧化钠标准溶液滴定至pH8.2时停止搅拌,记录体积;加入中性甲醛10 mL,再用NaOH标准溶液滴定至pH9.2,记下加入甲醛后消耗的氢氧化钠体积V。同时做空白实验,记录消耗的氢氧化钠体积V0。并用以下公式计算水解度。
式中:DH为水解度,%;C为NaOH溶液浓度,mol/L;V为滴定消耗NaOH溶液体积,mL;V0为空白滴定消耗NaOH溶液体积,mL;0.014为氮毫克当量;M为样品中总氮含量,g。
1.2.3 肽含量的测定 标准曲线绘制:精确称取酪蛋白标准品12 g,用蒸馏水配制成浓度为12 mg/mL母液备用。采用梯度稀释法将其依次配成10、8、6、4、2 mg/mL溶液。各取1 mL与3 mL双缩脲试剂混合均匀,放置30 min,在λ=540 nm波长下测其OD值。以酪蛋白浓度(mg/mL)为横坐标,OD值为纵坐标,制作标准曲线。
量取一定体积酶解液,加入一定体积三氯乙酸,混匀,离心,取上清液,再用漏斗过滤,静置30 min;再将滤液与双缩脲试剂混合,在540 nm波长下测定OD值。按标准曲线算出其含量,再乘以样品稀释比例,即为肽含量[19]。
1.2.4 抗氧化能力测定
1.2.4.1 DPPH自由基清除率的测定 参考Chen等[20]的方法,略作修改。取冷冻干燥样品,配制成不同浓度,取2 mL样品加入0.2 mmol/L的DPPH乙醇混合溶液2 mL,混合摇匀后在避光处静置30 min,然后在517 nm处测得吸光值Ai。以无水乙醇溶液代替DPPH溶液作为空白组Aj,以等体积蒸馏水代替样品溶液作为对照组A0。以VC为阳性对照。
式中:Ai-样品组吸光度;Aj-空白组吸光度;A0-对照组吸光度。
1.2.4.2 铁还原力的测定 参考Remanan等[21]研究方法并略作修改。取2.0 mL不同浓度的样品溶液,与2 mLPBS溶液(0.2 mol/L)和2 mL铁氰化钾溶液(1%,w/v)混合,在50 ℃中保温20 min,取出冷却后加入2 mL三氯乙酸(10%)充分混匀,然后5000 r/min离心10 min,取2 mL上清液加入2 mL蒸馏水和0.4 mL三氯化铁溶液(0.1%,w/v)在50 ℃充分反应10 min,在700 nm处测定吸光度。以VC为阳性对照。
1.3 数据处理
每组实验重复3次,采用Excel 2010和SPSS 17.0软件分析数据及作图,Box-Behnken设计采用Design Expert 8.0.6软件并进行响应面分析。
2 结果与分析
2.1 蛋白酶的筛选
选用碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、风味蛋白酶和胰蛋白酶5种蛋白酶,在各酶的适宜条件下进行酶解。由图1可知,采用碱性蛋白酶、木瓜蛋白酶和风味蛋白酶这三种酶水解汉麻分离蛋白的水解度变化不显著(P>0.05),而木瓜蛋白酶、碱性蛋白酶水解汉麻分离蛋白得到的肽含量高于风味蛋白酶。由于碱性蛋白酶的酶切作用位点较多,属于内切酶,可以先将肽链末端的疏水性氨基酸暴露出来,而木瓜蛋白酶是一种外切酶,可以将肽链末端的芳香族氨基酸释放出来[22],所以为了后续更好地制备和分离高F值寡肽,本研究选择碱性蛋白酶和木瓜蛋白酶进行分步复合酶解。

图1 不同蛋白酶对HPI酶解效果的影响Fig.1 Effect of different proteases on HPI enzymolysis注:字母相同表示无显著性差异,P>0.05;字母不同表示 差异显著,P<0.05;图2~图5、图7~图10,图13~图14同。
2.2 酶解方式对酶解效果的影响
经过筛选可得,采用碱性蛋白酶和木瓜蛋白酶进行复合酶解。分别采用将碱性蛋白酶和木瓜蛋白酶同时加入,先加入碱性蛋白酶后加入木瓜蛋白酶和先加入木瓜蛋白酶后加入碱性蛋白酶三种方式进行酶解,研究不同酶解方式对酶解效果的影响。
由表5可知,当采用碱性蛋白酶和木瓜蛋白酶先后使用时,HPI水解液的水解度和肽含量最大,分别达到20.36%和6.82 mg/mL,因此采用先碱性蛋白酶后木瓜蛋白酶的水解方式。

表5 酶解方式对酶解效果的影响Table 5 Effect of enzymolysis mode on enzymolysis effect
2.3 碱性蛋白酶水解条件的优化
2.3.1 pH对酶解效果的影响 由图2可知,当pH小于8.0时,水解度和肽含量都逐渐增大;当pH为8.0时,水解度达到最大值(19.10%),pH为8.5时肽含量达到最大值,为5.1 mg/mL,此时的水解度为18.75%。与pH为8.0时的水解度相比,变化不显著(P>0.05)。pH会影响酶的稳定性,pH大小不同,即溶液中OH-浓度不同,会影响蛋白酶自身的解离和底物的解离,从而影响酶解反应[23],所以溶液过酸或过碱会影响酶与底物的结合。因此,综合考虑选择最佳pH为8.5进行酶解实验。这与梁凯[16]采用碱性蛋白酶单酶酶解火麻仁粕蛋白时得到的结果一致,当pH在7.0~8.5时,水解度逐渐增大,并确定最佳pH为8.5,当pH大于8.5时,水解度开始逐渐降低。因此,pH选择为8.5。

图2 pH对碱性蛋白酶酶解效果的影响Fig.2 Effect of pH value on enzymatic hydrolysis by alkaline protease
2.3.2 加酶量对酶解效果的影响 由图3可知,随着加酶量的逐渐增大,汉麻多肽的水解度和肽含量逐渐上升。当加酶量大于10000 U/g时,水解度和肽含量趋于平缓。可能在此阶段酶解过程中,大分子蛋白减少,导致大分子蛋白与酶结合的几率大大减少,酶分子达到饱和状态[24]。进一步增加酶用量,水解度和肽含量增加不显著。加酶量的多少决定汉麻蛋白水解后生成多肽的量,碱性蛋白酶作为一种内切酶,作用位点较多,可能使肽链充分水解。综合考虑,确定最佳加酶量为10000 U/g。

图3 加酶量对碱性蛋白酶酶解效果的影响Fig.3 Effect of alkaline protease addition on enzymatic hydrolysis

图4 时间对碱性蛋白酶酶解效果的影响Fig.4 Effect of time on enzymatic hydrolysis by alkaline protease
2.3.3 时间对酶解效果的影响 由图4可知,当酶解时间在1~2 h之间时,水解度和肽含量的变化趋势一致,随着时间的增加,水解度和肽含量明显增加,蛋白与酶充分反应,生成大量汉麻多肽;当酶解时间大于2 h后,反应几乎停滞。原因可能是在反应初期,底物浓度较大,蛋白酶与底物作用效果明显,随着时间的延长,底物浓度逐渐降低[25],汉麻蛋白几乎全部水解,水解度和肽含量几乎不再变化。因此,选择最佳酶解时间为2 h。
2.3.4 温度对酶解效果的影响 温度也是影响酶解效果的重要因素,由图5可知,随着温度的升高,汉麻蛋白水解度和汉麻肽含量逐渐增大,在55 ℃时二者达到最大值,当温度大于55 ℃时,水解度和肽含量缓慢减小,可能是由于反应体系温度过高,使碱性蛋白酶活性降低,水解反应逐渐缓慢。酶的催化反应都有各自的最适温度,温度过高会影响蛋白酶的稳定性,使酶失活;其次酶促反应过程中,酶与底物、酶与抑制剂的结合都会受温度的影响[26]。因此选择最佳温度为55 ℃。此结果与周徐慧[27]采用碱性蛋白酶制备抗氧化肽时得到的结果一致,同样在55 ℃时水解度达到最大。
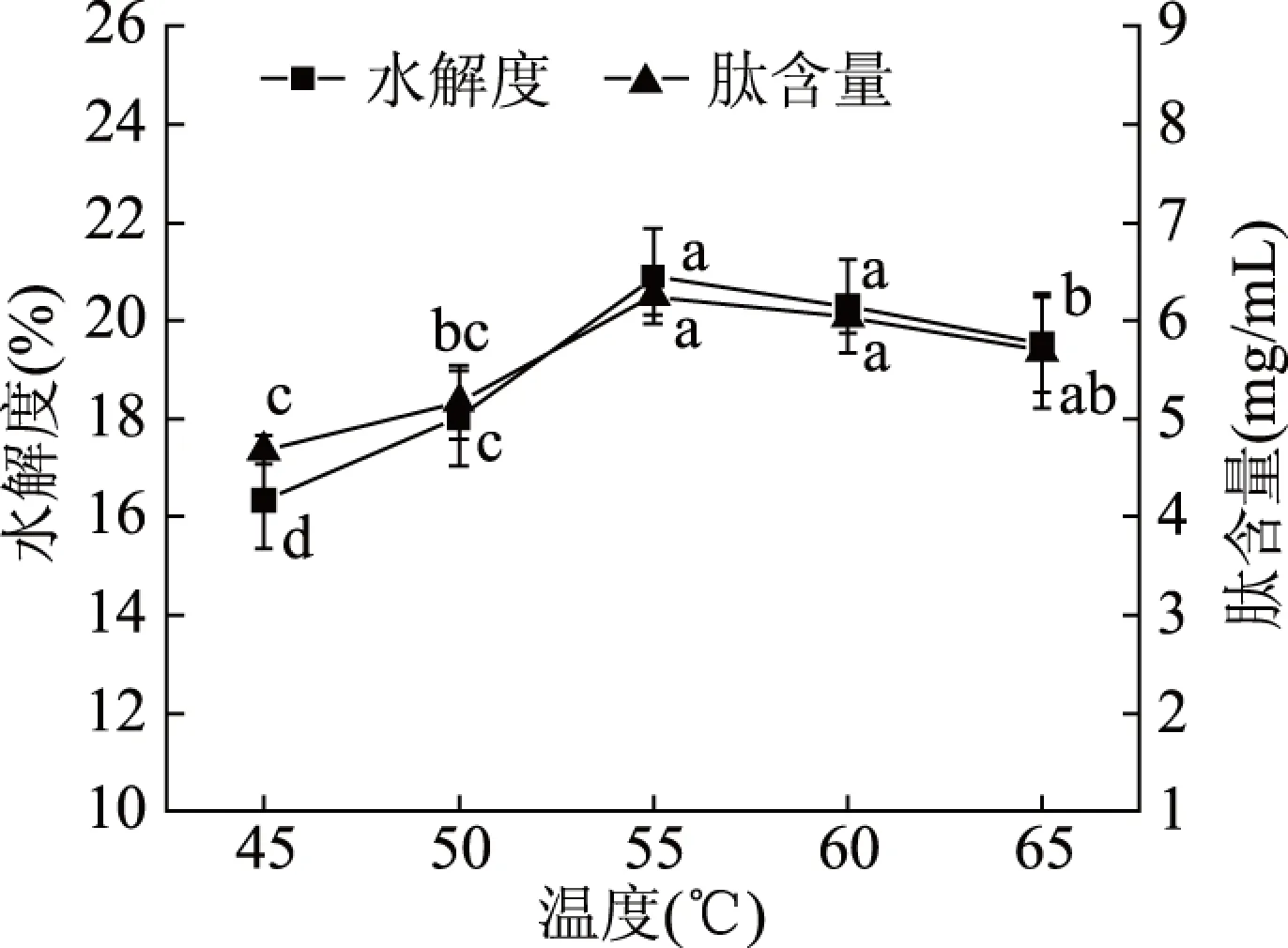
图5 温度对碱性蛋白酶酶解效果的影响Fig.5 Effect of temperature on enzymatic hydrolysis by alkaline protease
2.3.5 响应面优化碱性蛋白酶水解条件 固定酶解反应条件底物浓度为5%,时间为2 h,选定对酶解效果影响较大的3种因素(加酶量、温度、pH)作为响应面分析试验的各因素,从而求出其最佳水解工艺条件。以pH(A)、温度(B)、加酶量(C)作为自变量,以汉麻蛋白水解度(Y1)和酶解结束时溶液中的肽含量(Y2)为指标,设计三因素三水平试验,响应面结果见表6。

表6 Box-Behnken试验设计与结果Table 6 Design and results of Box-Behnken experiment
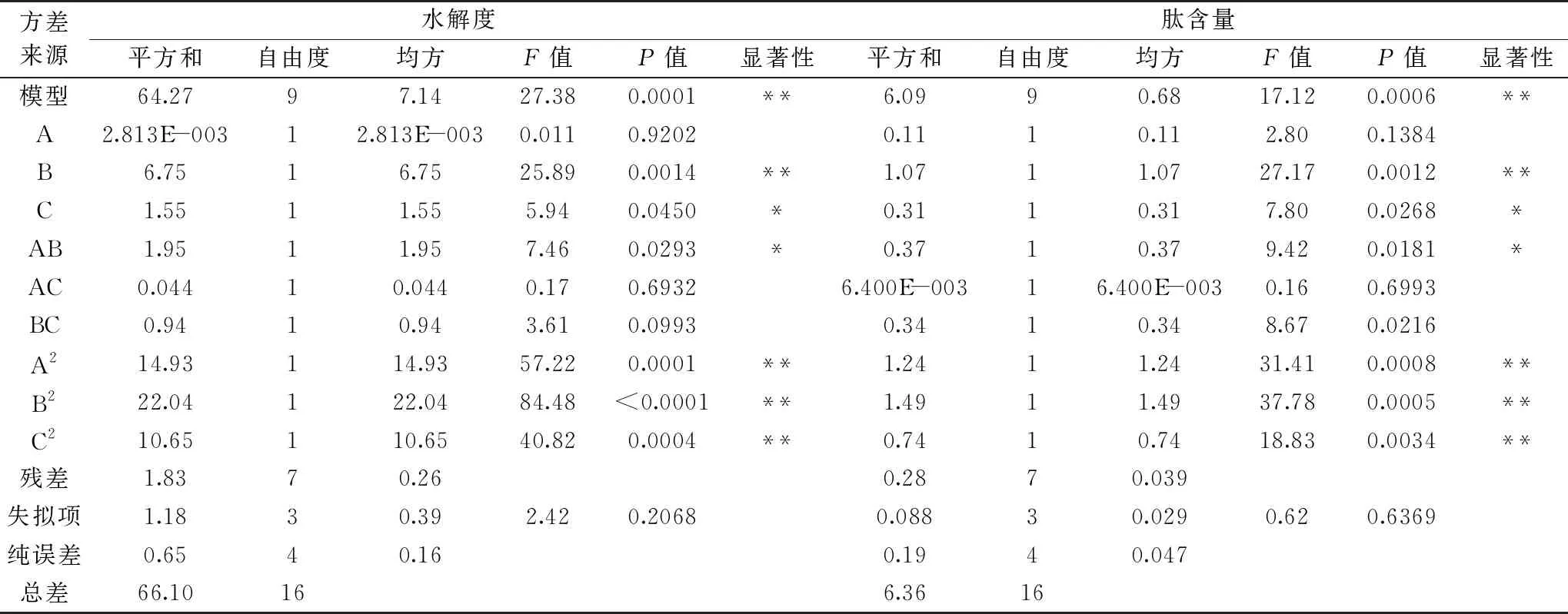
表7 回归模型方差分析Table 7 Variance analysis for the regression model
采用Design-Expert V 8.0.6软件对试验数据进行回归分析,得到的回归方程为:
Y1=23.14-0.019A-0.92B+0.44C-0.70AB+0.10AC+0.49BC-1.88A2-2.29B2-1.59C2;
Y2=7.08+0.12A-0.37B+0.20C-0.31AB-0.04AC+0.29BC-0.54A2-0.60B2-0.42C2。
对方程进行显著性及方差分析,结果见表7。
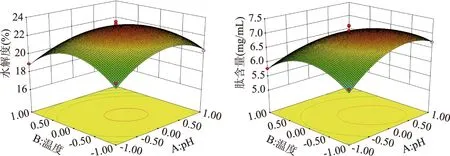
图6 pH和温度对水解度和肽含量的交互作用Fig.6 Interaction of pH and temperature on peptide content

该模型中三个因素对响应值的影响强弱可用F值来进行评价,各因素对汉麻蛋白肽的水解度和肽含量的影响顺序为:温度>加酶量>pH,其中温度的影响极显著(P<0.01),加酶量影响显著(P<0.05),pH影响不显著。对于因素间的交互作用,模型中只有AB交互作用显著(P<0.05)。根据Design Expert软件得出的回归模型各因素相互之间作用如图6所示。
响应曲面的交互图中的椭圆排列越稀疏,各因素的变化对结果的影响越小;响应面图斜度越大,响应值越敏感,对结果的影响越大[28]。由图6可知,随着温度和pH的升高,水解度和肽含量呈先增加后减小的现象,AB交互作用显著,与方差分析结果一致。该模型得到的碱性蛋白酶酶解最佳工艺条件为:pH为8.55,温度为53.74 ℃,加酶量为10120.39 U/g,此时预测水解度为23.24%,肽含量为7.16 mg/mL。为了进一步验证模型的可靠性,考虑到实际生产操作,将最佳碱性蛋白酶酶解工艺调整为:pH为8.5,温度为54 ℃,加酶量为10100 U/g,并在此条件下重复3次试验,实测水解度为22.95%,肽含量为7.06 mg/mL,与预测值较为接近,说明模型拟合较好。
2.4 木瓜蛋白酶水解条件的优化
2.4.1 pH对酶解效果的影响 由图7可知,随着pH的增加,水解度和肽含量均先增加后降低;当木瓜蛋白酶pH为6.5时,水解度和肽含量都达到最大值(22.58%和7.59 mg/mL);当pH高于6.5时,水解度和肽含量的变化趋势都有一定程度的降低。这是因为酶的活性部位对反应体系的pH变化比较敏感,解离状态随pH变化而变化,这些变化会影响酶的空间构象,使蛋白酶的活力下降,反应达到一定的限度。综合考虑,选择木瓜蛋白酶pH为6.5。
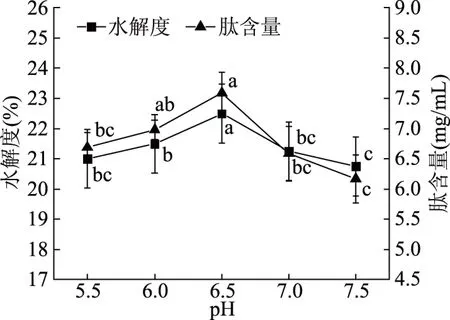
图7 pH对木瓜蛋白酶酶解效果的影响Fig.7 Effect of pH on enzymatic hydrolysis by papain
2.4.2 加酶量对酶解效果的影响 木瓜蛋白酶的加酶量对酶解工艺的影响见图8,在加酶量为2000~4000 U/g范围内,随着加酶量的增加,水解度和肽含量逐渐增加,没有分解的大分子蛋白逐渐分解成小分子肽;当加酶量大于5000 U/g时,酶解达到饱和状态,过量的酶不能与底物充分接触,无法相互作用,因此再进一步增加酶量,使水解度和肽含量变化不显著。考虑生产成本,选择最佳加酶量为5000 U/g。

图8 加酶量对木瓜蛋白酶酶解效果的影响Fig.8 Effect of papain addition on enzymatic hydrolysis
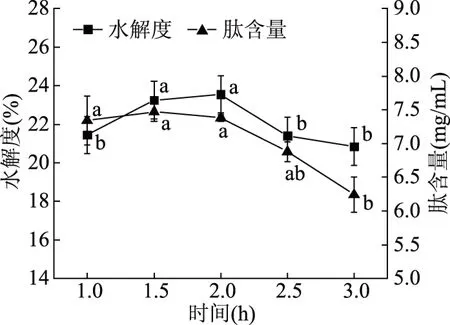
图9 时间对木瓜蛋白酶酶解效果的影响Fig.9 Effect of time on enzymatic hydrolysis by papain
2.4.3 时间对酶解效果的影响 由图9可知,当酶解时间为1.5 h时,肽含量达到最大值,此时的水解度大小与2 h的水解度相比变化不显著(P>0.05)。随着时间的延长,蛋白酶的活性开始逐渐下降,可见,木瓜蛋白酶酶解1.5 h后,随着时间的延长,汉麻分离蛋白基本水解完全,部分多肽分解为氨基酸分布在溶液中,使肽含量降低。与其他因素相比,时间对于水解度和肽含量的影响较低,可能是因为选择的时间范围较窄,在此范围内变化不明显。所以,综合考虑选择酶解时间1.5 h,此时水解度为23.25%,肽含量为7.47 mg/mL。
2.4.4 温度对酶解效果的影响 由图10可知,当温度为45~50 ℃时,水解度和肽含量逐渐增大,可能是由于温度的升高,使酶活性中心与反应底物分子之间有效碰撞的几率增大;当温度为50 ℃时水解度和肽含量都达到最大值,当温度大于50 ℃时,水解度和肽含量缓慢下降,可能是温度过高,破坏了蛋白酶的特定空间构象,从而使酶活中心受到破坏,蛋白酶活性急剧下降,酶解效果降低。因此,选择温度为50 ℃。

表9 回归模型方差分析Table 9 Variance analysis for the regression model

图10 木瓜蛋白酶温度对酶解效果的影响Fig.10 Effect of temperature on enzymatic hydrolysis by papain
2.4.5 木瓜蛋白酶水解条件优化 选用木瓜蛋白酶进行第二步酶解,在单因素实验的基础上,固定底物浓度为5%,水解时间为1.5 h,选择影响因素较大的pH(A)、温度(B)、加酶量(C)进行二次回归分析,以水解度(Y1)和肽含量(Y2)为响应值进行响应面优化试验,试验方案及结果见表8。

表8 Box-Behnken试验设计与结果Table 8 Andexperimental results of Box-Behnken experimental design
采用Design-Expert V 8.0.6软件对试验数据进行回归分析,得到的回归方程为:
Y1=25.46-0.14A-1.17B+0.31C-0.70AB+0.35AC+0.99BC - 1.92A2- 1.58B2- 1.13C2;
Y2=8.08+0.12A - 0.37B+0.2C-0.3AB-0.04AC+0.29BC - 0.54A2- 0.6B2- 0.42C2。
对方程进行显著性及方差分析,结果见表9。
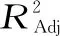
图11 水解度交互作用分析Fig.11 Interaction analysis of degree of hydrolysis

图12 肽含量交互作用分析Fig.12 Interaction analysis of peptide content
该模型中三个因素对响应值的影响强弱可用F值来进行评价,各因素对汉麻蛋白肽的水解度和肽含量的影响顺序为:温度>加酶量>pH,其中温度的影响极显著(P<0.01),加酶量对肽含量影响显著(P<0.05),pH影响不显著。对于因素间的交互作用,模型中AB和BC交互作用对肽含量影响显著(P<0.05),BC交互作用对水解度影响显著(P<0.05)。根据Design Expert软件得出的回归模型各因素相互之间作用如图11和图12所示。BC交互作用对水解度影响显著,AB、BC交互作用对肽含量影响显著(P<0.05),与方差分析结果一致。
该模型得到的木瓜酶酶解最佳工艺条件为:pH为6.44,温度为50.49 ℃,加酶量为5006.49 U/g,此时预测水解度的为24.68%,肽含量为8.54 mg/mL。为了进一步验证模型的可靠性,考虑到实际生产操作,将最佳酶解工艺调整为:pH为6.5,温度为50 ℃,加酶量为5000 U/g,并在此条件下重复3次试验,实测水解度为24.48%,肽含量为8.48 mg/mL,与预测值较为接近,说明模型拟合较好。
2.5 汉麻蛋白肽抗氧化能力评价
DPPH自由基是一种稳定的含氮自由基,与乙醇溶液相混合后呈紫色,并在517 nm处具有最大的吸收峰[29]。抗氧化剂清除自由基的方式是通过自身的还原作用来给出电子,还原能力越强,代表其抗氧化活性就越强[30]。因此,当吸光度越大时,还原能力越强,说明抗氧化活性也越强。试验研究了HPI酶解前后的DPPH自由基清除率和铁还原能力。由实验结果(图13、图14)可知,随着样品浓度的不断增大,HPI和HPH的DPPH自由基清除率和铁还原能力均不断增加,阳性对照VC的活性最强,其中HPI的DPPH自由基清除率的IC50值为8.97 mg/mL,HPH的IC50值为6.37 mg/mL。且HPI酶解后的抗氧化能力均强于HPI本身,当样品浓度为10 mg/mL时,DPPH自由基清除率达到了82.32%,铁还原能力增加了29.6%,可能是蛋白酶对HPI水解后,大分子肽链被切断,HPI的分子构象发生变化,暴露出其内部结构,一些具有抗氧化能力的氨基酸残基也逐渐暴露出来,如色氨酸(Trp)、酪氨酸(Tyr)、组氨酸(His)和苯丙氨酸(Phe)等,这些氨基酸经研究具有抗氧化活性[31],王庆玲[32]在热处理和pH偏移条件下对HPI的氨基酸组成的影响研究中,经测定含有这些具有抗氧化性的氨基酸且种类丰富,从而使HPI经过酶解后其抗氧化能力明显上升。

图13 不同浓度样品的DPPH自由基清除率结果Fig.13 Results of scavenging rate of DPPH free radicals of samples with different concentrations

图14 不同浓度样品的铁还原能力结果Fig.14 Results of iron reduction capacity of samples at different concentrations
3 结论
本研究采用碱性蛋白酶和木瓜蛋白酶复合分步酶解的方式制备汉麻蛋白肽。最终得到的最佳工艺条件为:碱性蛋白酶加酶量为10100 U/g,pH为8.5,温度为54 ℃,酶解时间2 h;第二步木瓜蛋白酶加酶量为5000 U/g,pH为6.5,温度为50 ℃,酶解时间1.5 h,分步酶解后得到的汉麻蛋白水解物的水解度和肽含量分别为24.48%和8.48 mg/mL。抗氧化结果表明汉麻多肽具有较好的DPPH自由基清除能力和铁还原能力,说明汉麻抗氧化肽具有市场潜力,在食品保健领域有一定的开发利用价值。同时此工艺也为今后高F值汉麻寡肽的制备提供一定的理论基础。今后还将对汉麻多肽的的结构、氨基酸组成和序列进行进一步分析。
