外界因素和杜仲叶提取物对双乙酸钠的抑菌活性影响
2021-06-16杨秋玲王志宏彭密军宁礼信
杨秋玲,王 翔,王志宏,黄 韬,彭密军,*,宁礼信
(1.广东省科学院测试分析研究所(中国广州分析测试中心),广东广州 510070; 2.广东中测食品化妆品安全评价中心有限公司,广东中山 528437)
食品成分复杂,蛋白质、脂肪和碳水化合物等食品基质容易对食品防腐剂或天然抑菌剂的抑菌活性产生影响[1-3]。食品中丰富的营养,可能与抑菌成分发生作用,降低其抑菌活性。此外,食品从生产到消费过程中经历了复杂的环境变化,这些外界环境因素也可能对其抑菌活性产生影响,尤其是温度和pH[4-5]。双乙酸钠(sodium diacetate,SDA)作为一种新型的高效低毒防霉、防腐剂和保鲜剂,具有安全、无残留、无致癌、无致畸变等优点,是山梨酸钾、苯甲酸钠、丙酸钙等防腐剂的理想替代产品,其在美国、德国、日本等发达国家已得到普遍使用[6-8],目前在我国豆制品、肉制品、水产品、调味品等领域也有广泛应用[9-12]。但是,实际应用中的食品基质和食品加工条件对SDA抑菌活性的影响尚缺乏系统研究。
天然抑菌剂因其来源广泛、安全高效等优点,在食品保鲜、包装和加工方面有着广阔的应用前景和研究价值[13-15]。研究表明杜仲叶(EucommiaulmoidesOliv. leaves)具有多种活性成分(如绿原酸、京尼平苷酸等)及药理活性,其提取物更是具有广谱抑菌活性,对革兰氏阳性菌和革兰氏阴性菌都有良好的抑制作用[16]。研究杜仲叶提取物对SDA的抑菌效果是否具有增效作用,对于减少化学抑菌剂的使用,拓宽其应用范围具有重要作用。
鉴于此,本试验以SDA为研究对象,通过动力学方程拟合细菌生长曲线,以细菌生长的迟缓期λ和最大比生长速率μmax为考查指标,研究其在不同食品基质和加工条件等外界因素干扰下,对沙门氏菌、金黄色葡萄球菌的抑制效果及探讨其影响规律,并采用棋盘法评价其与杜仲叶提取物的联合抑菌效果,为进一步开发以SDA为主的绿色食品添加剂提供理论参考。
1 材料与方法
1.1 材料与仪器
沙门氏菌SalmonellatyphimuriumATCC 14028、金黄色葡萄球菌StaphylococcusaureusATCC 25923 中国广州分析测试中心微生物实验室提供;营养琼脂、脑-心浸出液肉汤(BHI)、水解酪蛋白胨(MH)肉汤、牛肉浸粉(总氮12%,氨基氮2.5%) 广东环凯微生物科技有限公司;双乙酸钠、可溶性淀粉 上海麦克林生化科技有限公司;杜仲叶提取物 参考课题组前期最优工艺制备,测得总多酚含量14.49%[16]。
BHC-1200-11-A2型生物安全柜 苏州市华宇净化设备有限公司;HVE-50型高压灭菌锅 日本HIRAYMA公司;SHP-150型生化培养箱 广东环凯微生物科技有限公司;SHA-CA型恒温水浴振荡器 上海汗诺仪器有限公司。
1.2 实验方法
1.2.1 SDA抑菌实验
1.2.1.1 培养基的制备 营养琼脂培养基:称取营养琼脂33 g,加入去离子水1 L,搅拌加热煮沸至完全溶解,分装三角瓶。BHI液体培养基:称取脑-心浸出液肉汤(BHI)37 g,加入去离子水1 L,搅拌加热煮沸至完全溶解,分装试管。MH液体培养基:称取水解酪蛋白胨(MH)肉汤21 g,加入去离子水1 L,搅拌加热煮沸至完全溶解,分装试管。将配制好的培养基,于121 ℃高压灭菌15 min。
1.2.1.2 菌悬液的制备 在无菌条件下,将供试菌种接种于普通营养琼脂培养基上,37 ℃恒温培养24 h。分别挑取一环已活化的菌置于10 mL灭菌液体培养基内,37 ℃摇床培养24 h制成菌悬液后测定其细菌浓度,并调整其菌液浓度为106~107CFU/mL,现配现用。
1.2.1.3 最低抑菌浓度(MIC)的测定 配制56 mg/mL SDA溶液。往第1~11号试管中加入2 mL MH液体培养基后,再往1号试管再加入2 mL SDA样品母液,混合均匀。从1号试管中移取2 mL样品稀释液至第2管,以此类推,直至11管,从11管中吸2 mL弃去,再分别往1~11号试管中加入2 mL浓度为106~107CFU/mL的菌悬液,12号试管中加入无菌液体培养基作为阴性对照。由此可得浓度为28.00、14.00、7.00、3.50、1.75、8.75×10-1、4.38×10-1、2.19×10-1、1.10×10-1、5.47×10-2、2.74×10-2mg/mL的样品稀释溶液。将上述配好的溶液放置恒温培养箱内,37 ℃培养24 h后观察结果。若观察到试管中几乎无浑浊现象,则其对应的样品浓度为此样品的MIC值。每个样品做3个平行测试。
1.2.2 不同食品基质对SDA抑菌活性的影响
1.2.2.1 蛋白质对SDA抑菌活性的影响 参照Gutierrez等[3]方法并稍作修改。将不同质量的牛肉浸粉加入到MH培养基中,配成低、中、高浓度牛肉汤培养基(W/W),其中1%为低浓度、3%和5%为中浓度,10%为高浓度。分别取0.50 mL SDA溶液到1.50 mL不同浓度的牛肉汤培养基中,使得试管中的SDA溶液的最终浓度为1/2MIC,最后加入2 mL浓度约为106~107CFU/mL的菌悬液,混匀后于37 ℃恒温条件下培养36 h。不添加SDA作为阳性对照,添加SDA而不添加菌悬液作为阴性对照。每2 h用酶标仪在600 nm下测定吸光度,计算细菌个数,并用Modified Gompertz生长模型进行S形曲线拟合,计算迟缓期λ和最大比生长速率μmax。试验重复1次,每次处理3个平行。
1.2.2.2 蛋白质对SDA MIC的影响 参照1.2.1.3方法并稍作修改。配制56 mg/mL SDA溶液。将不同质量的牛肉浸粉加入到MH培养基中,配成低、中、高浓度牛肉汤培养基(W/W),其中低浓度为1%、中浓度为3%和5%,高浓度为10%。后续试验步骤按1.2.1.3进行。
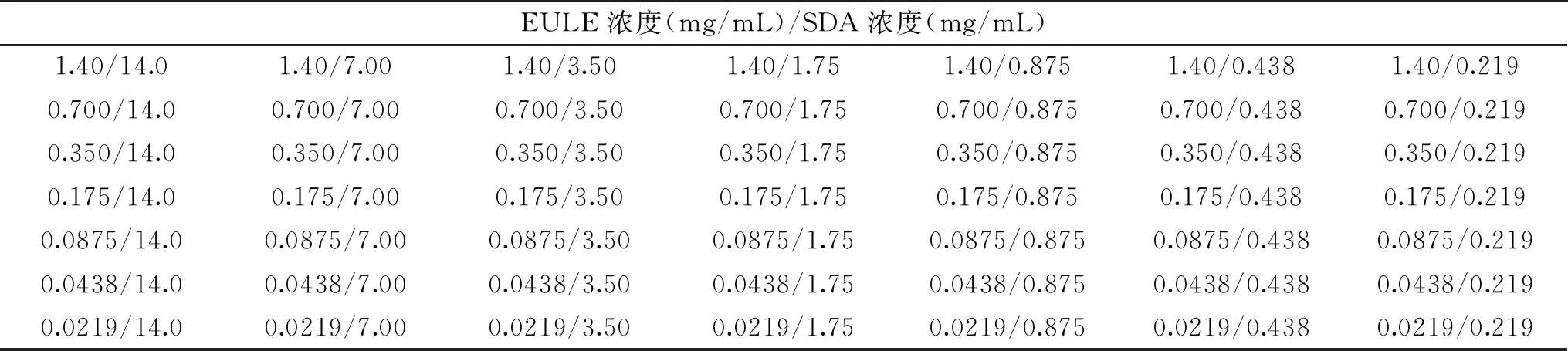
表1 沙门氏菌棋盘法示意表Table 1 Schematic diagram of checkerboard method for Salmonella typhimurium

表2 金黄色葡萄球菌棋盘法示意表Table 2 Schematic diagram of checkerboard method for Staphylococcus aureus
1.2.2.3 碳水化合物对SDA抑菌活性的影响 参照1.2.2.1方法并稍作修改。将不同质量的可溶性淀粉加入到MH培养基中,配成低、中、高浓度淀粉培养基(W/W),其中低浓度为1%、中浓度为3%和5%,高浓度为7%。分别取0.50 mL SDA溶液到1.50 mL不同浓度的淀粉培养基中,最后加入2 mL稀释后的菌悬液,混匀后于37 ℃恒温条件下培养36 h,后续检测方法同1.2.2.1。
1.2.2.4 碳水化合物对SDA MIC的影响 配制56 mg/mL SDA溶液。将不同质量的可溶性淀粉加入到MH培养基中,配成低、中、高浓度淀粉培养基(W/W),其中低浓度为1%、中浓度为3%和5%,高浓度为7%。后续试验步骤按1.2.1.3进行。
1.2.3 不同加工条件对SDA抑菌活性的影响
1.2.3.1 温度对SDA抑菌活性的影响 研究室温、巴氏杀菌、高温和超高温处理对SDA抑菌活性的变化。将SDA分别放入60、73、121、138 ℃烘箱中,过夜烘干直至恒重,备用。SDA放在室温(25 ℃)作为对照。参照1.2.2.1方法并稍作修改。分别取不同温度处理后的SDA溶液0.50 mL加到1.50 mL MH培养基中,最后加入2 mL稀释后的菌悬液,混匀后于37 ℃恒温条件下培养36 h,后续检测方法同1.2.2.1。
1.2.3.2 温度对SDA MIC的影响 配制经不同温度处理后的SDA溶液,浓度为56 mg/mL。后续试验步骤同1.2.1.3保持不变。
1.2.3.3 pH对SDA抑菌活性的影响 用1 mol/L的HCl和NaOH溶液调节MH培养基pH为4.50、5.50、6.50、7.50(原MH培养基的pH为7.50,1.2.3.4同)、8.50。参照1.2.2.1方法,取0.50 mL SDA溶液加到1.50 mL不同pH的MH培养基中,最后加入2 mL用不同pH的MH培养基稀释后的菌悬液,混匀后于37 ℃恒温条件下培养36 h,后续检测方法同1.2.2.1。
1.2.3.4 pH对SDA MIC的影响 配制56 mg/mL SDA溶液。用1 mol/L的HCl和NaOH溶液调节MH培养基pH为4.50、5.50、6.50、7.50、8.50。其余试验步骤同1.2.1.3保持不变。
1.2.4 杜仲叶提取物联合SDA抑菌作用的测定与评价 采用1.2.1.3方法分别测定EULE对沙门氏菌和金黄色葡萄球菌的MIC值,并稍作修改。棋盘法评价SDA和EULE的联合抑菌效果,按Schelz等[17]方法并稍作修改。根据上述MIC值配制一定浓度的SDA和EULE溶液(浓度为各细菌MIC的4倍),用MH培养基稀释各溶液成所需的工作液(4~1/16 MIC)。取49根试管按7×7依次排好后,分别取2 mL工作液按浓度从高到低依次加入到试管中,最后再加入2 mL稀释后的菌悬液(各组试管中细菌终浓度约为106~107CFU/mL),混匀后于37 ℃恒温条件下培养24 h,试管中几乎无浑浊现象所对应的样品浓度作为该样品的MIC值。由此可得沙门氏菌棋盘法中的SDA终浓度为14.00、7.00、3.50、1.75、0.875、0.438、0.219 mg/mL,EULE终浓度为1.40、0.700、0.350、0.175、0.0875、0.0438、0.0219 mg/mL,如表1所示。金黄色葡萄球菌棋盘法中的SDA终浓度为14.0、7.00、3.50、1.75、0.875、0.438、0.219 mg/mL,EULE终浓度为0.700、0.350、0.175、0.0875、0.0438、0.0219、0.0110 mg/mL,如表2所示。每个样品做3个平行测试。
分级抑菌浓度指数(fractional inhibitory concentration index,FICI)计算公式为FICI=MIC(EULE+SDA联合)/MIC(SDA单独)+MIC(EULE+SDA联合)/MIC(EULE单独)。联合作用效果评价标准依据Odds的建议[18]:FICI≤0.5为协同作用,0.5≤FICI≤1为相加作用,1
1.3 数据处理

2 结果与分析
2.1 SDA最低抑菌浓度(MIC)的测定
根据试验结果得知,SDA对沙门氏菌的MIC值为7.00 mg/mL,对金黄色葡萄球菌的MIC值为7.00 mg/mL。
2.2 不同食品基质对SDA抑菌活性的影响
2.2.1 蛋白质对SDA抑菌活性的影响 沙门氏菌和金黄色葡萄球菌在MH培养基(牛肉浸粉浓度为0%)和不同浓度牛肉汤培养基中的生长情况,结果如图1和图2。随着牛肉浸粉浓度的升高,阳性对照组中沙门氏菌和金黄色葡萄球菌的最大比生长速率显著大于MH培养基(P<0.05)。当牛肉浸粉浓度为10%时,其迟缓期显著长于MH培养基(P<0.05),而低浓度下的迟缓期和MH培养基无差异。总体而言,牛肉汤培养基同MH培养基一样,适合细菌的培养。
如图1所示,样品组中沙门氏菌的迟缓期随牛肉浸粉浓度的升高呈上升趋势,且比相同浓度的阳性对照组的时间长;不同浓度牛肉汤培养基中沙门氏菌的最大比生长速率和MH培养基无差异(P>0.05),但显著低于相同浓度的阳性对照组(P<0.05)。由图2可知,金黄色葡萄球菌的迟缓期与沙门氏菌的迟缓期变化趋势一致。而在牛肉浸粉质量浓度增加时,金黄色葡萄球菌的最大比生长速率显著增大(P<0.05)。而当浓度上升至10%时,其最大比生长速率比相同浓度的阳性对照组。表明在此浓度蛋白质的作用下,SDA的抑菌活性可能被减弱。

图1 沙门氏菌在不同牛肉汤培养基中(SDA)的 迟缓期(A)和最大比生长速率(B)Fig.1 Lag phase(A)and maximum specific growth rate(B)of Salmonella typhimurium in different beef extract media containing SDA注:图中相同小写字母或无字母表示处理组 差异不显著(P>0.05),不同小写字母表示 差异显著(P<0.05);图2~8同。

图2 金黄色葡萄球菌在不同牛肉汤培养基中(SDA)的 迟缓期(A)和最大比生长速率(B)Fig.2 Lag phase(A)and maximum specific growth rate(B)of Staphylococcus aureus in different beef extract media containing SDA
2.2.2 蛋白质对SDA MIC的影响 由表3可知,当牛肉浸粉浓度为1%、3%和5%时,SDA的MIC值与牛肉浸粉浓度为0时一致;当浓度为10%时,SDA的MIC值升高。由此可见,高浓度蛋白质(10%牛肉浸粉)对SDA的抑菌效果产生负面影响。
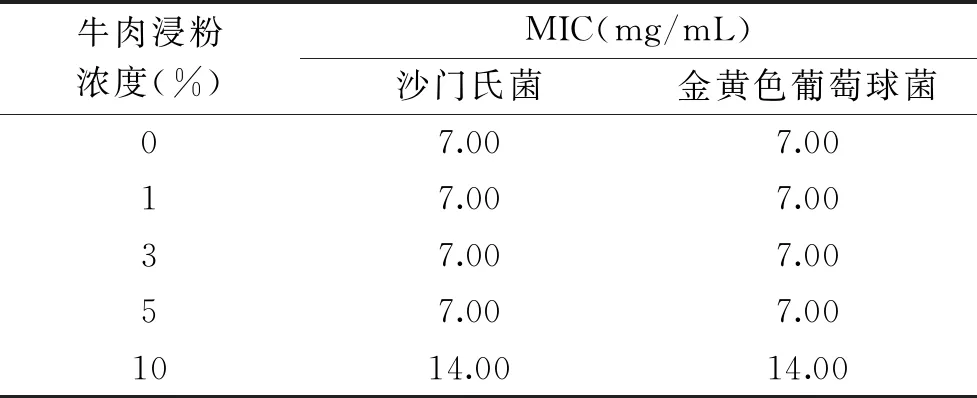
表3 不同牛肉汤培养基对SDA MIC的影响 Table 3 Effect of different beef extract media on SDA MIC
实验结果表明,在高浓度蛋白质培养基中,SDA可显著延长沙门氏菌和金黄色葡萄球菌的迟缓期,但也增大金黄色葡萄球菌的最大比生长速率和这两种致病菌的MIC值。说明高浓度蛋白质可使SDA的抑菌活性减弱。Gutierrez等[3]研究表明,某些天然抑菌物质如牛至和百里香也有类似效果,其原因可能是过量的蛋白质相比于成品培养基中半合成的蛋白胨更难被细菌所利用。此外,前期研究表明,蛋白质对微生物具有缓冲作用,且基质中的蛋白质是微生物生长的营养成分,丰富的营养会加速微生物的自我修复。Smith-Palmer等[19]以及Devlieghere等[2]研究发现,蛋白质可促进细菌的生长,减弱活性成分的抑菌作用。因此,在高蛋白食品中应尽可能避免添加SDA为食品添加剂。
2.2.3 碳水化合物对SDA抑菌活性的影响 沙门氏菌和金黄色葡萄球菌在MH培养基(可溶性淀粉浓度为0%)和不同浓度淀粉培养基中的生长情况,结果如图3和图4。不同浓度淀粉培养基与MH培养基相比,阳性对照组中的沙门氏菌通过缩短迟缓期或增大最大比生长速率的方式来促进生长;而阳性对照组中的金黄色葡萄球菌在1%和3%碳水化合物浓度下的生长与0%时无差异,在5%和7%浓度下则是通过延长迟缓期和增大最大比生长速率的方式来促进生长。总体而言,相对于MH培养基,这两种细菌在淀粉培养基中可以很好生长。

图3 沙门氏菌在不同淀粉培养基中(SDA)的 迟缓期(A)和最大比生长速率(B)Fig.3 Lag phase(A)and maximum specific growth rate(B)of Salmonella typhimurium in different starch media containing SDA
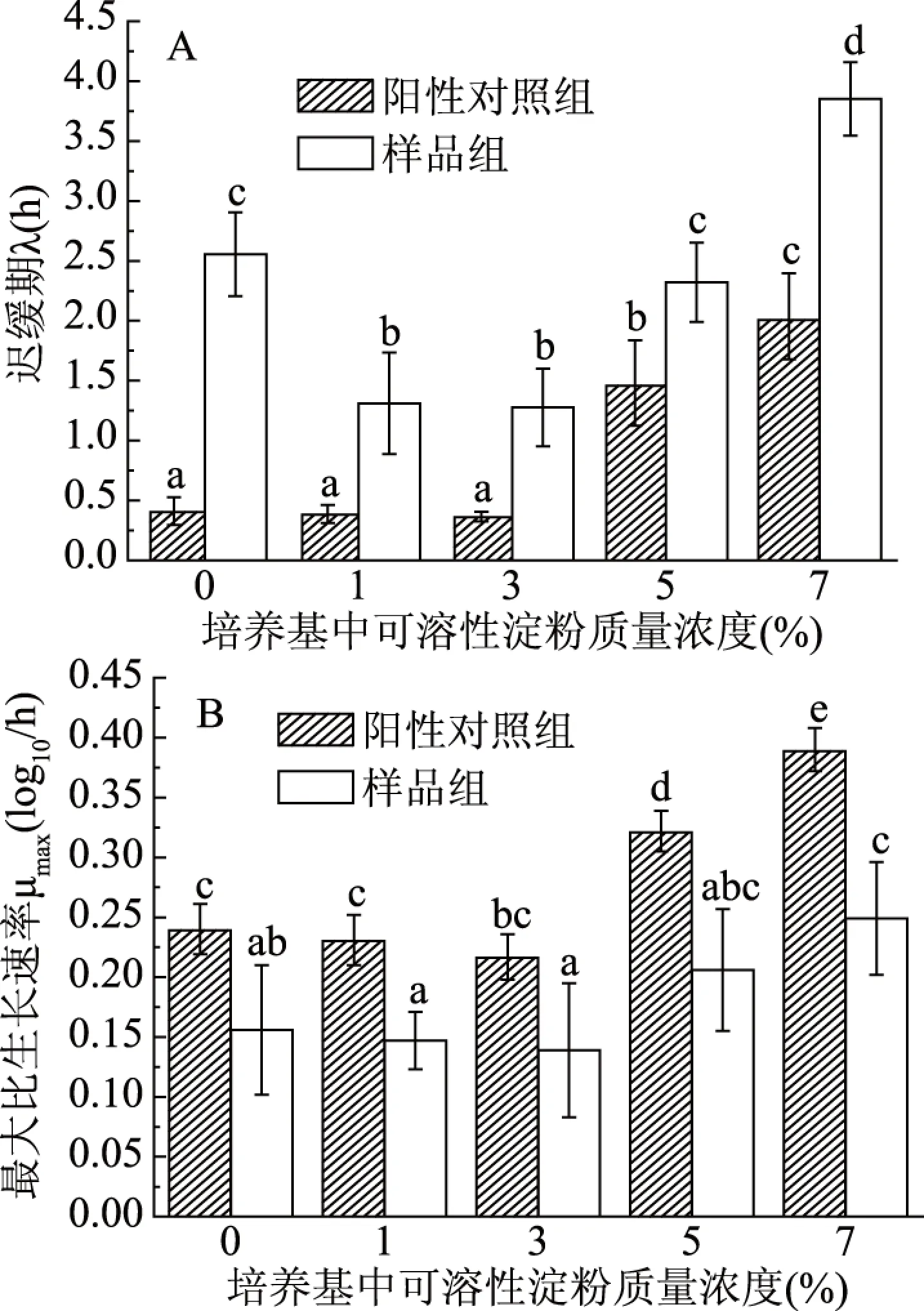
图4 金黄色葡萄球菌在不同淀粉培养基中(SDA)的 迟缓期(A)和最大比生长速率(B)Fig.4 Lag phase(A)and maximum specific growth rate(B)of Staphylococcus aureus in different starch media containing SDA
样品组中沙门氏菌和金黄色葡萄球菌的迟缓期变化趋势基本一致,随可溶性淀粉浓度的升高先缩短后延长,且在浓度为7%时的迟缓期显著长于MH培养基(P<0.05)。在不同浓度淀粉培养基中,各样品组的迟缓期显著长于相同浓度的阳性对照组(P<0.05)(图3A和图4A)。同样,沙门氏菌和金黄色葡萄球菌的最大比生长速率变化趋势一致,其中在高浓度(5%和7%)下显著大于MH培养基(P<0.05),且各样品组的最大比生长速率比相同浓度的阳性对照组的小(图3B和图4B)。表明在淀粉培养基中,SDA对沙门氏菌生长和金黄色葡萄球菌的抑制作用依旧较为显著,但高浓度碳水化合物(7%可溶性淀粉)可能使SDA的抑菌活性减弱。
2.2.4 碳水化合物对SDA MIC的影响 由表4可知,当可溶性淀粉浓度为0、1%、3%和5%时,SDA对沙门氏菌的MIC无差异,而当浓度为7%时,SDA的MIC值升高。在实验浓度范围内,SDA对金黄色葡萄球菌的MIC并无差异。由此可见,高浓度碳水化合物(7%可溶性淀粉)可升高SDA对沙门氏菌的MIC值,对金黄色葡萄球菌的MIC却无影响。Gutierrez等[3]研究发现,适当浓度的碳水化合物对细菌起保护作用,当培养基中淀粉浓度在5%或10%时,可减弱牛至和百里香的抑菌活性。Devlieghere等[2]报道了碳水化合物对细菌的保护作用,30%的淀粉可减弱壳聚糖的抑菌活性。Ofman等[20]也表明木薯淀粉可减弱防腐剂的抗菌效果,但Shelef等[21]研究结果却表明,高浓度碳水化合物(5.80%或11.6%)对精油的抑菌效果无影响。因此,在高碳水化合物食品中应尽可能避免添加SDA为食品添加剂。
2.3 不同加工条件对SDA抑菌活性的影响
2.3.1 温度对SDA抑菌活性的影响 研究室温、60、73、121、138 ℃五种温度处理后的SDA对沙门氏菌和金黄色葡萄球菌抑菌活性的影响,结果如图5和图6。与室温相比,样品组中沙门氏菌和金黄色葡萄球菌的迟缓期随温度的升高逐渐缩短,最大比生长速率逐渐增大。表明温度越高,SDA的抑菌活性越弱。当温度为60 ℃时,沙门氏菌和金黄色葡萄球菌的迟缓期和最大比生长速率与室温相比无明显差异,表明SDA在此条件下仍具有一定的抑菌活性,当温度为138 ℃时,金黄色葡萄球菌的迟缓期与阳性对照组无差异,最大比生长速率比阳性对照组的大(P<0.05)。表明SDA对金黄色葡萄球菌的抑菌活性可能完全丧失。

图5 在不同处理温度的SDA抑制下, 沙门氏菌的迟缓期(A)和最大比生长速率(B)Fig.5 Lag phase(A)and maximum specific growth rate(B)of Salmonella typhimurium in MH media containing SDA at different treatment temperatures

图6 在不同处理温度的SDA抑制下, 金黄色葡萄球菌的迟缓期(A)和最大比生长速率(B)Fig.6 Lag phase(A)and maximum specific growth rate(B)of Staphylococcus aureus in MH media containing SDA at different treatment temperatures
2.3.2 温度对SDA MIC的影响 由表5可知,当温度为室温、60和73 ℃时,SDA对沙门氏菌和金黄色葡萄球菌的MIC值没有显著差别。当温度上升至121和138 ℃时,其MIC值随之升高。
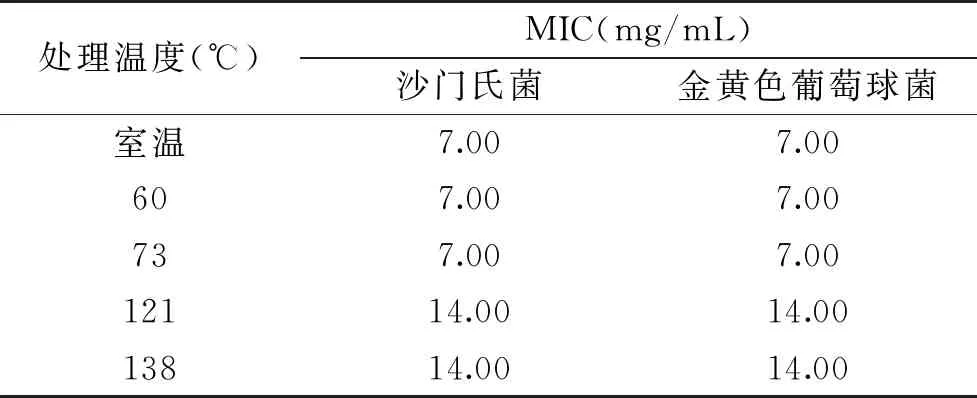
表5 不同处理温度对SDA的 MIC的影响Table 5 Effect of different treatment temperatures on SDA MIC
实验结果显示,随着温度的升高,SDA对沙门氏菌和金黄色葡萄球菌的抑菌活性逐渐减弱。当温度为121和138 ℃时,沙门氏菌和金黄色葡萄球菌的MIC增大。推测可能是因为双乙酸钠在高温下受热分解,其抑菌效果也随之减弱。因此,在以SDA为食品添加剂时,不宜将其置于高温条件下进行加工。
2.3.3 pH对SDA抑菌活性的影响 沙门氏菌和金黄色葡萄球菌在不同pH环境下的生长情况,结果如图7和图8。阳性对照组中沙门氏菌和金黄色葡萄球菌能够在不同pH的培养基中生长。当实验组中pH为4.5、5.5和6.5时,未检测到迟缓期和最大比生长速率,表明沙门氏菌和金黄色葡萄球菌可能生长停止。说明在酸性环境下,SDA的抑菌活性增强。与pH为7.5相比,沙门氏菌和金黄色葡萄球菌在pH为8.5时的迟缓期显著缩短,最大比生长速率显著增大(P<0.05)。表明此pH条件下,SDA的抑菌活性减弱。
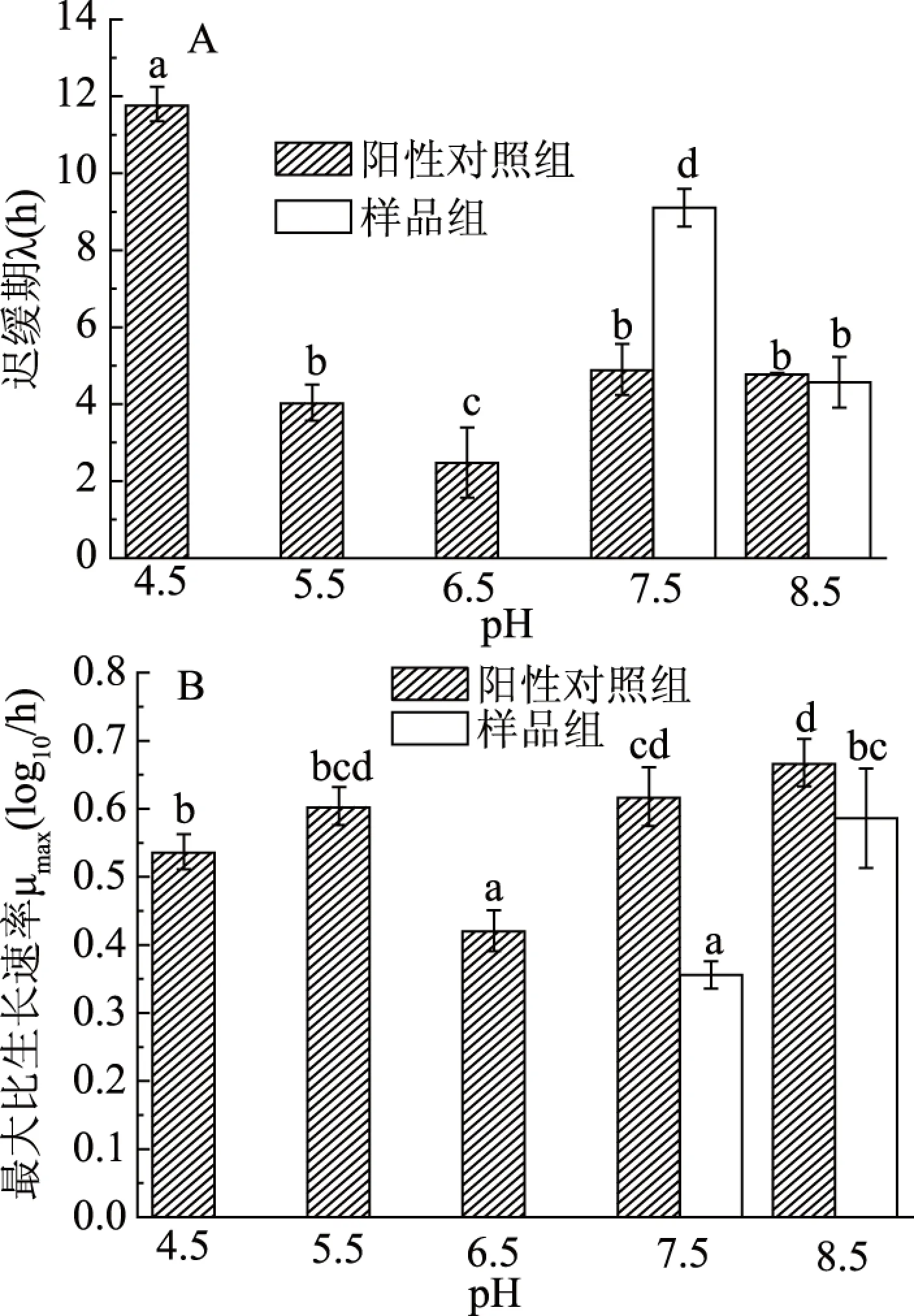
图7 不同pH培养基中(SDA)沙门氏菌的 迟缓期(A)和最大比生长速率(B)Fig.7 Lag phase(A)and maximum specific growth rate(B)of Salmonella typhimurium in different pH media containing SDA

图8 不同pH培养基中(SDA)金黄色葡萄球菌的 迟缓期(A)和最大比生长速率(B)Fig.8 Lag phase(A)and maximum specific growth rate(B)of Staphylococcus aureus in different pH media containing SDA
2.3.4 pH对SDA MIC的影响 由表6可知,与pH为7.5的MIC值相比,pH为4.5、5.5和6.5的SDA MIC值减小,pH为8.5的SDA MIC值增大。表明在酸性环境下,SDA的抑菌活性增强;在碱性环境下,SDA的抑菌活性减弱。

表6 不同pH培养基对SDA MIC的影响Table 6 Effect of different pH media on SDA MIC
本实验中,培养基中pH会对SDA的抑菌作用产生影响。在酸性环境下,SDA对沙门氏菌、金黄色葡萄球菌的抑制作用增强;而当培养基的pH为8.5时,其对细菌的抑制作用减弱。SDA的抑菌作用来源于乙酸,其含有可释放的游离乙酸分子,在水溶液中呈酸性,释放出的乙酸能渗入菌体组织的细胞壁,干扰细胞内各种酶的体系而产生作用,使细胞内蛋白质变性、抑制微生物生长繁殖,从而起到抗菌作用[22-23],而在碱性环境下,其能与乙酸分子发生酸碱中和,从而减弱其抗菌作用。Campo等[24]和Hsieh等[25]研究发现,精油的抗菌活性随pH的降低而增加。
2.4 杜仲叶提取物联合SDA抑菌作用的测定与评价

表7 EULE的MIC值和其与SDA联合抑菌的FICI值Table 7 MIC vaules of EULE and FICI values of EULE+SDA combinations in MH media
由表7可知,杜仲叶提取物对沙门氏菌的MIC值为0.700 mg/mL,对金黄色葡萄球菌的MIC值为0.350 mg/mL。实验结果表明,沙门氏菌和金黄色葡萄球菌的FICI为1,说明杜仲叶提取物和双乙酸钠联合使用时表现为相加作用,能够部分替代SDA。
3 结论
食品基质(蛋白质和碳水化合物)和食品加工条件(温度和pH)能影响SDA对沙门氏菌和金黄色葡萄球菌的抑制效果。高浓度蛋白质(10%牛肉浸粉),高浓度碳水化合物(7%可溶性淀粉),高温处理(121和138 ℃)和碱性环境(pH8.5)可减弱SDA对沙门氏菌和金黄色葡萄球菌的抑菌活性,增大其MIC值,而酸性环境(pH为4.5、5.5和6.5)增强SDA的抑菌活性。SDA与EULE联用对抑菌效果有相加作用,该结果表明EULE可作为天然抑菌剂与SDA联合使用,并一定程度可起到替代作用,将扩宽其在食品领域的应用范围。
