柚皮素对甲状腺癌细胞凋亡、自噬的影响及其与AMPK/mTORC1通路的关系
2021-06-16张增岭施杲旸朱乃海陈涛
张增岭,施杲旸,朱乃海,陈涛
(1.江苏省人民医院浦口分院 普通外科,江苏 南京 211899;2.江苏省人民医院 普通外科,江苏 南京 210029)
甲状腺癌是全世界最普遍的内分泌实体瘤类型之一,其发病率呈逐年增加趋势[1-2]。在大多数患者中,手术后进行放射性碘或观察治疗是有效的,但是其他罕见的甲状腺癌亚型患者的靶向治疗只能延长生存期,因此迫切需要寻找新型有效的治愈性药物用于甲状腺癌的临床治疗[3]。柚皮素(naringenin,NAR)是从柑橘类植物中提取得到的黄酮类化合物,具有抗炎、抗病毒和抗肿瘤等作用[4-5]。在急性白血病HL-60细胞中,NAR能够激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)诱导细胞自噬和凋亡[6]。此外,AMPK/哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex 1,mTORC1)信号通路在调控细胞自噬和凋亡过程中至关重要[7-8],但NAR对甲状腺癌细胞增殖、凋亡和自噬的影响及其作用机制是否与AMPK/mTORC1途径相关尚不清楚。本实验旨在探索NAR对甲状腺癌细胞凋亡和自噬的影响,并初步探索其作用机制,以期为将NAR应用于甲状腺癌的临床治疗提供参考。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞甲状腺癌细胞株ACT-1 购自上海冠导生物工程有限公司,批号GD-C521997。
1.1.2 主要试剂和仪器AMPK 抑制剂(compound C)(杭州昊鑫生物科技股份有限公司,批号HY13418-1);DMEM 培养基、噻唑蓝(MTT)试剂、膜联蛋白V-异硫氰酸荧光素/ 碘化丙啶(Annexin V-FITC/PI)细胞凋亡检测试剂盒、RIPA 裂解液、ECL 发光液(北京Solarbio 公司,批号分别为11995、M8180、CA1020、R0010、PE0010);绿色荧光蛋白-微管相关蛋白1 轻链3(GFP-LC3)质粒试剂盒(上海远慕生物科技有限公司,批号AT-V192);兔抗人AMPK、磷酸化AMPK(p-AMPK)、核孔蛋白(p62)、微管相关蛋白1 轻链3(LC3)I、LC3II、mTORC1、磷酸化mTORC1(p-mTORC1)、半胱氨酸蛋白酶-3(caspase-3)、甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体、山羊抗人IgG 二抗(美国Thermo Fisher Scientific 公司,批号分别为MA5-32122、PA5-104982、PA1-16777、PA5-27357、PA5-27247、PA3-10054、PA3-11775、PA2-30472、A109226、A32731);CO2细胞培养箱(上海Heal Force 公司,型号HF160W);酶标仪、凝胶成像仪(美国Bio-Rad 公司,型号ELX081U、Gel DocTMXR+);流式细胞仪(美国贝克曼公司,型号CytoFLEX);荧光显微镜(德国蔡司公司,型号Axioplan 2 imaging E)。
1.2 实验方法
1.2.1 细胞培养将ACT-1 细胞用含有10% 胎牛血清的DMEM 培养基培养,置于37 ℃、5%CO2培养箱中孵育,每2 天更换1 次培养液,待细胞融合度达80% 左右,胰酶消化传代,收集细胞用于后续实验。
1.2.2 MTT 实验将ACT-1 细胞铺于96 孔板(密度4.5×104个/ 孔),用浓度为0、6.25、12.50、25.00、50.00、100.00 μg/mL 的NAR 处理12、24、48 h,每个浓度设置6 个复孔,每孔加入100 μLMTT,孵育4 h,加入二甲基亚砜(100 μL/ 孔)充分溶解,同时设置空白组(含有培养液、MTT、二甲基亚砜),使用酶标仪测量490 nm 处的OD 值,计算细胞存活率以及半数抑制率IC50值。然后根据IC50值,将实验分为对照组、NAR 低、中、高浓度组,分别使用含有NAR 浓度为0、25、50、100 μg/mL[9]的无血清DMEM 培养基培养24 h 后,用于后续实验。细胞存活率(%)=(实验组OD 值-空白组OD 值)/(对照组OD 值-空白组OD 值)×100%。
1.2.3 Annexin VP-FITC/PI 实验调整ACT-1细胞密度为1.2×106个/孔,铺于6 孔板,按1.2.2中分组及干预方法处理后,将各组细胞在无血清培养液培养24 h,进行Annexin V-FITC 和PI 染色,于流式细胞仪上检测各组凋亡情况。
1.2.4 GFP-LC3 转染检测自噬小体根据转染试剂盒说明书步骤转染GFP-LC3 质粒至细胞中,更换培养基孵育24 h,参照1.2.2 中分组及干预方法处理各组细胞24 h,荧光显微镜下观察细胞自噬活性情况(绿色点状聚集为自噬小体)。
1.2.5 Western blot 实验向对照组、3 个NAR浓度组细胞中加入RIPA 裂解液,提取总蛋白,并采用BCA 法测量蛋白含量。取25 μg 蛋白,经凝胶电泳、转膜、封闭、清洗后,加入一抗LC3I、LC3II、p62、p-AMPK、AMPK、p-mTORC1、mTORC1 和GAPDH(均为1:1000),孵育过夜,加入二抗(1:5000),曝光显影,分析条带。
1.2.6 AMPK 抑制剂干预实验将ACT-1 细胞随机分为空白对照组、NAR 组、AMPK 抑制剂组和NAR+AMPK 抑制剂组,分别用无血清培养基、100 μg/mLNAR 无血清培养基稀释液、25 μmol/LAMPK 抑制剂无血清培养基、100 μg/mLNAR+25 μmol/LAMPK 无血清培养基干预24 h。采用1.2.5 中方法检测各组细胞LC3I、LC3II、p62、caspase-3、p-AMPK、AMPK、p-mTORC1、mTORC1 和GAPDH 蛋白表达情况。
1.3 统计学处理
用统计学软件SPSS22.0分析实验数据,计量资料以平均数±标准差(±s)描述,多组间比较使用单因素方差分析,进一步两组间比较行SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 NAR 对ACT-1 细胞存活率的影响
用NAR处理后的ACT-1细胞存活率随浓度增加呈下降趋势,同时随NAR作用时间的延长,ACT-1细胞存活率逐渐下降(均P<0.05)(图1)。经软件分析算得NAR处理ACT-1细胞12、24、48 h的IC50值分别为85.65、50.12、38.94 μg/mL。后续实验选择NAR干预时间为24 h,药物浓度为25、50、100 μg/mL。
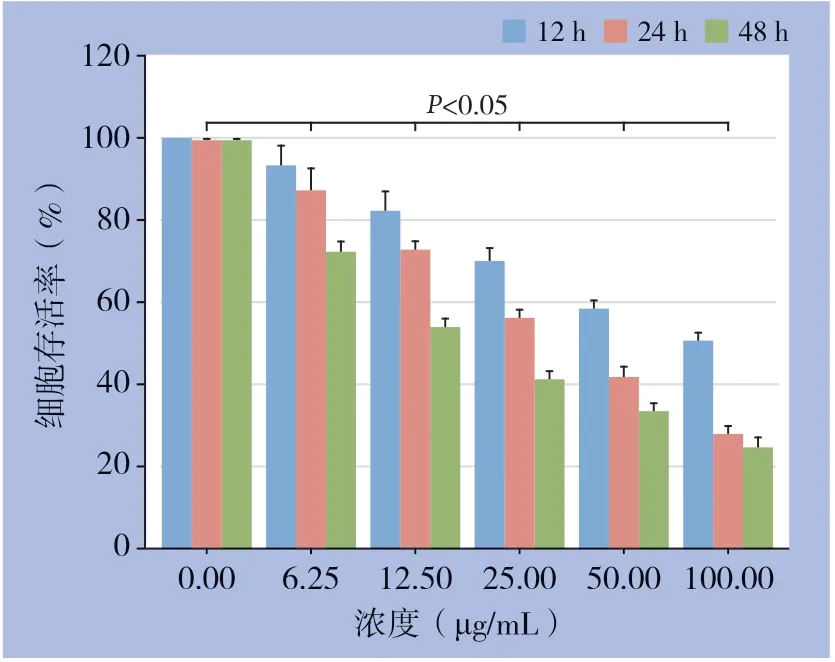
图1 NAR 对ACT-1 细胞存活率的影响Figure 1 The effects of NAR on the survival rate of ACT-1 cells
2.2 NAR 对ACT-1 细胞凋亡的影响
与对照组相比,3个浓度的NAR处理组ACT-1细胞凋亡率均明显增加,且呈浓度依赖性(均P<0.05)(图2)。

图2 NAR 对ACT-1 细胞凋亡的影响Figure 2 Effect of NAR on the apoptosis of ACT-1 cells
2.3 NAR 对ACT-1 细胞自噬的影响
转染GFP-LC3质粒后,与对照组相比,ACT-1细胞株经不同浓度NAR作用后,各组细胞内均出现自噬小体,且自噬小体数量随浓度增加呈逐渐增加趋势(图3)。

图3 NAR 对ACT-1 细胞自噬的影响(绿色荧光代表自噬小体)(×1000)Figure 3 Effect of NAR on autophagy of ACT-1 cells(green fluorescence showing hte autophagosomes)(×1000)
2.4 NAR 对自噬相关蛋白LC3II、LC3I 和p62蛋白表达的影响
与对照组比较,3个NAR处理组ACT-1细胞LC3II/LC3I蛋白表达水平均明显升高,而p62蛋白表达水平均明显降低,均呈浓度依赖性(均P<0.05)(图4)。
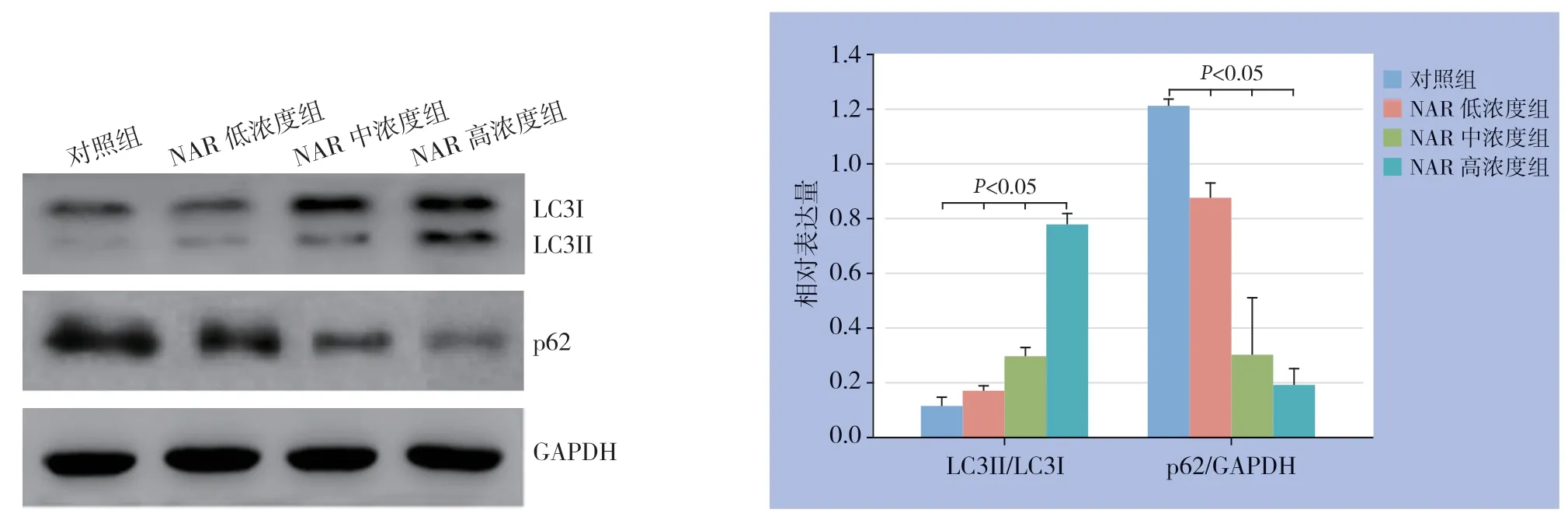
图4 各组ACT-1 细胞LC3II/LC3I 和p62 蛋白表达情况Figure 4 The expressions of LC3II/LC3I and p62 protein in each group of ACT-1 cells
2.5 NAR 对ACT-1 细 胞p-AMPK、AMPK、p-mTORC1 和mTORC1 蛋白表达的影响
与对照组比较,3个NAR处理组ACT-1细胞p-AMPK/AMPK 蛋白表达水平均明显升高,而p-mTORC1/mTORC1蛋白表达水平均明显降低,均呈浓度依赖性(均P<0.05)(图5)。

图5 各组ACT-1 细胞p-AMPK、AMPK、p-mTORC1 和mTORC1 表达情况Figure 5 Expressions of p-AMPK,AMPK,p-mTORC1 and mTORC1 in each group of ACT-1 cells
2.6 NAR 与AMPK 抑制剂共处理对各组细胞凋亡和自噬蛋白的影响
与空白对照组比较,NAR组p-AMPK/AMPK、LC3II/LC3I、caspase-3 蛋白表达明显升高,p-mTORC1/mTORC1和p 62 蛋白表达明显降低(均P<0.05);AMPK抑制剂组p-AMPK/AMPK、LC3II/LC3I、caspase-3 蛋白表达明显降低,p-mTORC1/mTORC1和p62蛋白表达明显升高(均P<0.05)。与NAR组比较,NAR+AMPK抑制剂组p-AMPK/AMPK、LC3II/LC3I、caspase-3蛋白表达明显降低,p-mTORC1/mTORC1和p62蛋白表达明显升高(均P<0.05)。与AMPK抑制剂组比较,NAR+AMPK抑制剂组ACT-1细胞p-AMPK/AMPK、LC3II/LC3I、caspase-3蛋白表达明显升高;p-mTORC1/mTORC1和p62蛋白表达明显降低(均P<0.05)(图6)。
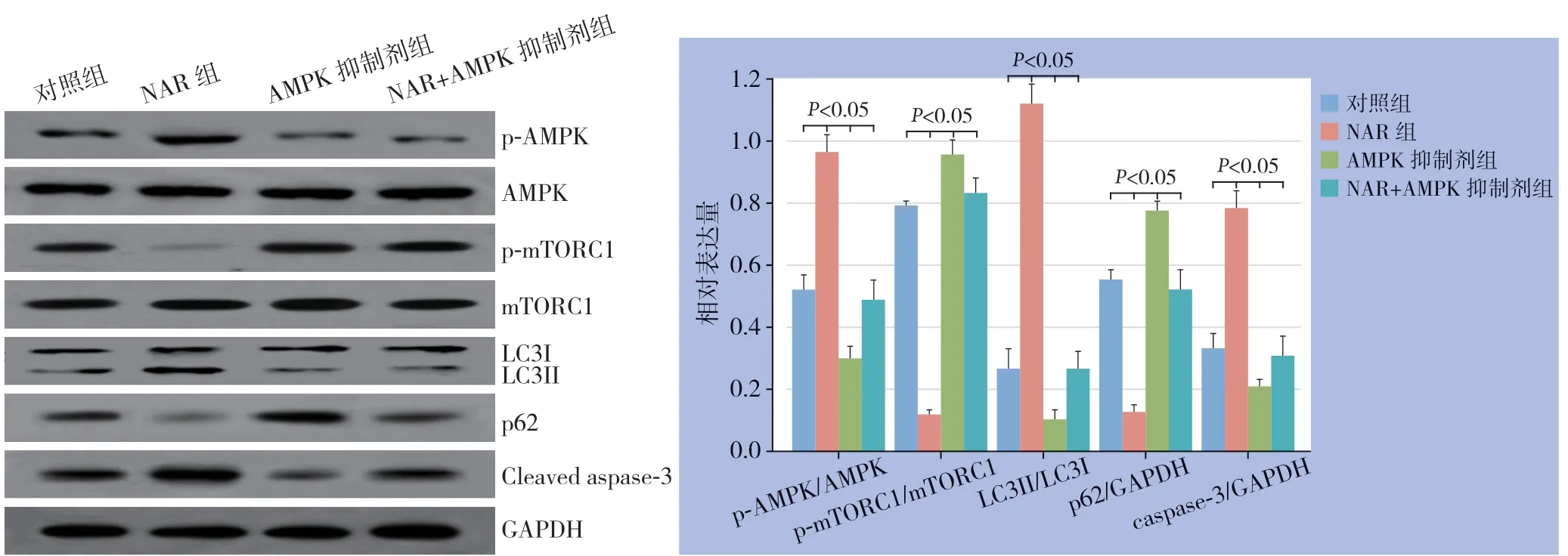
图6 各组ACT-1 细胞p-AMPK/AMPK、p-mTORC1/mTORC1、LC3II/LC3I、p62 和caspase-3 蛋白表达情况Figure 6 Expressions of p-AMPK/AMPK,p-mTORC1/mTORC1,LC3II/LC3I,p62 and caspase-3 in each group of ACT-1 cells
3 讨论
目前,手术和外科手术加放射性碘治疗(标准治疗)甲状腺癌会产生永久并发症,严重影响患者的生活质量[10]。此外,甲状腺后遗症可能在数年至数十年随访后出现,且它们产生的临床症状可能是惰性或非特异性的,给临床治疗带来挑战[11-12]。因此积极探索更有效的治疗药物以代替放射治疗可能有助于改善甲状腺癌的治疗现状。NAR作为一种柚皮苷苷元,由于其广泛的生物活性,而成为抗肿瘤方面研究的热点[13]。曾德贵等[14]发现,NAR能够抑制人肺鳞癌细胞增殖。本研究结果显示,ACT-1细胞经不同浓度NAR处理后,细胞存活率呈浓度依赖性下降,提示NAR对甲状腺癌细胞增殖具有抑制作用。
自噬是一种自降解系统,在癌症治疗过程中,它可以保护癌细胞免受化学疗法的侵害,也可以杀死凋亡途径不活跃的癌细胞[15]。此外,药物和饥饿等因素干预能够改变细胞自噬能力,以维持细胞稳态,参与组织发育、免疫调节和肿瘤发生发展等生理病理过程[16]。LC3I和LC3II是LC3的2种不同表现形式,在自噬形成期间,LC3I可以转化LC3II,因此LC3II含量与自噬膜囊泡数量呈正相关,通常以LC3II/LC3I比值作为自噬小体标记物来评价自噬的形成[17-18]。p62是细胞自噬的特异性底物,可用于检测自噬通量,其表达水平与自噬活性成反比[19]。研究[6]显示,NAR能够诱导白血病HL-60细胞自噬,抑制白血病的发展。本研究发现,NAR处理ACT-1细胞后,细胞凋亡率和LC3II/LC3I蛋白显著增加,p62蛋白显著降低,提示NAR干预后诱导了LC3I向LC3II转变。荧光显微镜下观察,NAR干预使绿色荧光富集,且绿色荧光强度随NAR浓度增加而增加,进一步表明NAR能够促进ACT-1细胞自噬体的形成。
细胞凋亡受细胞内外信号调节,其特征在于死亡靶细胞形态、线粒体膜通透性和凋亡小体等形成,该过程可维持细胞内环境的稳定,是细胞发育和程序性死亡的主要机制,在调控肿瘤发生发展中至关重要[20-21]。近期研究显示[9,13,22-23],NAR能够促进宫颈癌、胃癌、舌鳞癌及肝癌细胞凋亡。本研究用NAR处理ACT-1细胞后经流式分析发现,NAR可诱导细胞发生凋亡,且随NAR浓度的增加,凋亡率增加,提示NAR可诱导凋亡的发生。此外,自噬与凋亡之间存在的平衡过程在细胞存活和死亡中至关重要[24-25],因此推测NAR可能通过诱导ACT-1细胞自噬,从而促进其凋亡,发挥对甲状腺细胞的毒性作用,但其具体作用机制尚不清楚。
AMPK是一种重要的能量因子,可以协调细胞代谢途径,平衡营养供应和能量需求,在控制人类疾病中至关重要[26]。mTOR是细胞生长调节剂,能够形成mTORC1和mTORC2复合物,且由于其在癌症中被高度激活,成为提高癌症治疗效率的靶标[27]。此外,在胰腺癌细胞中,激活AMPK信号通路,能够降低mTOR磷酸化水平,诱导细胞自噬,抑制增殖[28]。徐琛莹等[29]发现,雌激素受体β能够通过激活AMPK/mTORC1轴,诱导自噬发生。本研究结果显示,ACT-1细胞经不同浓度NAR作用后,p-AMPK/AMPK蛋白表达显著升高,p-mTORC1/mTORC1蛋白表达显著降低,提示NAR可能通过调节AMPK/mTORC1信号通路,诱导甲状腺癌细胞自噬。caspase-3是细胞凋亡的效应蛋白,其受到凋亡刺激后会被激活,因而被称为“凋亡的执行者”[30]。为进一步验证AMPK/mTORC1信号通路在NAR治疗过程中的作用,使用AMPK抑制剂和NAR共同干预甲状腺癌细胞后发现,AMPK抑制剂抑制了NAR作用下甲状腺癌细胞LC3II/LC3I和cleaved caspase-3蛋白表达,并促进p62蛋白表达水平,提示AMPK抑制剂可逆转NAR对甲状腺癌细胞自噬和凋亡的诱导作用,推测NAR能够诱导甲状腺癌细胞自噬和凋亡,可能与调控AMPK/mTORC1轴相关。
综上所述,NAR 能够抑制甲状腺癌细胞增殖,促进自噬,并诱导细胞凋亡,可能与激活AMPK活化,抑制mTORC1蛋白表达相关,表明NAR在治疗甲状腺癌方面的潜在价值,可能为甲状腺癌治疗提供新思路。但临床甲状腺癌的发生涉及家族遗传等多方面因素,且具有转移和侵袭性,因此针对NAR对其治疗效果及作用机制,仍需联合动物模型和临床试验进行探索。
