果蝇残翅/长翅杂交与PCR结合验证遗传学基本规律
2021-06-15马依莎王文燕谭艳平刘新琼黎艳艳姚凯龙徐鑫王春台
马依莎 王文燕 谭艳平 刘新琼 黎艳艳 姚凯龙 徐鑫 王春台

摘 要:为减轻传统有性杂交验证遗传基本规律的工作量以及把传统杂交试验与分子遗传学相结合,利用分子标记和性状共同验证分离及连锁遗传规律,从http://flybase.org/下载果蝇(Drosophila melanogaster)Chr.2R DNA序列并设计引物,筛选长翅和残翅(Vg/vg)果蝇之间多态性连锁PCR标记,获得了2个与Vg/vg紧密连锁的侧翼PCR标记R15和R24,对长翅和残翅杂交后自交得到的F2代个体进行翅型观察统计的同时进行PCR分析。结果表明:自交F2代中Vg/vg、R15/r15分离符合3∶1的分离比,R24/r24的分离符合1∶2∶1的分离比;Vg/vg与R15/r15的交换值为7.24%~8.42%,Vg/vg与R24/r24的交换值为22.82%~23.8%。
关键词:果蝇;PCR标记;杂交;遗传规律验证
中图分类号 Q963文献标识码 A文章编号 1007-7731(2021)08-0020-06
Abstract: To simplify the workload of traditional sexual hybridization to verify the three basic laws of genetics and combine traditional hybridization experiments with molecular genetics, molecular markers and characteristics are used to jointly verify the laws. The DNA sequence of Drosophila melanogaster Chr.2R was downloaded from http://flybase.org/ and the PCR primers were designed to screen the polymorphism between long and residual wing (Vg/vg) fruit flies and 2 flank linkage PCR markers R15 and R24 with Vg/vg were obtained. The PCR analysis was carried out at the same time as the wing observation statistics of F2 generation individuals obtained by self-interbreeding after long-wing and residual wing hybridization. The segregation of Vg/vg、R15/r15 was according with 3∶1, and R24/r24 was according with 1∶2∶1 in F2 population. The cross-over value between Vg/vg and R15/r15 is 7.24%~8.42%,Vg/vg and R24/r24 is 22.82%~23.8%。
Key words: Drosophila melanogaster; PCR Marker; Hybridization; Verifying of Genetics Laws
果蝇(Drosophila melanogaster)是生物与基础医学研究领域中最重要的生物材料之一,早在2000年就完成全基因组序列测定[1],并在基因组学和基因功能研究等领域取得了许多辉煌成就。作为模式动物的果蝇具有诸多优势:(1)易饲养。黑腹果蝇的饲养只需要很小的空间和设备,饲料成本低,非常适合实验室饲养;(2)生长周期短。包括卵期、幼虫期、蛹期、成虫形成与产卵,在25℃条件下10d左右即可完成;(3)高繁殖。雌虫每天产卵多达100枚,一生约产2000枚卵;(4)雌雄易分辨。雌雄差异明显,未交配的雌虫容易辨识,方便后续杂交试验[2]。
果蝇饲养容易、繁殖快的特点保证了实验材料的供应。自从遗传学家摩尔根在1908年把果蝇引入遗传学研究领域,此后果蝇就成为经典遗传学的“主角”,利用果蝇已经产出5个诺贝尔奖。摩尔根[3]发现了果蝇白眼突变的性连锁遗传,提出了基因在染色体上直线排列以及连锁交换定律,因此在1933年被授予诺贝尔生理学或医学奖;“果蝇的突变大师”穆勒[4]证明X射线能使果蝇的突变率提高150倍,因而成为1946年诺贝尔生理学或医学奖获得者;爱德华·路易斯、克里斯汀·纽斯林-沃尔哈德和艾瑞克·威斯乔斯[5]阐明了胚胎发育的遗传规律,为研究人类的胚胎发育奠定了重要理论基础而获得1995年诺贝尔奖;Hoffmann等[6]在果蝇体内分离出Toll基因,并发现该基因所表达的蛋白质作为受体,能特异识别某些入侵的细菌或真菌,从而激活机体的先天免疫反应,为传染病、癌症以及炎症的防治开辟了新路径,获得2011年诺贝尔生理学或医学奖;美国遗传学家Jeffrey C. Hall、Michael Rosbash和Michael W. Young[7]利用果蝇作为模式動物发现了控制生物钟的分子机制,获得2017年诺贝尔生理学或医学奖。截至2020年12月22日17:00,以“Drosophila”为关键词,在Pubmed上可检索到110900篇学术论文。果蝇基因组学和功能基因研究的飞速发展为生物医学专业等基础与应用科学提供了越来越多的帮助。
果蝇是经典遗传学和现代遗传学研究的通用材料,果蝇的单双因子、伴性及连锁遗传试验是传统而经典的遗传学实验之一。通过果蝇的杂交实验,可以掌握果蝇的杂交技术,并学会记录交配结果和掌握统计处理方法;认识伴性遗传的正、反交差别,掌握伴性遗传的特点;掌握绘制遗传学图的原理和方法,学会处理实验数据,加深对重组值、遗传学图、双交换值、并发率和干涉等概念的理解,并验证与加深理解3个遗传规律。但传统的杂交实验要达到上述目标,需要通过3个性状差异的亲本进行杂交和测交才能完成,不仅工作量大(杂交和测交都必须分离处女蝇),而且对实验材料要求严格,经常受三隐性材料的限制而不能完成三点测交,因此不能进行双交换值、并发率和干涉等实验,且知识点仅停留在经典遗传学水平[8]。为此,笔者首先筛选残翅(vg)和长翅(Vg)果蝇之间具有多态性且与残翅/长翅连锁的PCR标记,对残翅和长翅杂交得到F2代个体进行翅型观察统计的同时进行PCR分析,计算标记与残翅/长翅的交换值。通过1个杂交(长翅与残翅)和自交,结合与翅型连锁的分子标记,完成遗传学基本规律的验证,同时增加了动物DNA提取、分子标记鉴定2个知识点,实现经典实验的分子化和分子实验的经典化。
1 材料与方法
1.1 供试材料 残翅和长翅果蝇由中南民族大学实验教学与实验室管理中心繁殖保存。
1.2 试验方法
1.2.1 引物的设计与合成 从http://flybase.org/数据库下载果蝇2R的DNA序列,利用PCR引物设计软件在距vg基因两侧各10cm左右共设计30对特异引物,由昆泰锐(武汉)生物有限责任公司合成。
1.2.2 果蝇杂交 残翅(雌)与长翅(雄)及残翅(雄)与长翅(雌),获得F1及F2,观察统计F1及F2的翅型及数目,同时收集亲本、F1及F2的果蝇个体,并单独保存于-20℃条件下。
1.2.3 亲本果蝇基因组DNA提取 参照徐书华和曾庆韬[9]采用的方法加以改进简化。取6只冷冻的果蝇,放入1.5mL离心管中,加入预热的消化緩冲液30?L(100mmol/L Tris-HCl,25mmol/L EDTA,1.5mol/L NaCl,3%CTAB),用200?L Tip枪头迅速捣碎;补加预热的消化缓冲液400?L,混匀,置65℃温浴30min,每10min摇荡1次,使样品被充分消化;取出离心管加入400?L氯仿和异戊醇(24∶1)的混合物,盖紧管盖,上下颠倒充分混匀,抽提样品5min,12000rpm离心5min;小心吸取上清转移至新的离心管中。加入400?L异丙醇,轻轻混匀3min,此时可见白色线团状物质出现;14000rpm离心10min,让线团状物质沉到管底或管壁,小心倒出液体;用400?L 70%的乙醇洗涤沉淀,12000rpm离心5min,倒掉乙醇,倒置晾干至乙醇气味消失,沉淀用50?L TE缓冲液溶解;取5?L溶解好的DNA加1?L上样缓冲液进行琼脂糖(1%)凝胶电泳,以2?L DNA Marker作参照,估算DNA浓度。100V电泳30min,凝胶成像系统观察结果。根据检测结果将DNA稀释至10ng/?L,用于PCR。
1.2.4 多态性连锁引物的筛选 以残翅与长翅果蝇基因组DNA为模板,鉴定40对引物的可扩增性和遗传多态性。10?L PCR体系含PCR buffer 1?L、dNTP 1?L、Primer F 和Primer R各 0.2?L、模板DNA 1?L、Taq E 0.1?L、ddH2O 6.5?L。反应程序为95℃变性4min,94℃变性30s、60℃退火30s、72℃延伸30s、35个循环,72℃延伸8min。制备1.5%琼脂糖凝胶,PCR产物中加1?L上样缓冲液后点样,100V电泳30min,凝胶成像系统观察结果。
1.2.5 单果蝇微量基因组DNA提取及检测 取冷冻的单果蝇放入0.5mL离心管中,加入消化缓冲液20?L,用200?L Tip枪头迅速捣碎。补加消化缓冲液150?L,混匀。其余步骤同1.2.3。沉淀用20?L TE缓冲液溶解。电泳检测DNA质量和浓度后用于PCR。
1.2.6 F2代个体PCR标记分析 分别以F2的单个果蝇基因组DNA为模板,以获得的多态性引物进行扩增,PCR反应体系及反应程序同上。同一个体的2个PCR反应产物点在同一点样孔电泳,确定每个F2个体的基因型。
1.3 数据处理 根据杂交后代的表现型及PCR标记结果,先用χ2检验各性状与各标记是否符合分离规律、两两之间是否符合自由组合规律;对于不符合自由组合规律的计算交换值、双交换值等。
2 结果与分析
2.1 简易法提取DNA质量 取简易法提取的果蝇基因组DNA 2?L进行琼脂糖凝胶电泳检测。由图1可知,主带明显,可用于PCR分析。
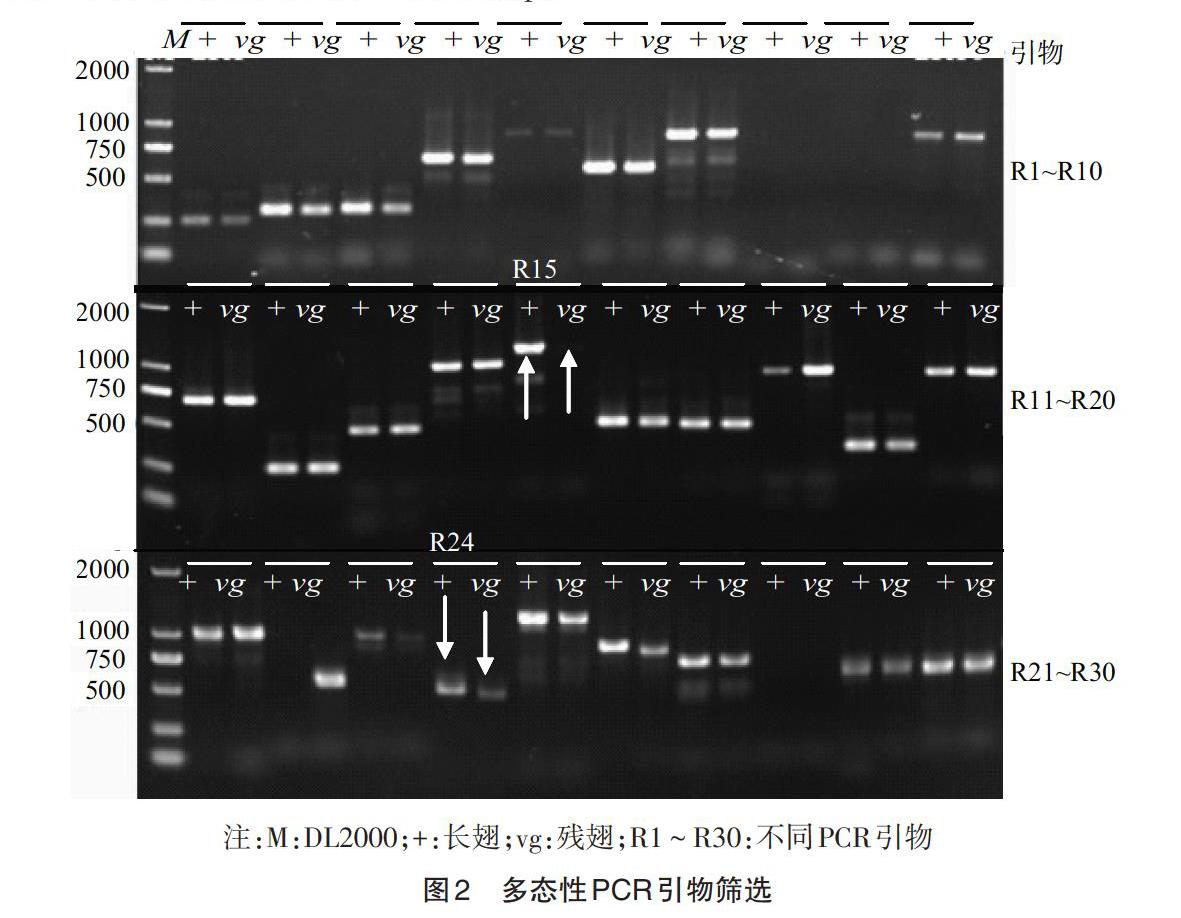
2.2 多态性连锁PCR引物 从http://flybase.org/数据库下载果蝇2R的DNA序列后利用PCR引物设计软件在距vg基因(2R 12884632-12899385 bp)两侧各10cm左右共设计30对特异引物,筛选长翅与残翅之间的多态性,只获得2对多态性引物(图2),其中R15(R15F:5′AGATCGCAGTTGTATATAGGTACAC3′,R15R:5′CCAGCCGAAAGAGATGGATAG3′)位于2R11942362-11943526bp,为显性标记,扩增片段大小为1164bp,长翅有带,残翅无带;位于2R14414248-14414788bp的R24(R24F:5′AGCAGCGCGTTCTAAGG3′,R24R:5′ATTCAGTGAGCTGTAGCGT3′)为共显性标记,长翅为540bp左右,残翅为520bp左右。R15与Vg/vg相距941106bp,Vg/vg与R24相距1515403bp。
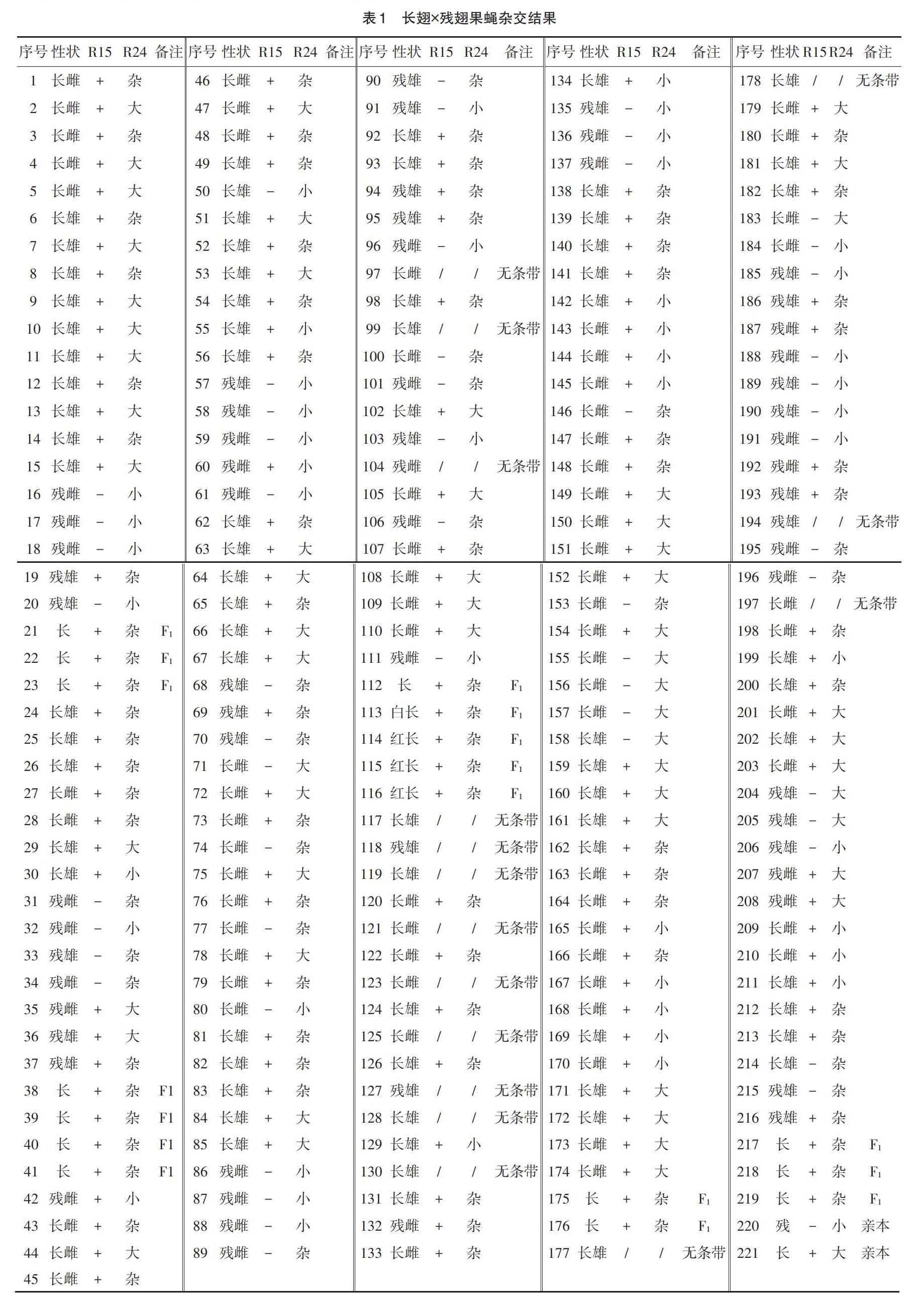
2.3 杂交结果及F2个体PCR检测 用长翅与残翅杂交,F1全部为长翅,自交后获得202个F2个体,性状表现如表1所示。简易法提取221个样本(202个F2个体,加上17个F1和2亲本)的基因组DNA进行R15和R24的PCR扩增,获得 186个F2个体的PCR数据(图3)。
2.3.1 等位基因分离规律的验证 分别对R15 Vg R24/R15 Vg R24和r15 vg r24/r15 vg r24杂交获得的F2代R15/r15、Vg/vg和R24/r24 3个位点进行分离规律的c2检测。由表2可知,F2代R15/r15和Vg/vg的分离符合3∶1的分离规律,R24/r24的分离符合1∶2∶1的分离规律。
2.3.2 非等位基因组合的验证及重组值 对F2代Vg/vg、R15/r15和R24/r24 3个位点两两组合,进行自由组合规律的c2检测。由表3可知,F2代Vg/vg-R15/r15不符合9∶3∶3∶1、Vg/vg-R24/r24和R15/r15-R24/r24不符合6∶3∶3∶2∶1∶1的自由组合规律,差异极显著,表明它们是连锁的。
基因间重组值可以用2种方法计算。一种方法是根据自交F2代双隐性个体出现比例开方得到双隐性亲型配子的比例,然后获得重组型配子比例。双隐性个体无带残翅(r15 vg/r15 vg)出现的比例为20.97%,亲型配子r15 vg的比例为45.79%,R15/r15-Vg/vg交换值8.42%;双隐性个体残翅小带(vg r24/vg r24)出现的比例为14.52%,亲型配子vg r24的比例为38.1%,Vg/vg-R24/r24交换值23.8%。第2种方法是根据谭远德[10]三点自交法计算基因图距的方法,R15/r15-Vg/vg图距为7.24%,Vg/vg-R24/r24图距为22.82%,双交换值为4.33%。2种方法计算得到的交换值基本一致。
3 结论与讨论
果蝇杂交一直是经典遗传学实验之一,但因材料要求高、工作量大而常被老师和学生诟病。孟敏等[11]改进优化了杂交实验的4个环节(培养基配制、果蝇性别鉴定、处女蝇培养以及F2代群体扩繁),提高了实验的成功率。但由于经典的三因子连锁遗传需要观察3个性状,且如刚毛特征一类的性状必须在解剖鏡下才能观察,进一步增加了工作量。本研究在性状考察时只有性别需要在解剖镜下确认,翅型的鉴定不需要解剖镜,同时2个分子标记大小差异较大,1次电泳就可完成,大大减轻了工作量,并且将传统的有性杂交与分子实验相结合,有助于学生从分子水平上理解遗传学。
参考文献
[1]Adams MD, Celniker SE, Holt RA, et al.The genome sequence of Drosophila melanogaster[J]. Science, 2000, 287(5461):2185-2195.
[2]刘素宁,沈杰.果蝇基因组与功能基因研究进展[J].应用昆虫学报,2011,48(06):1559-1572.
[3]戴灼华,王亚馥.遗传学[M].北京:高等教育出版社,2016:5-7.
[4]Calabrese EJ.Muller′s Nobel Prize Lecture: when ideology prevailed over science[J]. Toxicol Sci, 2012, 126(1):1-4.
[5]Raju TN. The Nobel chronicles [J]. The Lancet, 2000, 356(9223):81.
[6]陈丽华,金伯泉,杨安钢.揭示免疫识别的奥秘-2011年诺贝尔生理学或医学奖简介[J].细胞与分子免疫学杂志,2012,28(01):1-3.
[7]曾武威.2017年诺贝尔生理学或医学奖简介[J].解剖学报,2017,48(06):633-634.
[8]郭善利,刘林德.遗传学实验教程[M].第三版.北京:科学出版社,2015:8-20.
[9]徐书华,曾庆韬.果蝇基因组DNA的大规模提取及其RAPD-PCR反应条件的优化[J].湖北大学学报(自然科学版),2002(04):342-346.
[10]谭远德.构建分子标记连锁图谱的一种新方法:三点自交法[J].遗传学报,2001(01):83-94.
[11]孟敏,胡甘,王竹林,等.果蝇杂交实验教学的小窍门[J].实验技术与管理,2015,32(08):173-175.
(责编:徐世红)
