芥子碱硫氰酸盐增强HepG2 细胞对吉西他滨敏感性的作用
2021-06-15孙远梅曾智锐王婧雅彭明兵雷珊杨宇石兰金芝张毅陈腾祥
孙远梅曾智锐王婧雅彭明兵雷 珊杨宇石兰金芝张 毅陈腾祥*
(1.贵州医科大学基础医学院生理教研室,贵州 贵阳550004; 2.贵州医科大学附属医院病理科,贵州贵阳550004; 3.贵州医科大学组织工程与干细胞实验中心,贵州 贵阳550004; 4.贵州医科大学附属肿瘤医院,贵州 贵阳550004)
肝细胞癌是常见的消化系统癌症,发病率排第六位,也是第二常见的癌症相关死亡原因[1⁃2],由于其发病具有隐匿性的特征,一般被确诊时就已处于晚期,仅有20% 患者有机会接受手术治疗[3]。化疗仍是治疗肝癌的重要策略,其中吉西他滨是重要相关药物,但其长期使用会增强癌细胞的多药耐药性而降低其疗效。
肝癌细胞多药耐药性的机制有许多,其中一个重要的是ABCB1(也叫做p⁃糖蛋白)、ABCG2 蛋白的上调,其作用底物广泛,可将包含吉西他滨在内的抗肿瘤药物从细胞内外排出去,进而降低其含量,导致不能在细胞内达到有效阈值[4]。因此,寻找有效的药物来靶向抑制ABCB1、ABCG2 蛋白,增强细胞对吉西他滨的敏感性是治疗肝癌的有效策略。
十字花科植物是常见草本药物,其根和叶均具有清热消毒、凉血消瘢的功效,芥子碱硫氰酸盐是从该类植物中提取出的活性成分,具有抗氧化、放射性保护等活性[5],能抑制胰岛素小鼠血糖上升,进而延缓肝脂肪性变[6];作为一种益生元制剂,可预防肠道失调和肥胖相关的慢性疾病,如胰岛素抵抗(IR)、非酒精性脂肪肝疾病(NAFLD)[7];还具有良好抗肿瘤的作用,可抑制结肠腺癌细胞Caco⁃2 的增殖[8],并能逆转乳腺癌细胞的化学耐药性[9],但该成分对肝癌细胞的作用及其机制仍不清楚。因此,本实验探讨芥子碱硫氰酸盐增强肝癌细胞HepG2 对吉西他滨敏感性的作用,以期为相关临床治疗提供新的治疗策略和实验依据。
1 材料
1.1 细胞株 人肝癌细胞HepG2,购自美国ATCC 细胞库。
1.2 药物 吉西他滨(批号HY⁃17026)、芥子碱硫氰酸盐(批号HY⁃N0450),均购自武汉MCE 生物公司,DMSO 制成10 mmol/L 母液,-20 ℃下保存,用时以含10%胎牛血清的DMEM 培养基稀释成不同浓度的工作液。
1.3 试剂 DMEM 培养基(批号11965092)、胎牛血清(FBS,批号26010074)、0.25% 的胰蛋白酶(批 号25200072),购自美国 Gibco公司。DMSO(批号D2650),购自美国Sigma 公司;罗丹明123 染料(批号R8030),购自北京索莱宝科技有限公司;CCK⁃8 试剂(批号AR1199)、PMSF 酶抑制剂(批号AR1192)、蛋白裂解液RIPA(批号AR0102)、BCA 试剂盒(批号AR1189)、5×蛋白上样缓冲液(批号AR1112)、SDS⁃PAGE 胶制胶试剂盒(批号AR0138)、辣根过氧化物酶标记的山羊抗兔(批号BA1054)、山羊抗鼠二抗(批号BA1050),购自武汉博士德生物工程有限公司;AnnexinV⁃FITC/PI凋亡检测试剂盒(批号MA0220),购自大连美仑生物技术有限公司;PVDF 膜(批号ISEQ00010),购自美国Millipore公司;脱脂奶粉(批号G5002),购自武汉赛维尔生物科技有限公司;鼠源性单克隆抗β⁃actin(批号60008⁃1⁃Ig)、兔源性多克隆抗ABCB1(批号22336⁃1⁃AP)、兔源性多克隆抗ABCG2(批 号27286⁃1⁃AP)、兔源性多克隆抗Caspase⁃8(批号13423⁃1⁃AP)、兔源性多克隆抗Bcl⁃2(批号12789⁃1⁃AP)、兔源性多克隆抗Bax(批号50599⁃2⁃Ig),购自武汉三鹰生物技术有限公司;兔源性多克隆抗cleave⁃caspase8(批号9496),购自美国CST 公司;高敏ECL 曝光液(批号R30199),购自北京雷根生物技术有限公司公司。
2 方法
2.1 细胞培养 人肝癌细胞HepG2 用含10%FBS的DMEM 培养,放入37 ℃、5%CO2的培养箱中,当细胞汇合度达80%时用胰酶消化传代,取状态良好的对数生长期者进行实验。
2.2 芥子碱硫氰酸盐与ABCB1、ABCG2 蛋白结合能力的分子对接分析 从Protein Data Bank(ht⁃tps:/ /www.rcsb.org/)数据库下载ABCB1 蛋白的晶体结构和ABCG2 蛋白的晶体结构(ID:6COV、6ETI),同时从PubChem Compound 数据库(https:/ /www.ncbi.nlm.nih.gov/pccompound/)下载芥子碱硫氰酸盐的三级结构。ABCB1、ABCG2的晶体结构及芥子碱硫氰酸盐的三级结构均导入SYBYL 软件,对蛋白晶体结构清除原结合分子、修复黏性末端、加氢、自动识别活性口袋后,采用DOCKING 功能对接芥子碱硫氰酸盐与ABCB1、ABCG2 的活性口袋,根据结合打分(C⁃score 0~5分)来判断分子与蛋白稳定结合的可能性,C⁃score 在4~5 分范围内时,可认为分子与蛋白能稳定结合[10]。
2.3 HepG2 细胞外排药物能力检测 肝癌HepG2细胞以1×105/孔浓度接种于6 孔板上,待细胞贴壁后加入0、12.5、25、50 μmol/L 芥子碱硫氰酸盐处理24 h,胰酶消化成细胞悬液,离心收集细胞,重悬于培养基中,加入10 mmol/L 罗丹明123染液,在培养箱中避光孵育30 min 后PBS 缓冲液洗涤3 次,清除细胞外游离的罗丹明123 染料。将细胞重悬于PBS 缓冲液中,流式细胞仪(激发波长488 nm)检测其荧光强度,判断罗丹明123 在细胞内的累积程度,其累积越多,细胞外排药物能力越弱。
2.4 CCK⁃8 实验 取对数生长期的HepG2 细胞,用胰酶消化后制成细胞悬液接种于96 孔板中(3 000/孔),检测芥子碱硫氰酸盐对HepG2 细胞增殖的影响时,细胞分别给予0、12.5、25、50 μmol/L芥子碱硫氰酸盐处理;检测芥子碱硫氰酸盐对吉西他滨的增敏作用时,细胞分别给予0、2.5、5、10、20 μmol/L 吉西他滨或联合50 μmol/L芥子碱硫氰酸盐处理。48 h 后,除去旧培养基,每孔加入CCK⁃8 溶液10 μL、无血清培养基90 μL,放入培养箱中继续培养,2 h 后用酶标仪检测450 nm波长下各孔光密度(OD)值,以0 μmol/L处理为对照孔,只含CCK⁃8 溶液的DMEM 培养基的孔为调零孔,计算存活率,公式为存活率=[(实验组OD值-调零孔OD值)/(对应的对照组OD值-调零孔OD值)] ×100%。吉西他滨单独用药和联合芥子碱硫氰酸盐时,对HepG2 细胞的IC50是在GraphPad 软件中根据各浓度对应的增殖率构建非线性回归函数公式推导得出,同时根据金氏公式,即联合指数(CI)=ABi/ [Ai+(1-Ai)×Bi] 计算药物联合指数,CI>1.15 表示两药联合效果强于两药效单纯叠加。
2.5 克隆平板实验 用胰酶消化对数生长期的HepG2 细胞,离心后混匀制成细胞悬液,细胞计数后接种于6 cm 小皿中(2 000/皿),待细胞贴壁后分别给予等体积DMSO、5 μmol/L 吉西他滨、50 μmol/L芥子碱硫氰酸盐、5 μmol/L 吉西他滨+50 μmol/L 芥子碱硫氰酸盐处理HepG2 细胞。处理后第11 天除去旧培养基,用4%多聚甲醛在常温下固定细胞30 min,再用0.5% 结晶紫染色30 min,双蒸水洗净多余的结晶紫溶液,放入孵箱内烘干,相机拍照,计算克隆形成数。
2.6 HepG2 细胞凋亡检测 采用流式细胞术。取对数生长期的2×105/孔HepG2 细胞,接种于6 孔板中。待细胞贴壁后给予等体积DMSO、5 μmol/L吉西他滨、50 μmol/L 芥子碱硫氰酸盐、5 μmol/L吉西他滨+50 μmol/L 芥子碱硫氰酸盐处理HepG2细胞。24 h 后,用胰酶将细胞消化,收集于离心管中,1 000 r/min(离心半径8 cm)离心5 min,弃上清,PBS 缓冲液洗涤后再离心5 min,沉淀收集于流式管中,每管加入binding buffer 150 μL、PI染液4 μL、FITC 染液2 μL,混匀,锡纸包裹后置于4 ℃冰箱中15 min 后,采用流式细胞仪[艾森生物(杭州)有限公司] 检测细胞凋亡情况,总凋亡率=晚期凋亡率+早期凋亡率。
2.7 HepG2 细胞中ABCB1、ABCG2、Cleave caspase⁃8、Bcl⁃2、Bax蛋白表达检测采用Western blot 法。等体积DMSO、5 μmol/L 吉西他滨、50 μmol/L 芥子碱硫氰酸盐、5 μmol/L 吉西他滨+50 μmol/L 芥子碱硫氰酸盐处理HepG2 细胞24 h后,加入含2% PMSF 蛋白酶抑制剂的蛋白裂解液RIPA 裂解,将裂解液收集于离心管中,4 ℃下12 000 r/min(离心半径15 cm)离心15 min,收集蛋白上清液,用BCA 试剂盒测定各组蛋白浓度,样品置于-80 ℃冰箱中保存,以40 μg/孔上样于10% SDS⁃PAGE 上,90 V 恒定电压电泳2 h 后310 mA 恒定电流转膜2 h 至PVDF 膜上,5%脱脂奶粉在常温下封闭2 h,分别加入稀释度1 ∶1 000的一抗(ABCB1、ABCG2、caspase⁃8、Cleave caspase⁃8、Bcl⁃2、Bax、β⁃actin),置于4 ℃冰箱中过夜,TBST 洗涤3 次,加入稀释度1 ∶2 000的山羊抗鼠或兔二抗,室温下孵育2 h,TBST 洗涤3次,加入高敏ECL 曝光液,采用凝胶成像仪(美国Bio⁃Rad公司)进行曝光。ABCB1、ABCG2、Bcl⁃2、Bax 蛋白相对表达量=目的条带灰度值/β⁃actin 灰度值,Cleave caspase⁃8 相对表达量=Cleave caspase⁃8 条带灰度值/caspase⁃8 条带灰度值。
2.8 统计学分析 通过SPSS 19.0 软件进行处理,各实验均独立重复3 次,计量资料以()表示,2 组间比较采用独立t检验,多组间比较采用多因素方差分析和LSD⁃t 检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 芥子碱硫氰酸盐与多耐药相关蛋白ABCB1 和ABCG2 的对接 芥子碱硫氰酸盐与ABCB1、ABCG2 活性位点的对接打分(C⁃scrore)分别为4、5 分,见图1,提示该成分可稳定结合这2 种多耐药相关蛋白。

图1 芥子碱硫氰酸盐与多耐药相关蛋白ABCB1、ABCG2 的对接Fig.1 Docking of sinapine thiocyanate to multi⁃drug resistance related proteins ABCB1 and ABCG2
3.2 芥子碱硫氰酸盐减少HepG2 外排药物能力随着芥子碱硫氰酸盐浓度增加,HepG2 细胞中罗丹明123 波峰不断右移,见图2,提示该成分可减少HepG2 细胞药物外排能力,导致罗丹明123 在细胞中累积增多。
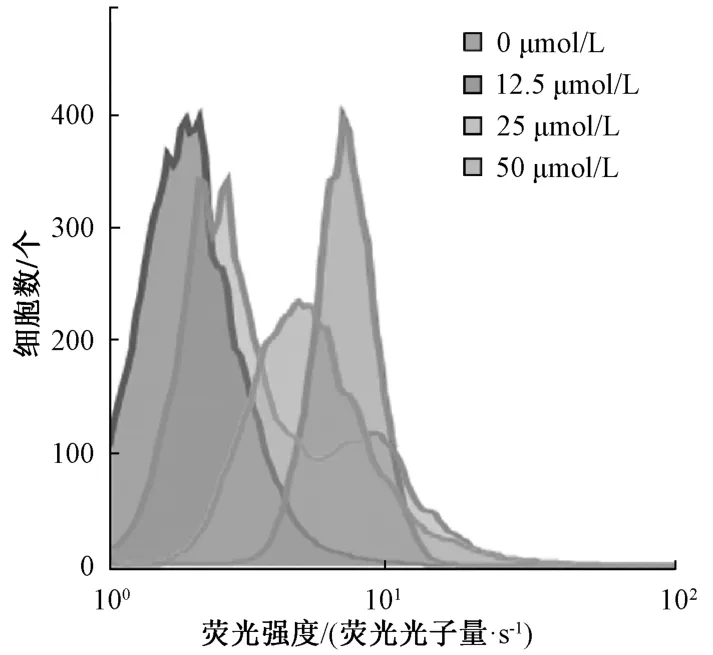
图2 不同浓度芥子碱硫氰酸盐对HepG2 细胞中罗丹明123 外排的影响Fig.2 Effects of different concentrations of sinapine thio⁃cyanate on rhodamine 123 efflux in HepG2 cells
3.3 芥子碱硫氰酸盐增强HepG2 细胞对吉西他滨敏感性的作用 25、50 μmol/L 芥子碱硫氰酸盐可减少肝癌HepG2 细胞增殖(P<0.05),见表1,再以不同浓度吉西他滨单独或联合50 μmol/L 芥子碱硫氰酸盐处理肝癌HepG2 细胞,细胞增殖率见表2。由此可知,吉西他滨单独用药时对HepG2 细胞的48 h IC50为15.48 μmol/L,而联合50 μmol/L 芥子碱硫氰酸盐后为5.34 μmol/L,提示该成分能增强HepG2 细胞对吉西他滨的敏感性。同时,5 μmol/L吉西他滨与50 μmol/L 芥子碱硫氰酸盐有最大联合指数,故将其用于后续研究。
表1 不同浓度芥子碱硫氰酸盐对HepG2 增殖的影响(, n=3)Tab.1 Effects of different concentrations of sinapine thio⁃cyanate on the proliferation of HepG2 cells(,n=3)

表1 不同浓度芥子碱硫氰酸盐对HepG2 增殖的影响(, n=3)Tab.1 Effects of different concentrations of sinapine thio⁃cyanate on the proliferation of HepG2 cells(,n=3)
注:与0 μmol/L 芥子碱硫氰酸盐组比较,*P<0.05。
表2 不同浓度吉西他滨单独用药或联合50 μmol/L 芥子碱硫氰酸盐对HepG2 细胞增殖的影响(, n=3)Tab.2 Effects of different concentrations of gemcitabine in single use or combinative use with 50 μmol/L si⁃napine thiocyanate on the proliferation of HepG2 cells(, n=3)
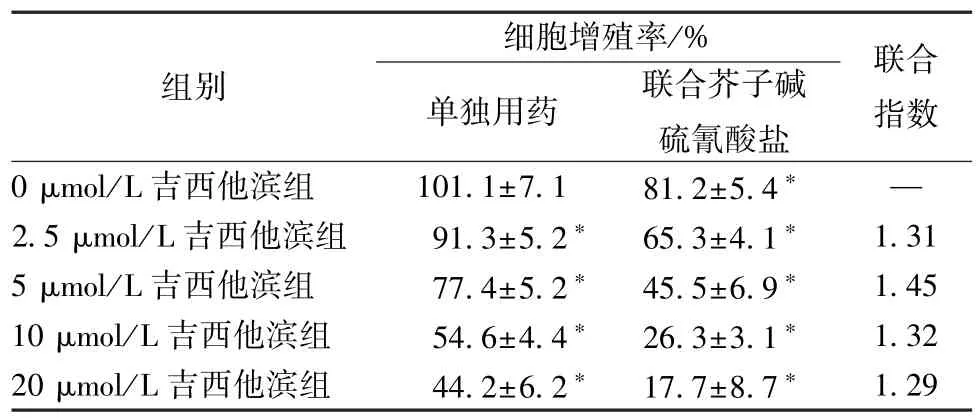
表2 不同浓度吉西他滨单独用药或联合50 μmol/L 芥子碱硫氰酸盐对HepG2 细胞增殖的影响(, n=3)Tab.2 Effects of different concentrations of gemcitabine in single use or combinative use with 50 μmol/L si⁃napine thiocyanate on the proliferation of HepG2 cells(, n=3)
注:与0 μmol/L 吉西他滨组比较,*P<0.05。
3.4 芥子碱硫氰酸盐联合吉西他滨对HepG2 细胞克隆形成的影响 对照组(DMSO 处理)、5 μmol/L吉西他滨组、50 μmol/L 芥子碱硫氰酸盐组、5 μmol/L吉西他滨+50 μmol/L 芥子碱硫氰酸盐组HepG2 细胞克隆形成的个数分别为(1 335±87)、(1 002±66)、(870±55)、(289±42)个,见图3。与对照组比较,给药组HepG2 细胞克隆形成能力均减弱(P<0.05);与5 μmol/L 吉西他滨组、50 μmol/L芥子碱硫氰酸盐组比较,5 μmol/L 吉西他滨+50 μmol/L 芥子碱硫氰酸盐组克隆形成能力减弱(P<0.05),提示芥子碱硫氰酸盐能增强吉西他滨对HepG2 克隆形成的抑制能力。

图3 吉西他滨、芥子碱硫氰酸盐及其联合对HepG2 细胞克隆形成的影响Fig.3 Effects of gemcitabine,sinapine thiocyanate and their combination on HepG2 cell colony formation
3.5 芥子碱硫氰酸盐联合吉西他滨对HepG2 凋亡的影响对照组、5 μmol/L吉西他滨组、50 μmol/L芥子碱硫氰酸盐组、5 μmol/L 吉西他滨+50 μmol/L 芥子碱硫氰酸盐组细胞凋亡率分别为(1.45 ± 0.32)%、(5.11 ± 0.67)%、(8.62 ±0.81)%、(23.53% ±1.73)%,见图4。与对照组比较,给药组HepG2 细胞凋亡率升高(P<0.05);与5 μmol/L 吉西他滨组、50 μmol/L 芥子碱硫氰酸盐组比较,5 μmol/L 吉西他滨+50 μmol/L 芥子碱硫氰酸盐组HepG2 细胞凋亡率升高(P<0.05),提示芥子碱硫氰酸盐能增强吉西他滨诱导HepG2凋亡的能力。

图4 吉西他滨、芥子碱硫氰酸盐及其联合对HepG2 细胞凋亡的影响Fig.4 Effects of gemcitabine,sinapine thiocyanate and their combination on HepG2 cell apoptosis
3.6 芥子碱硫氰酸盐联合吉西他滨对肝癌HepG2细胞中ABCB1、ABCG2、Cleave caspase⁃8、Bcl⁃2、Bax 表达的影响 与对照组比较,5 μmol/L 吉西他滨组HepG2 细胞中Cleave caspase⁃8、Bax 表达升高(P<0.05),Bcl⁃2 表达降低(P<0.05),50 μmol/L芥子碱硫氰酸盐组、5 μmol/L 吉西他滨+50 μmol/L芥子碱硫氰酸盐组HepG2 细胞中ABCB1、ABCG2、Bcl⁃2 表达降低(P<0.05),Cleave caspase⁃8、Bax 表达升 高(P<0.05);与5 μmol/L吉西他滨组、50 μmol/L芥子碱硫氰酸盐组比较,5 μmol/L 吉西他滨+50 μmol/L 芥子碱硫氰酸盐组Cleave caspase⁃8、Bax 表达升高(P<0.05),Bcl⁃2 表达降低(P<0.05),见表3、图5,提示芥子碱硫氰酸盐能通过抑制ABCB1、ABCG2 表达来增强吉西他滨诱导的Bcl⁃2 减少及Cleave caspase⁃8、Bax 的增加。

图5 吉西他滨、芥子碱硫氰酸盐及其联合对HepG2 细胞中ABCB1、ABCG2、Cleave caspase⁃8、Bcl⁃2、Bax表达的影响Fig.5 Effects of gemcitabine,sinapine thiocyanate and their combination on the expressions of ABCB1,ABCG2,Cleave caspase⁃8,Bcl⁃2 and Bax in HepG2 cells
表3 吉西他滨、芥子碱硫氰酸盐及其联合对HepG2 细胞中ABCB1、ABCG2、Cleave caspase⁃8、Bcl⁃2、Bax 表达的影响(, n=3)Tab.3 Effects of gemcitabine,sinapine thiocyanate and their combination on the expressions of ABCB1,ABCG2,Cleave caspase⁃8,Bcl⁃2 and Bax in HepG2 cells(, n=3)

表3 吉西他滨、芥子碱硫氰酸盐及其联合对HepG2 细胞中ABCB1、ABCG2、Cleave caspase⁃8、Bcl⁃2、Bax 表达的影响(, n=3)Tab.3 Effects of gemcitabine,sinapine thiocyanate and their combination on the expressions of ABCB1,ABCG2,Cleave caspase⁃8,Bcl⁃2 and Bax in HepG2 cells(, n=3)
注:与对照组比较,*P<0.05;与5 μmol/L 吉西他滨组比较,ΔP<0.05;与50 μmol/L 芥子碱硫氰酸盐比较,#P<0.05。
4 讨论
肝癌是致死率排第二的恶性肿瘤。由于肝癌发病隐匿,大部分肝癌患者诊断时,就失去了手术的机会。然而,由于肝癌细胞对多种化疗药物不敏感,肝癌患者的化疗缓解率低;此外,大剂量的化疗药物会造成严重的心脏、肾脏等毒性作用[11]。因此,寻找新的药物增强肝癌细胞对化疗药物的敏感性是肝癌治疗的一个有效策略。
中药及其有效成分具有药效温和、毒副作用小等优点,是重要的药物开发库[12]。目前,多种中药及其有效成分已证实能够通过抑制ABCB1 和ABCG2 等转运蛋白的表达,增强肝癌细胞对化疗药物的敏感性。如蟾毒灵是中药蟾酥的有效成分之一,能够通过抑制ABCB1 的表达,增强肝癌细胞对5⁃FU 的敏感性[13];苦参的活性成分苦参素靶向ABCG2 逆转肝癌细胞对阿霉素的耐药性[14]。基于ABCB1 和ABCG2 在调控化疗药物敏感性中扮演着重要角色,为挖掘可抑制ABCB1 和ABCG2 功能的药物,本研究通过计算机对接发现芥子碱硫氰酸盐能够与ABCB1 和ABCG2 蛋白的活性口袋结合;同时利用罗丹明123 实验发现,芥子碱硫氰酸盐能够降低肝癌细胞外排药物的能力。
吉西他滨是治疗肝癌的一个重要化疗药物,其主要是通过干扰细胞DNA 合成过程,抑制肝癌细胞增殖,诱导细胞凋亡[15]。但是,吉西他滨也是ABCB1 和ABCG2 的底物,在予以高剂量吉西他滨治疗时,细胞中的ABCB1 和ABCG2 蛋白介导吉西他滨持续外排,致使细胞内的吉西他滨无法达到有效杀伤的阈值浓度[16]。在本研究中,通过CCK⁃8、克隆形成和凋亡实验发现,芥子碱硫氰酸盐能够增强肝癌细胞对吉西他滨的敏感性,增强吉西他滨抑制肝癌细胞克隆形成以及诱导凋亡的能力;通过Western blot 实验发现,芥子碱硫氰酸盐能够通过抑制ABCB1 和ABCG2 的表达,增强吉西他滨介导的Bcl⁃2 减少以及Cleave caspase⁃8 和Bax 的增加。
综上所述,芥子酸碱硫氰酸盐靶向抑制ABCB1 和ABCG2,增强肝癌细胞对吉西他滨的敏感性。芥子碱硫氰酸盐联合吉西他滨可能是治疗肝癌的一种有效策略。
