天然二萜衍生物JYD01促进己糖激酶Ⅱ与线粒体解离诱导胃癌细胞凋亡
2021-06-15范霞霞王爱凤马永成
苏 楠,范霞霞,王爱凤,马永成
(1. 河南牧业经济学院食品与生物工程学院,河南 郑州 450011; 2. 河南省人民医院药学部,华中阜外医院药学部临床药理室,郑州大学华中阜外医院,河南 郑州 450003)
有氧糖酵解(Warburg效应)与肿瘤快速生长、侵袭转移以及耐药性密切相关,被认为是肿瘤不同于正常细胞的显著特征,此特征为抗肿瘤药物的研发提供了潜在靶点[1]。己糖激酶Ⅱ(hexokinaseⅡ,HKⅡ)是糖酵解过程中控制葡萄糖代谢速率的第一个关键酶,目前大量研究证实其在肿瘤细胞中高表达,使得肿瘤细胞表现出高度的糖酵解代谢表型,促进肿瘤细胞快速增殖和适应恶劣环境[2]。与正常细胞相比,恶性肿瘤细胞中HKⅡ更倾向于与线粒体外膜结合,线粒体赋予了结合型HKⅡ多种酶促动力学优势,优先利用线粒体释放的ATP以快速进行酶促反应,将进入细胞内的葡萄糖磷酸化,促进糖酵解发生,为肿瘤细胞的快速增殖提供必要的能量与原料[2]。另一方面,HKⅡ与线粒体外膜控制线粒体膜电位的分子结合,如电压依赖性离子通道(VDAC),抑制线粒体细胞色素C(cytochrome c,Cyt c)释放,抵抗细胞凋亡[3]。总之,HKⅡ是调控肿瘤细胞糖酵解代谢和生死存亡的关键分子,以其为靶点进行新型化合物设计与探索有望获取有效的抗肿瘤药物。这里,我们报道了一个新合成的二萜类衍生物JYD01,该化合物结构稳定,合成路线简单,反应收率高;前期研究发现,该化合物具有良好的抗肿瘤活性,采用人食管癌细胞系EC109移植瘤模型评价其体内抗肿瘤活性,抑瘤率可达59%,具有较好的研究价值。本文则进一步研究了JYD01的抗胃癌活性及作用机制,发现该化合物可以促进HKⅡ与线粒体解离,抑制糖酵解,同时可降低MMP,致使Cyt c释放,诱导肿瘤细胞凋亡。本研究可为新型抗肿瘤药物的研发提供有效靶标以及物质基础,对进一步研发更多的二萜类药物亦有重要的理论和实践意义。
1 材料与方法
1.1 细胞BGC-823和MGC-803两株人胃癌细胞均购自中国科学院典型培养物保藏委员会细胞库,本实验室传代培养。
1.2 主要试剂糖酵解压力检测试剂盒(#103346-100,美国Seahorse Bioscience公司);荧光染料JC-1(#C2005,江苏碧云天生物技术研究所);FITC-annexinⅤ/PI试剂盒(#K201-25,美国Biovision公司);GAPDH抗体(#AB-P-R001,杭州贤至生物科技公司);HKⅡ(#32115)和COX Ⅳ(#49275)抗体(美国SAB公司);Cyt c抗体(#sc-13156,美国Santa Cruz 公司);辣根过氧化酶(HRP)标记的第二抗体(#ZB-2301)购自北京中杉金桥生物技术公司;硝酸纤维素膜(NC膜,美国pall公司);化学发光检测试剂盒(美国Pierce公司);四氮唑蓝(MTT,美国sigma公司)。
1.3 化合物JYD01由天然二萜经化学衍生获得,最终的反应回收率达57%(由郑州大学新药研发中心刘宏民教授团队研制),化学结构如Fig 1A所示。JYD01溶解于DMSO,-20 ℃分装保存。

Fig 1 Cell proliferation of MGC-803 and BGC-823
1.4 细胞培养MGC-803和BGC-823细胞均使用RPMI 1640 培养液,其中含有10%胎牛血清、100 g·L-1链霉素和1×105kU·L-1青霉素,于37 ℃,5% CO2的条件下培养。
1.5 细胞生存率测定参照文献,利用MTT法检测细胞生存率[4]。简单来讲,将BGC-823和MGC-803细胞接种于96孔细胞培养板,过夜培养,待细胞完全贴壁,加入终浓度为1、2、4、8、16 μmol·L-1的JYD01,作用48 h后,加入适量体积的MTT溶液,使每孔MTT的终浓度为0.5 g·L-1,培养箱内孵育4 h,移除培养基,每孔加入200 μL DMSO,室温振荡15 min,充分溶解结晶物。使用酶标仪(美国Perkinelmer公司)于490 nm处测定各孔吸光度,实验重复3次,利用GraphPad 8.0计算细胞生存率(survival rate)及IC50值。
1.6 线粒体膜电位(MMP)分析高MMP情况下,荧光探针JC-1呈现强的红橙色荧光;在MMP较低情况下,JC-1则呈现绿色荧光[5]。本研究利用该原理,进行MMP分析。将MGC-803细胞接种于6孔培养板,过夜培养,待细胞全部贴壁后,使用不同浓度JYD01作用细胞24 h,胰酶消化并离心收集细胞;然后每个样品中加入适量体积的10 mg·L-1JC-1 溶液,培养箱中孵育染色20 min, PBS洗涤2次以去除未结合的JC-1染料,取适量PBS垂悬细胞,最终移取20 μL细胞悬液至载玻片,加盖玻片后,荧光显微镜观察。同时,相同条件下处理细胞样品,利用流式细胞仪(美国BD公司)定量分析MMP变化。
1.7 细胞凋亡检测不同浓度的JYD01作用于细胞24 h后,在室温避光条件下,使用FITC-AnnexinⅤ/PI试剂盒对细胞进行荧光染色处理,同时利用荧光显微镜和流式细胞仪进行细胞凋亡情况分析。
1.8 细胞糖酵解检测将MGC-803细胞(6500 cells/孔)接种到糖酵解检测专用培养板,过夜培养,待细胞完全贴壁后,使用不同浓度的JYD01预处理细胞2 h,然后去除原培养基,更换不含JYD01的专用培养液,利用细胞能量分析仪Seahorse XFp(美国Seahorse Bioscience公司)实时检测胞外酸化率(ECAR)。参照以往发表文献[5],利用所得ECAR值分析JYD01对胃癌细胞的(Glycolysis)和最大糖酵解能力(Glycolytic Capacity)的抑制作用,其中糖酵解水平=(寡霉素注射前最大检测值)-(葡萄糖注射前最后一个检测值);最大糖酵解能力=(寡霉素注射后最大的检测值)-(葡萄糖注射前最后一个检测值)。检测结束后,收集各孔细胞,利用细胞计数仪(JIMBIO FIL,江苏卓微生物科技有限公司)进行绝对计数,以每孔1 000细胞标准化ECAR的测量值。
1.9 线粒体分离0、1、2、4 μmol·L-1JYD01作用MGC-803细胞24 h后,胰酶消化,离心收集细胞;参照细胞线粒体分离试剂盒(江苏碧云天生物技术研究所)说明,加入适量添加了蛋白酶抑制剂(PMSF)的线粒体分离试剂,垂悬后转移到适当大小的玻璃匀浆器中,匀浆10-30次(利用台盼蓝染色判断匀浆的具体次数,当台盼蓝阳性细胞率大于50%即为匀浆合理);然后,细胞匀浆于600g、4 ℃条件下离心10 min,转移上清至新离心管,并于11 000g,4 ℃条件下继续离心10 min,此时上清为胞质,沉淀则为线粒体;线粒体部分使用线粒体裂解液(江苏碧云天生物技术研究所)获取线粒体蛋白;BCA法对胞质蛋白和线粒体蛋白定量。
1.10 Western blot不同浓度JYD01处理MGC-803细胞24 h后,离心收集细胞,使用RIPA裂解液裂解细胞,低温离心,吸取上清则为总蛋白,蛋白浓度由BCA 法测定。参照以往发表文献进行后续Western blot分析[4]。

2 结果
2.1 JYD01抑制MGC-803和BGC-823细胞生存JYD01处理两种胃癌细胞系48 h后,MTT检测细胞生存率,结果显示,JYD01明显抑制了MGC-803和BGC-823细胞系的生长,且具有浓度依赖性(Fig 1B),IC50值分别为(1.26 ± 0.39)μmol·L-1和(2.45 ± 0.43)μmol·L-1,见Fig 1B。MGC-803对JYD01相对敏感,因此后续以MGC-803为细胞模型做进一步研究。
2.2 JYD01促进HKⅡ与线粒体分离0、1、2、4 μmol·L-1JYD01作用MGC-803细胞24 h后,收集细胞,并分离线粒体和胞质,Western blot法分别检测线粒体和胞质中HKⅡ蛋白含量,如Fig 2所示,随着JYD01浓度增加,线粒体上HKⅡ蛋白含量逐渐降低,胞质中的HKⅡ蛋白含量则呈浓度依赖性增加,表明JYD01可诱导HKⅡ脱离线粒体。
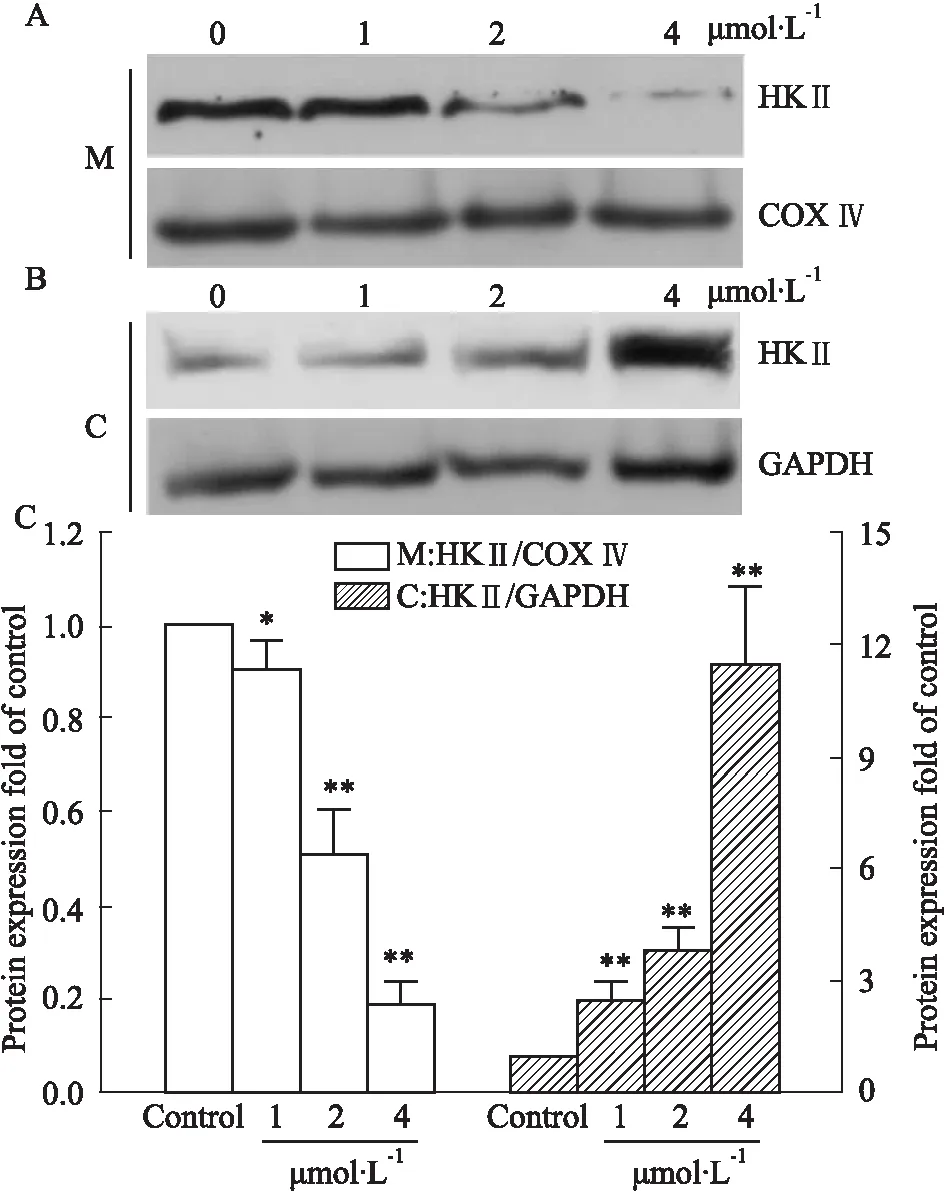
Fig 2 HK Ⅱ dissociation from mitochondria
2.3 JYD01抑制MGC-803细胞糖酵解胞外酸化率(ECAR)代表细胞的糖酵解水平[5]。如Fig 3A所示,JYD01明显抑制了MGC-803细胞糖酵解功能,且随着JYD01浓度的增加这种抑制作用逐渐增强;此外,与对照组细胞相比,JYD01处理组细胞基础糖酵解水平和最大糖酵解能力均明显降低(P<0.05,Fig 3B和3C)。上述结果表明,JYD01具有抑制肿瘤细胞糖酵解作用,而JYD01促进HKⅡ脱离线粒体可能是其抑制糖酵解的作用机制。

Fig 3 Glycolysis of MGC-803 cells inhibited by JYD01 n=3)
2.4 JYD01诱导MGC-803细胞线粒体膜电位降低荧光显微镜定性分析表明,相对于阴性对照组细胞显示出强的红橙色荧光,1 μmol·L-1JYD01作用MGC-803细胞24 h后,红橙色荧光相对减弱并显示了一定量的绿色荧光,提示MMP有所下降;2 μmol·L-1JYD01处理组红橙色荧光进一步下降,而绿色荧光增强,4 μmol·L-1JYD01处理组则呈现微弱的橙色荧光,而绿色荧光强烈,代表MMP已显著降低,接近崩溃丧失(Fig 4A)。同样,通过流式细胞术定量分析可知,JYD01可明显降低MMP,1、2、4 μmol·L-1JYD01处理组,低MMP细胞比例分别为27.8%、66.9%和92.6%,呈浓度依赖性增加,与对照组4.44%相比,MMP下降明显(Fig 4B)。上述结果表明了,JYD01可以致使MMP下降,这可能与HKⅡ脱离线粒体有关。

Fig 4 Effects of JYD01 on MMP
2.5 JYD01诱导细胞色素C释放Western blot法检测显示,与对照组相比,JYD01作用MGC-803细胞24 h后,随着化合物浓度的增加,线粒体中Cyt c逐渐减少(Fig 5A),而胞质中的Cyt c则逐渐增多(Fig 5B),且呈浓度依赖性(Fig 5C)。该结果表明,JYD01降低线粒体膜电位,增加线粒体膜通透性,诱导了Cyt c的释放。
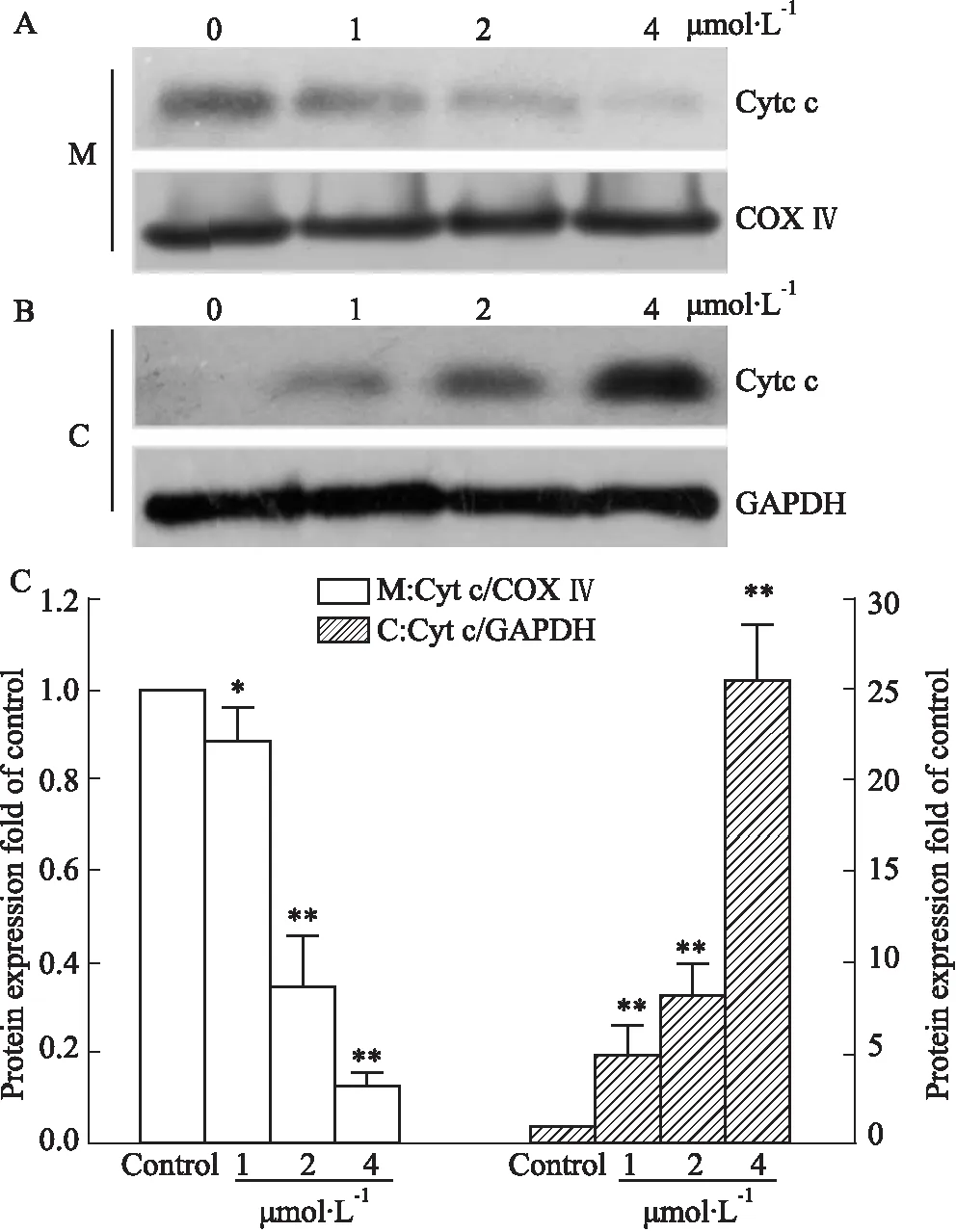
Fig 5 Cyt c release induced by JYD01 n=3)
2.6 JYD01诱导肿瘤细胞凋亡使用不同浓度JYD01处理MGC-803细胞24 h后,荧光显微镜观察发现,阴性对照组绿色和红色荧光均较弱,表明细胞处于正常状态;1、2 μmol·L-1JYD01处理后,绿色荧光逐渐增强,表明早起凋亡的发生;4 μmol·L-1组绿色和红色荧光均较强,说明了细胞处在晚期凋亡状态(Fig 6A)。另一方面,经流式细胞术定量分析,1、2、4 μmol·L-1JYD01均诱导了MGC-803细胞凋亡(Fig 6B),且早期凋亡率分别为(18.1±3.2)% 、(22.2±4.5)%和(21.1±3.2)%,与正常对照组(3.6 ± 1.7)%相比具有统计学差异(P<0.01);晚期凋亡率分别为(14.1 ± 4.2)%、(24.3 ±4.3)%和(45.3 ±5.1)%,与对照组晚期凋亡率(2.2± 0.8)%相比,差异亦具有显著性(P<0.01)(Fig 6C)。上述结果表明JYD01具有诱导细胞凋亡作用,这可能与其促进HKⅡ脱离线粒体,降低MMP,激活线粒体介导的凋亡途径有关。

Fig 6 MGC-803 cell apoptosis induced by JYD01 n=3)
3 讨论
对映贝壳杉烷型二萜化合物具有广泛的药理学活性,如抗菌、抗病毒、抗炎、抗肿瘤等,是很有潜力的先导化合物[6]。但以往的报道表明,天然对映贝壳杉烷型二萜化合物抗肿瘤效果不佳,体内活性更缺乏振奋人心的效果。因而对其进行结构修饰以减毒增效成为当前研究热点,目前已有大量的二萜类衍生物被报道,体内外抗肿瘤效果得到显著提升,药物利用度、不良反应等均得到较好的优化,甚至一些衍生物进入了临床试验阶段[4]。本研究中,我们探讨了一个新合成的对映贝壳杉烷型二萜衍生物JYD01抑制胃癌细胞增殖的效果及机制,证明了JYD01通过促进HKⅡ脱离线粒体、抑制糖酵解、降低线粒体膜电位、诱导Cyt c释放和细胞凋亡,从而发挥抗胃癌细胞增殖作用。
HKⅡ是肿瘤细胞进行高效有氧糖酵解的关键酶,其促进肿瘤细胞快速增殖,提高肿瘤细胞的迁移侵袭能力,同时在肿瘤耐药方面也发挥着重要作用,因此HKⅡ已成为抗肿瘤药物研发中的重要靶标[7]。抗真菌药物克霉唑和白呋唑[8]、天然来源的茉莉酮酸酯[9]和黄酮类衍生物FV-429[10]均能够促进HKⅡ和线粒体解离,诱导线粒体介导的凋亡,抑制肿瘤细胞增殖;此外,3-溴丙酮酸(3-bromopyruvate)和2-脱氧-D-葡萄糖(2-deoxy-D-glucose)均是HKⅡ特异抑制剂,在抗肿瘤研究领域亦是一大热点[1];另外,抗肿瘤药物铜配位化合物(Casiopeina Ⅱ-gly)[11]和氯尼达明(Lonidamine)[12],以及最近发现抗真菌药酮康唑和泊沙康唑[13],也均是通过抑制HKⅡ活性发挥抗肿瘤作用。本研究结果也表明,JYD01可诱导胃癌细胞线粒体上HKⅡ蛋白含量逐渐降低,相反,胞质中的HKⅡ蛋白含量则逐渐增加,继而MGC-803细胞的糖酵解功能和线粒体膜电位受到影响,诱导了凋亡的发生。但是JYD01诱导HKⅡ与线粒体解离的具体调控机制尚不明确,有报道表明,3-溴丙酮酸可以与HKⅡ半胱氨酸残基中的巯基结合,从而导致HKⅡ从线粒体释放[14]。而对映贝壳杉烷型二萜化合物的主要药理学活性则是与生物分子中的巯基发生迈克尔加成反应[15],因而,我们推测JYD01可能与HKⅡ半胱氨酸残基中的巯基结合,改变其结构和功能,诱导其与线粒体脱离,当然,该推测仍需进一步实验验证。
总之,作为一个新型的HKⅡ抑制剂,JYD01可促使HKⅡ与线粒体解离,抑制糖酵解功能并诱导凋亡,是一个很有潜力的抗肿瘤候选化合物。同时,本研究亦为设计合成更多的HKⅡ抑制剂提供了实验依据和理论支持。
