葛根素通过circ-TLK1/miR-367-3p/TLR4抑制SK-N-SH细胞氧糖剥夺损伤
2021-06-11齐献忠邢英瀛张小林贾燕燕
齐献忠,邢英瀛,张小林,贾燕燕
南阳市中心医院 神经内科,河南 南阳 473000
脑卒中是导致残疾的主要原因,也是全球第2大常见的死亡原因[1]。约87%脑卒中病例为缺血性脑卒中(ischemic stroke,IS),IS 的死亡率和致残率一直处于较高水平[2]。有效保护神经元损伤在IS防治中至关重要[3]。葛根素是从豆科植物野葛Pueraria lobata(Willd.) Ohwi 的根中提取的异黄酮苷类物质,具有抗炎、抗氧化、抗肿瘤等多种药理作用[4]。葛根素被广泛用于治疗急性缺血性中风、心脏病和其他全身性疾病[5-6]。环状RNA(circRNA)通过微小RNA(miRNA)或与RNA 结合蛋白相互作用形成circRNA-miRNA-mRNA 复合物,在转录后基因表达的调节中起关键作用[7]。研究发现,circRNA 可能参与了IS 的发病过程,具有作为IS的新型诊断生物标志物和分子治疗靶点的潜力[8-9]。在IS 患者和动物模型中,circ-丝氨酸/苏氨酸蛋白扰动样激酶1(tousled-like kinase1,TLK1)表达明显上调,敲除circ-TLK1能够显著减少脑梗死体积,减少缺血性神经元损害并改善神经功能缺损[10]。因此,本研究基于circ-TLK1 探究葛根素对IS 的神经细胞保护作用及机制。
1 材料
1.1 细胞
人神经母细胞瘤细胞 SK-N-SH 购自美国ATCC。
1.2 药品与试剂
葛根素(质量分数≥98%,批号110752-201912)购自中国药品生物制品检定所;DMEM 高糖培养基(批号1912)购自美国Hyclone 公司;胎牛血清(批号SN201909)购自美国Gibco 公司;Lipofectamine 3000转染试剂(批号L3000-015)购自美国Invitrogen公司;MTT(批号MKBP6775V)购自美国Sigma公司;circ-TLK1过表达载体及空载 Vector、circ-TLK1小干扰RNA(si-circ-TLK1)、siRNA 阴性对照(si-NC)、miR-367-3p模拟物(miR-367-3p mimics)、miR-367-3p抑制剂(miR-367-3p inhibitors)及相应对照、Toll 样受体4(Toll-like receptor 4,TLR4)过表达载体质粒和空载pcDNA 均由上海吉玛制药技术有限公司合成;白细胞介素-6(interleukin-6,IL-6)ELISA 检测试剂盒(批号20191120)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)ELISA 检测试剂盒(批号20190608)购自上海酶联生物科技有限公司;Annexin V-FITC/碘化丙啶(PI)细胞凋亡试剂盒(批号MK1020)购自日本Takara 公司;双荧光素酶标记试剂盒(批号E2920)、pmirGLO 载体(批号E1330)购自美国Promega 公司;RNA 结合蛋白免疫沉淀(RNA binding protein immunoprecipitation,RIP,批号KT102-01)购自美国Millipore 公司;TLR4 单抗、HRP 标记的IgG 二抗购自美国CST 公司;RIPA 裂解液(批号P0013)购自上海碧云天生物技术有限公司;BCA 蛋白定量试剂盒(批号PC0020)购自北京索莱宝科技有限公司。
1.3 仪器
CR21GⅡ型低温高速离心机购自日本日立公司;T-1186-340-LA 型超低温冰箱购自天地精仪科技;MAXM5 型多功能酶标仪购自美谷分子仪器;YXQ-LS-75G 型高压灭菌锅购自诺基仪器;流式细胞仪购自北京仪美信科技。
2 方法
2.1 细胞培养
SK-N-SH 细胞用含10%胎牛血清的DMEM 高糖培养基,于5% CO2、饱和湿度、37 ℃的培养箱中培养。
2.2 氧糖剥夺(oxygen-glucose deprivation,OGD)对SK-N-SH 细胞存活率的影响
取处于对数生长期的SK-N-SH 细胞,以2×104/孔接种于6 孔板中,待细胞贴壁后使用PBS 洗涤3 次,用不含血清、无糖的DMEM 培养基,于5% CO2、1% O2、94% N2、37 ℃的培养箱中分别培养6、12、24 h;将培养基更换成DMEM 高糖培养基,于5% CO2、饱和湿度、37 ℃的培养箱中培养24 h,建立OGD 细胞模型[11]。加入100 μL MTT 孵育4 h,弃上清,加入二甲基亚砜(DMSO),振荡至结晶完全溶解,采用酶标仪测定490 nm 处的吸光度(A),计算细胞存活率。
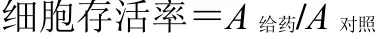
2.3 细胞转染
取处于对数生长期的SK-N-SH 细胞,以2×104/孔接种于6 孔板中,培养12 h,待细胞融合度达到50%时,按照试剂盒说明书将circ-TLK1过表达载体及空载Vector、si-circ-TLK1(5’-GGACATCTCAAA- AAGGCAACA-3’)及si-NC、miR-367-3pmimics、miR-367-3pinhibitors 及相应对照、TLR4过表达载体质粒及空载pcDNA 转染至SK-N-SH 细胞。
2.4 MTT 法检测细胞存活率
取处于对数生长期的SK-N-SH 细胞,以2×104/孔接种于6 孔板中,培养12 h,加入不同质量浓度(20、40、80 µg/mL)的葛根素或用质粒转染,对照组加入不含药物的无糖DMEM 培养基,于5% CO2、1% O2、94% N2、37 ℃的培养箱中培养12 h;将培养基更换成DMEM 高糖培养基,于5% CO2、饱和湿度、37 ℃的培养箱中培养24 h。按“2.2”项下方法检测细胞存活率。
2.5 流式细胞术检测细胞凋亡情况
按“2.4”项下方法处理细胞,收集细胞,分别加入Annexin V-FITC 和PI 染液,孵育15 min,采用流式细胞仪检测细胞凋亡情况。
2.6 ELISA 法检测上清液中IL-6 和TNF-α 水平
按“2.4”项下方法处理细胞,收集上清液,按ELISA 试剂盒说明书测定IL-6 和TNF-α 水平。
2.7 qRT-PCR 检测 circ-TLK1 和 miR-367-3p mRNA 表达情况
按“2.4”项下方法处理细胞,收集细胞,按照试剂盒说明书提取总RNA 并合成cDNA,进行qRT-PCR 分析。引物序列见表1,将U6作为miR-367-3p内参,将GAPDH作为circ-TLK1内参。
2.8 双荧光素酶标记实验检测荧光素酶活性
将包含miR-367-3p结合位点的circ-TLK1的野生型序列(WT-circ-TLK1)或不具有miR-367-3p 结合位点的突变体(MUT-circ-TLK1)插入pmirGLO载体,将质粒与miR-367-3p mimics或miR-NC共转染至SK-N-SH 细胞,采用双荧光素酶标记试剂盒考察荧光素酶活性。
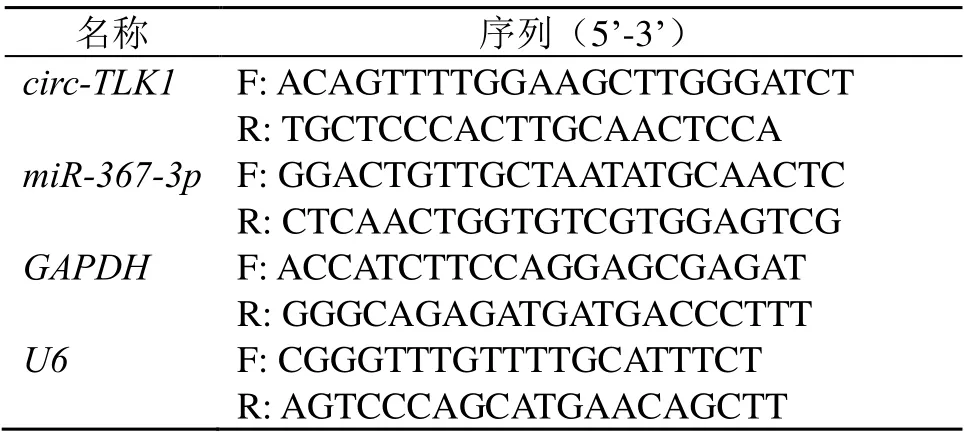
表1 引物信息Table 1 Primer information
2.9 RIP 实验检测miR-367-3p 与circ-TLK1 和TLR4 结合关系
以预冷的PBS 洗涤SK-N-SH 细胞2 次,加入裂解液于冰上裂解,收集上清液,于 -80 ℃保存。制备重悬磁珠,加入IgG 或Ago2 抗体孵育,弃上清,以洗涤液洗涤3 次,加入免疫沉淀缓冲液,离心取上清,提取免疫沉淀的RNA,并通过qRT-PCR检测,以确认结合靶点的富集水平。
2.10 Western blotting 法检测TLR4 蛋白表达情况
按“2.4”项下方法处理细胞,收集细胞,加入RIPA 裂解液,提取蛋白,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,于5%脱脂牛奶封闭2 h,加入TLR4 抗体(1∶1000),4 ℃孵育过夜;洗涤3 次后,加入HRP 标记的IgG 二抗,孵育2 h,使用ECL 试剂盒显色,采用Image J软件分析。
2.11 统计学分析
采用SPSS 21.0 软件对数据进行统计学分析,数据以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。
3 结果
3.1 葛根素抑制OGD 所致的SK-N-SH 细胞损伤
如图1-A 所示,随着OGD 作用时间的延长,SK-N-SH 细胞存活率显著降低(P<0.05、0.01、0.001),后续选择12 h 作为OGD 的处理时间。如图1-B~D 所示,与对照组比较,模型组细胞存活率显著降低(P<0.001),凋亡率显著升高(P<0.001),IL-6 和TNF-α 水平显著升高(P<0.001);与模型组比较,葛根素组细胞存活率显著升高(P<0.05、0.01、0.001),细胞凋亡率显著降低(P<0.01、0.001),IL-6 和TNF-α 水平显著降低(P<0.01、0.001),表明葛根素对OGD 致细胞损伤具有保护作用,选择40 μg/mL 葛根素进行后续研究。

图1 葛根素抑制OGD 所致的SK-N-SH 细胞损伤Fig.1 Puerarin inhibited SK-N-SH cells damage induced by OGD
3.2 过表达circ-TLK1 逆转葛根素对OGD 所致的SK-N-SH 细胞损伤的保护作用
如图2 所示,与对照组比较,模型组细胞circ-TLK1mRNA 表达水平显著升高(P<0.001);与模型组比较,葛根素组细胞circ-TLK1mRNA 表达水平显著降低(P<0.001),表明葛根素对OGD致SK-N-SH 细胞损伤的保护作用可能与circ-TLK1的表达有关。转染过表达circ-TLK1后,细胞circ-TLK1mRNA 表达水平表达显著升高(P<0.001),细胞存活率显著降低(P<0.05),细胞凋亡率显著升高(P<0.01),IL-6 和TNF-α 水平显著升高(P<0.01、0.001),表明过表达circ-TLK1能够逆转葛根素对OGD 致SK-N-SH 细胞损伤的保护作用。

图2 过表达circ-TLK1 逆转葛根素对OGD 所致的SK-N-SH 细胞损伤的保护作用Fig.2 Overexpression of circ-TLK1 reversed protective effect of puerarin on SK-N-SH cells injury induced by OGD
3.3 葛根素通过circ-TLK1 靶向调控miR-367-3p对OGD 所致的SK-N-SH 细胞损伤的保护作用
如图3 所示,采用生物信息学在线软件预测circ-TLK1的下游靶点,发现miR-367-3p和circ-TLK1间存在特异性靶向结合位点,提示miR-367-3p可能是circ-TLK1的直接靶点。采用双荧光素酶报告基因实验和RIP 实验验证miR-367-3p和circ-TLK1的靶向关系,结果显示,与miR-NC组相比,miR-367-3p 组WT-circ-TLK1 荧光素酶相对活性显著降低(P<0.001),MUT-circ-TLK1 荧光素酶相对活性无明显改变;与IgG 组相比,Ago2组miR-367-3p和circ-TLK1的富集水平均显著升高(P<0.001),表明miR-367-3p可通过结合位点与circ-TLK1特异性结合。

图3 circ-TLK1 与miR-367-3p 靶向调控作用Fig.3 Targeted regulation of circ-TLK1 and miR-367-3p
与对照组相比,模型组miR-367-3pmRNA 表达水平显著降低(P<0.001);与si-NC 组相比,si-circ-TLK1组circ-TLK1mRNA 表达水平显著降低(P<0.001),miR-367-3pmRNA 表达水平显著升高(P<0.01);与Vector组相比,circ-TLK1 组circ-TLK1mRNA 表达水平显著升高(P<0.001),miR-367-3pmRNA 表达水平显著降低(P<0.05),表明circ-TLK1能够靶向负调控miR-367-3p的表达。
如图4 所示,与对照组相比,模型组miR-367-3pmRNA 表达水平显著降低(P<0.001);与模型组相比,葛根素组miR-367-3pmRNA 表达水平显著升高(P<0.001),表明葛根素对OGD 致SK-N-SH 细胞损伤的保护作用可能与miR-367-3p的表达有关。通过转染抑制miR-367-3p表达,结果显示,与葛根素+anti-miR-NC 组相比,葛根素+anti-miR-367-3p 组miR-367-3pmRNA 表达水平显著降低(P<0.001),细胞存活率显著降低(P<0.05),细胞凋亡率显著升高(P<0.001),IL-6 和TNF-α 水平显著升高(P<0.001),表明抑制miR-367-3p能够逆转葛根素对OGD 致SK-N-SH 细胞损伤的保护作用。
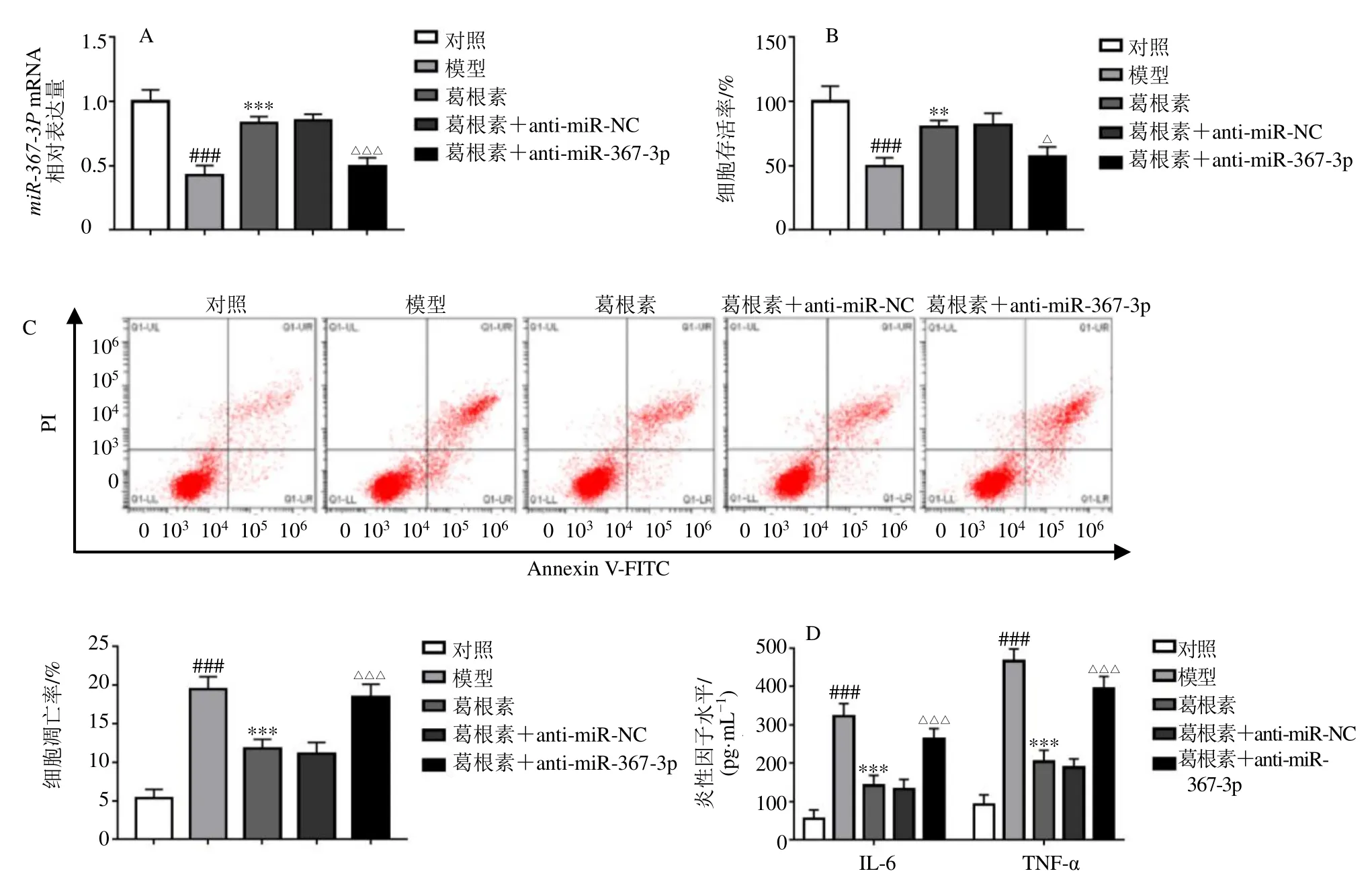
图4 葛根素通过促进miR-367-3p 表达对OGD 致SK-N-SH 细胞损伤发挥保护作用Fig.4 Puerarin protected SK-N-SH cells from OGD induced damage by promoting miR-367-3p expression
3.4 葛根素通过miR-367-3p 靶向调控TLR4 对OGD 所致的SK-N-SH 细胞损伤的保护作用
如图5 所示,采用生物信息学在线软件预测miR-367-3p的下游靶基因,发现miR-367-3p和TLR4间存在特异性靶向结合位点,提示TLR4可能是miR-367-3p的直接靶基因。采用双荧光素酶报告基因实验和RIP 实验验证miR-367-3p和TLR4的靶向关系,结果显示,与miR-NC 组相比,miR-367-3p组WT-TLR4 荧光素酶相对活性显著降低(P<0.001),MUT-TLR4 荧光素酶相对活性无明显改变;与IgG 组相比,Ago2 组TLR4和circ-TLK1的富集水平显著升高(P<0.001),表明miR-367-3p可通过结合位点与TLR4特异性结合。
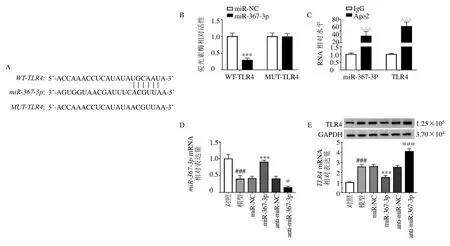
图5 TLR4 和miR-367-3p 靶向调控作用Fig.5 Targeted regulation of TLR4 and miR-367-3p
与对照组相比,模型组TLR4 蛋白表达水平显著升高(P<0.001);与miR-NC 组相比,miR-367-3p组miR-367-3pmRNA 表达水平显著升高(P<0.001),TLR4 蛋白表达水平显著降低(P<0.001);与 anti-miR-NC组相比, anti-miR-367-3p 组miR-367-3pmRNA 表达水平显著降低(P<0.05),TLR4 蛋白表达水平显著升高(P<0.001),表明miR-367-3p能够靶向负调控TLR4表达。
如图6 所示,与对照组相比,模型组TLR4 蛋白表达水平显著升高(P<0.001);与模型组相比,葛根素组TLR4蛋白表达水平显著降低(P<0.001),表明葛根素对OGD 致SK-N-SH 细胞损伤的保护作用可能与TLR4 表达有关。通过转染过表达TLR4,结果显示,与葛根素+pcDNA 组相比,葛根素+TLR4 组TLR4 蛋白表达水平显著升高(P<0.001),细胞存活率显著降低(P<0.05),细胞凋亡率显著升高(P<0.001),IL-6 和TNF-α 水平显著升高(P<0.001),表明过表达TLR4能够逆转葛根素对OGD致SK-N-SH 细胞损伤的保护作用。
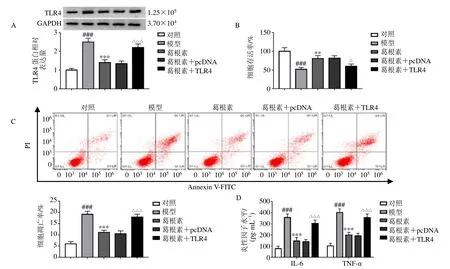
图6 葛根素通过抑制TLR4 表达对OGD 致SK-N-SH 细胞损伤发挥保护作用Fig.6 Puerarin protected SK-N-SH cells from OGD induced damage by inhibiting TLR4 expression
3.5 葛根素通过调控 circ-TLK1/miR-367-3p/ TLR4 抑制OGD 所致的SK-N-SH 细胞损伤
如图7 所示,与对照组相比,模型组TLR4 蛋白表达水平显著升高(P<0.001);与si-NC 组相比,si-circ-TLK1 组TLR4 蛋白表达水平显著降低(P<0.001);与si-circ-TLK1+anti-miR-NC 组相比,si-circ-TLK1+anti-miR-367-3p 组TLR4 蛋白表达水平显著升高(P<0.01);与模型组相比,葛根素组TLR4 蛋白表达水平显著降低(P<0.001);与葛根素+Vector 组相比,葛根素+circ-TLK1 组TLR4 蛋白表达水平显著升高(P<0.001);与葛根素+anti-miR-NC 组相比,葛根素+anti-miR-367-3p 组TLR4 蛋白表达水平显著升高(P<0.01)。

图7 葛根素对circ-TLK1/miR-367-3p/TLR4 的调控作用Fig.7 Regulatory effect of puerarin on circ-TLK1/miR-367-3p/TLR4
4 讨论
IS 为危害我国中老年人健康及生活质量的主要疾病,具有高发病率、高致残率、高死亡率及高复发率等特点[12-13]。研究发现,葛根中的葛根素可以改善血液循环并减少心血管和脑血管疾病;葛根素能够减少脑缺血再灌注引起的神经元损伤,并降低脑卒中神经细胞损伤过程[14-17]。本研究发现葛根素可以有效提高OGD 诱导的SK-N-SH 细胞存活率,降低细胞凋亡率,降低IL-6 和TNF-α 水平,表明葛根素对IS 神经细胞损伤具有保护作用。
CircRNA 在组织中特异性表达,具有高度同源性、结构稳定等特点[18-19]。本研究结果显示,OGD诱导的SK-N-SH 细胞中circ-TLK1mRNA 表达水平显著升高,与文献报道一致[10];葛根素显著下调circ-TLK1mRNA 表达,过表达circ-TLK1能够逆转葛根素对OGD 致SK-N-SH 细胞损伤的保护作用,表明葛根素通过降低SK-N-SH 细胞中circ-TLK1表达,从而发挥抗脑卒中的作用。circRNA 通常被用作miRNA 的分子海绵来调节mRNA 表达。研究发现,miR-367-3p具有明显的抗IS 的作用[20]。本研究结果显示,miR-367-3p为circ-TLK1的靶miRNA,circ-TLK1可以负向调节miR-367-3p表达;模型组SK-N-SH 细胞miR-367-3pmRNA 表达水平明显降低,葛根素显著上调miR-367-3pmRNA 表达,抑制miR-367-3p能够逆转葛根素对OGD 致SK-N-SH 细胞损伤的保护作用,表明葛根素可能通过下调circ-TLK1表达并上调miR-367-3p表达,从而发挥抗脑卒中的作用。
本研究通过生物信息学软件搜索miR-367-3p的靶基因,并将TLR4 确认为miR-367-3p的直接靶点。miR-497能够通过调节TLR4 和环磷腺苷反应元件结合蛋白(cAMP-responsive element-binding protein,CREB)信号传导途径减轻患者脑梗死[21]。miR-182-5p通过调节TLR4 介导的炎性反应,在脑缺血再灌注损伤中发挥神经保护作用[22]。本研究结果显示,模型组TLR4 蛋白表达水平显著降低,葛根素上调TLR4 蛋白表达,过表达TLR4能够逆转葛根素对OGD 致SK-N-SH 细胞损伤的保护作用;此外,circ-TLK1能够通过结合miR-367-3p来调节TLR4 蛋白表达。以上结果表明,葛根素通过circ-TLK1/miR-367-3p/TLR4 轴抑制IS 中的神经细胞损伤。
综上,葛根素能够有效提高IS 体外模型中SK-N-SH 细胞存活率,抑制细胞凋亡,减少炎性因子的分泌,对神经细胞损伤具有保护作用,其作用机制与调控circ-TLK1/miR-367-3p/TLR4 有关。
利益冲突所有作者均声明不存在利益冲突
