基于网络药理学的麦冬治疗糖尿病成分和机制及其配伍后作用通路改变研究△
2021-06-11席啸虎
席啸虎
山西省中医药研究院,山西 太原 030012
糖尿病在中医属于消渴范畴,以阴液亏损为本、燥热偏胜为标[1]。麦冬养阴润燥、清热生津,能疗消渴阴虚之本[2]。文献报道,麦冬发挥降血糖作用的成分多为麦冬多糖[3]。麦冬中还含有70余种甾体皂苷、30余种高异黄酮类化合物[4],其是否有潜在降血糖活性尚未明确。
中药中复杂的化学成分通过多靶点、多途径发挥作用,通过配伍和组方与其他药味相互作用,共同发挥药效[5-6]。网络药理学整体性、系统性和注重药物间相互作用的特点与中医药学的基本特点相吻合,有利于揭示中药复杂的作用机制[7]。
中医治疗糖尿病主要以清热润燥、养阴生津为主。由于本病常发生血脉瘀滞及阴损及阳的病变,且易并发痈疽、眼疾、劳嗽等证,故还应针对具体病情,及时合理地选用活血化瘀、清热解毒、健脾益气、滋补肾阴、温补肾阳等治法。麦冬养阴润燥、清热生津,疗消渴阴虚之本,黄芪补气升阳、布津摄液;北沙参多入上焦,清肺热、养肺阴,麦冬善入中焦,清胃热、益胃阴,两药相须为用;丹参活血化瘀,黄连清热泻火,配伍麦冬增强清热之力,使火去而津液自复,补虚而泻实;麦冬-山药-五味子3药合用,可增强补肾养阴、润肺作用。本研究依据中医补气、滋阴、清热、活血、酸甘化阴等治疗糖尿病基本的组方配伍方式[8],研究麦冬单味药及配伍后治疗糖尿病的潜在活性成分及作用机制,为进一步结合麦冬配伍后成分变化规律、血清药物化学[9]、代谢组学[10]、体外及体内降血糖活性追踪等方法探究其具体成分群提供参考。
1 材料与方法
1.1 麦冬及其配伍后化学成分与靶点的获取
釆用TCMID(http://www.megabionet.org/tcmid/)、Batman-TCM(http://bionet.ncpsb.org/batman-tcm/)数据库,结合文献挖掘的方法,收集麦冬单味药及其配伍的化学成分[11]。
根据BATMAN-TCM数据库默认的阈值(prediction score cutoff>20),筛选可信度高的蛋白作为候选靶点,其中麦冬为重点研究对象,阈值选择prediction score cutoff>15。使用UniProt数据库(http://www.uniprot.org/)中UniProtKB功能,限定蛋白物种为人,校正蛋白名称。
1.2 糖尿病作用靶点的获取
在CTD(http://ctdbase.org/)、TTD (http://bidd.nus.edu.sg/group/cjttd/)、DrugBank (https://www.Drugbank.ca/)数据库输入diabetes、diabetes mellitus等关键词,获得糖尿病相关靶点[11]。
1.3 药味-成分-靶点网络的构建
将筛选得到的成分和靶点数据导入Cytoscape 3.7.2软件(http://www.cytoscape.org/),构建药味-成分-靶点网络[11]。
1.4 蛋白质-蛋白质相互作用(PPI)网络构建及分析
使用STRING 10.0(http://string-db.oig/)工具构建麦冬及其配伍后靶点PPI网络,并进行拓扑分析和模块分析。拓扑分析采用Cytoscape 3.7.2软件进行Network Analyzer分析。以网络节点中的拓扑结构特征值度(degree)和中介中心度(betweenness centrality,BC)为指标筛选关键靶点。模块分析采用Cytoscape 3.7.2软件ClusterViz插件中的MCODE算法,设置score>2,即至少包含3条边[12]。
1.5 通路分析
通过DAVID 6.8(https://david.ncifcrf.gov/)数据库对上述预测得到的关键靶点信息进行基因本体(GO)富集分析和京都基因与基因组百科全书(KEGG)通路注释分析,并运用GraphPad Prism 5绘图[12]。
2 结果
2.1 麦冬及其配伍后成分和靶点筛选
共筛选得到麦冬化学成分22个、靶点236个,黄芪化学成分和靶点分别为35、415个,麦冬与黄芪配伍共有靶点为96个;黄连化学成分和靶点分别为23、132个,麦冬与黄连配伍共有靶点为24个;山药化学成分和靶点分别为20、478个,五味子化学成分和靶点分别为112、930个,麦冬与山药、五味子配伍共有靶点为146个;丹参化学成分和靶点分别为75、769个,麦冬与丹参配伍共有靶点为82个;北沙参化学成分和靶点分别为17、181个,麦冬与北沙参配伍共有靶点为172个。
2.2 糖尿病靶点筛选
基于多个数据库共检索到糖尿病相关靶点181个,其中麦冬涉及靶点20个,占糖尿病靶点数的11.05%;麦冬与黄芪共有相关靶点13个,黄芪涉及靶点27个,分别占糖尿病靶点数的7.18%、14.91%;麦冬与黄连共有相关靶点9个,黄连涉及靶点13个,分别占糖尿病靶点数的4.97%、7.18%;麦冬与山药共有相关靶点14个,山药涉及靶点32个,分别占糖尿病靶点数的7.73%、17.68%;麦冬与五味子共有相关靶点13个,五味子涉及靶点41个,分别占糖尿病靶点数的7.18%、22.65%;麦冬与丹参共有相关靶点9个,丹参涉及靶点41个,分别占糖尿病靶点数的4.97%、22.65%;麦冬与北沙参共有相关靶点11个,北沙参涉及靶点13个,分别占糖尿病靶点数的6.08%、7.18%;麦冬与各药味配伍后,涉及靶点58个,占糖尿病靶点数的32.04%。药味-成分-靶点网络见图1。

图1 麦冬及其配伍治疗糖尿病的药味-成分-靶点网络
2.3 PPI网络分析
使用STRING工具构建PPI网络,见图2。其中麦冬单味药治疗糖尿病靶点的PPI网络包括20个节点和24条边;麦冬与黄芪配伍治疗糖尿病靶点的PPI网络包括33个节点和74条边;麦冬与黄连配伍治疗糖尿病靶点的PPI网络包括24个节点和36条边;麦冬与丹参配伍治疗糖尿病靶点的PPI网络包括51个节点和259条边;麦冬与北沙参配伍治疗糖尿病靶点的PPI网络包括22个节点和33条边;麦冬与山药、五味子配伍治疗糖尿病靶点的PPI网络包括48个节点和244条边;麦冬与所有药味共同配伍后,共包括58个节点和330条边。
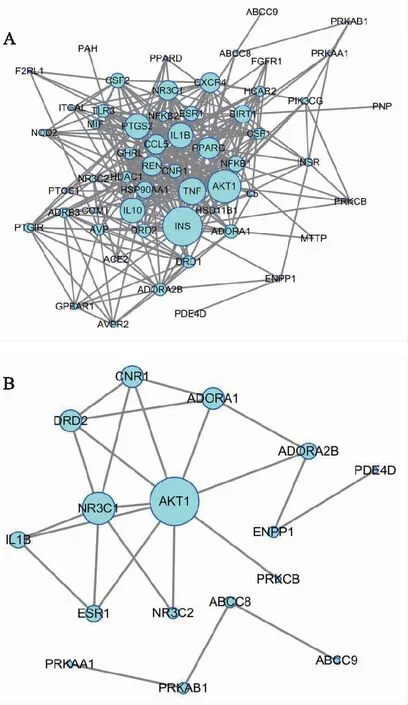
注:A.麦冬与其他药味配伍;B.麦冬单味药;FBP1、MTTP、PPARD、PNP等无蛋白间相互作用。图2 麦冬及其配伍治疗糖尿病活性靶点PPI网络
麦冬配伍后治疗糖尿病靶点网络的拓扑属性分析结果见表1。通过对连接度排序靠前的靶点及麦冬单味药靶点进行模块分析,发现蛋白激酶B1(Akt1)、大麻素受体1(CNR1)、多巴胺受体D2(DRD2)等为主要相关靶点,预测麦冬及其配伍通过影响中枢系统进而调节血糖。模块分析结果显示,score>2的靶点根据打分排序聚成3类,不同模块对应参数见表2,靶点间相互关系见图3,模块对应的生物过程(BP)、分子功能(MF)、细胞组成(CC)及KEGG通路富集分析见表3。

表1 麦冬配伍后治疗糖尿病靶点的拓扑属性分析(前20位)

表2 麦冬配伍后治疗糖尿病靶点模块参数

图3 麦冬配伍后治疗糖尿病靶点模块关联分析

表3 麦冬配伍后治疗糖尿病靶点富集分析
2.4 通路分析
2.4.1GO富集分析 将麦冬及其配伍治疗糖尿病交集网络中的靶点通过DAVID数据库进行GO富集分析,从BP、MF、CC 3个不同角度对基因功能进行注释[P<0.05,错误发现率(FDR)<0.05]。GO富集分析结果显示,麦冬单味药靶标基因主要富集在58个BP、19个CC和6个MF。麦冬配伍后靶标基因富集在206个BP、31个CC和18个MF。其中按照显著性由高到低进行排序,排名前14位的结果见图4~5。

图4 麦冬治疗糖尿病GO富集分析
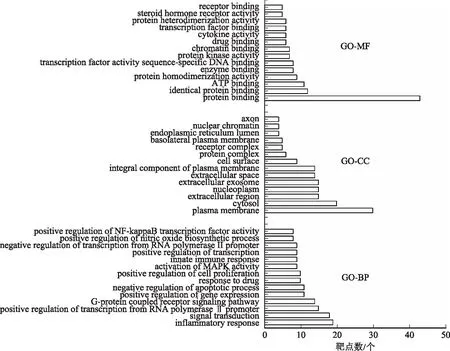
图5 麦冬配伍后GO富集分析
2.4.2KEGG分析 将麦冬及其配伍治疗糖尿病交集网络中的靶点通过DAVID数据库进行KEGG富集分析,结果显示,麦冬单味药具有显著意义的通路有14条,配伍后增加至63条(P<0.05,FDR<0.05)。排名前14位的结果见图6~7。

图6 麦冬治疗糖尿病KEGG通路分析

图7 麦冬配伍后KEGG通路分析
3 讨论
本研究结果表明,麦冬单味药中麦冬皂苷、麦冬黄烷酮、甲基麦冬黄烷酮等成分可以直接作用于相关靶点起到糖尿病治疗作用。麦冬配伍后,治疗糖尿病的相关靶点增加,成分之间相互作用也增加。其中,涉及到的活性成分包括黄芪中的黄芪甲苷类、黄芪素等,五味子中的五味子醇甲、木脂素类、烯类等,黄连中的生物碱类,山药中的尿囊素、山药素,丹参中的丹参酮类、丹参酚醌类及北沙参中的槲皮素、谷甾醇等。说明麦冬可能通过与其他药味或其中成分的相互作用及靶点蛋白之间相互作用增强治疗糖尿病的活性并扩大功能通路。基于网络药理学数据分析,麦冬甲基高异黄酮A和麦冬甲基高异黄酮B表现出直接或间接的治疗糖尿病活性,可作为重点研究对象。
依据PPI分析、模块分析、通路分析及BATMAN-TCM数据库蛋白可信度值 (prediction score)等结果显示,麦冬单味药涉及的关键靶点为Akt1、CNR1、DRD2等,KEGG通路主要涉及Ras相关蛋白1(Rap1)、环磷腺苷(cAMP)、腺苷酸活化蛋白激酶(AMPK)等,生物学过程主要包括三磷酸腺苷结合(ATP binding)、质膜(plasma membrane)、信号转导(signal transduction)等。麦冬通过配伍新增关键靶点为INS、肿瘤坏死因子(TNF)、白细胞介素-10(IL-10)等,新增通路为磷脂酰肌醇3-激酶/蛋白激酶(PI3K/Akt)、癌症(cancer)、TNF等,新增生物学过程为蛋白结合(protein binding)、炎症反应(inflammatory response)等。下丘脑-垂体-肾上腺(hypothalamo-pituitary-adrenal,HPA)轴作为机体能量代谢的调节中枢,在2型糖尿病发生过程中起重要作用。下丘脑内分布有大量CNR1,大麻素系统可广泛调节中枢神经系统神经元的功能。CNR1可通过调节HPA轴改善2型糖尿病指标[13]。PI3K/Akt是胰岛素信号传导的经典途径,DRD2可通过影响下游细胞内信号转导通路关键基因PI3K、Akt在外周细胞中的表达水平改善糖代谢[14],但配伍成分及具体机制不明确,是麦冬相关研究的关键突破点。Rap1是一种控制细胞粘附、细胞-细胞连接形成和细胞极性等多种过程的小三磷酸鸟苷环水解酶(GTPase),可调控下游PI3K、Akt因子,改善血糖水平。cAMP是环核苷酸系统的一种,腺苷酸环化酶-环磷腺苷-蛋白激酶A(AC-cAMP-PKA)途径在糖尿病大鼠周围神经中表达水平下降,活性成分通过调控AC-cAMP-PKA途径防治糖尿病神经病变[15]。AMPK对糖代谢的调节主要是增加葡萄糖摄取,增加糖酵解并抑制糖异生,AMPK是一种丝氨酸/苏氨酸蛋白激酶,激活后能够改善胰岛素敏感性及葡萄糖稳态,对糖代谢的调节主要是增加葡萄糖摄取,增加糖酵解并抑制糖异生[16]。
本研究通过网络药理学方法初步确定麦冬单味药及其配伍后改善糖尿病的物质基础及作用机制。研究结果表明,麦冬治疗糖尿病的物质基础与其配伍、组方密不可分,通过有效配伍后作用通路显著增加。该结果提示,麦冬中的部分化学成分可以通过直接作用治疗糖尿病,另一些成分可以通过配伍促进其他成分显效或被其他成分辅助显效,其中涉及的所有成分,均可认定为麦冬治疗糖尿病物质基础组群。这种配伍后活性和机制的改变与化学成分含量改变有关,同时与成分作用的蛋白靶点之间的相互作用有关。本课题组后续拟进一步基于网络药理学数据、配伍后成分变化情况、活性成分追踪结果、血清药物化学分析等,通过多层次信息挖掘与融合,总结麦冬治疗糖尿病相关活性组分群。通过在活性组分群中主要成分有序、有效捕获(增加)/扣除(减少)后体外、体内活性对比研究,明确麦冬相关配伍成分及其作用贡献度。
