核桃JrGRAS基因家族鉴定与响应低温胁迫基因筛选
2021-06-11赵星哲王红霞赵书岗张俊佩马庆国张志华
刘 凯,赵星哲,王红霞,赵书岗,张俊佩,马庆国,张志华
(1.河北农业大学 园艺学院,河北 保定 071001;2.河北省山区农业技术创新中心,河北 保定 071001; 3.河北农业大学 生命科学学院,河北 保定 071001;4.中国林业科学研究院林业研究所/国家林业和草原局林木培育重点实验室,北京 100091)
核桃是世界范围内占有重要地位的经济类果树之一,高温、低温、重金属等非生物环境因素会严重影响其正常生长发育,造成较大的经济损失[1]。晚霜易造成核桃的花芽、嫩梢、花器和幼果受冻,影响产量,严重时可使核桃绝收,造成大小年现象。而我国北方地区,春季周期性寒流是不可避免的。因此,如何防治核桃冷害已成为生产上亟待解决的问题[2]。
GRAS家族是一类仅存在于植物体内的转录调控因子,由最初发现的3个家族成员GAI(gibberellic acid insensitive)、RGA (repressor of GA1-3 mutant)、SCR (scarecrow)的特征字母命名[3],一般由 400~800 个氨基酸残基组成,该蛋白的C端是高度保守的[4],分成8个分支,分别为:SCL3、SHR、PAT1、LISCL、DELLA、SCR、LS和HAM[5]。目前已在桃[6]、铁皮石斛[7]、甜橙[8]、辣椒[9]等多种植物中发现GRAS转录因子。GRAS家族蛋白在赤霉素(GA)信号转导[10]、腋芽及根的发育、光信号通路、结瘤信号转导及在逆境胁迫中发挥作用[11],多项研究表明GRAS转录因子家族成员广泛参与到植物响应非生物胁迫过程中[12-13],特别是调节植物抗寒性[14-15]。李丽丽等[16]研究发现,GRAS转录因子LaSCL18基因表达与独行菜幼苗耐受低温有关;袁阳阳等[17]以山葡萄为试材,证实了GRAS转录因子VaPAT1在调节植物抗逆的过程中特别是低温过程起正向调控作用。然而在核桃中GRAS家族成员和核桃抗寒性之间的关系报道较少。本研究通过生物信息学在核桃基因组中挖掘GRAS转录因子家族成员,并分析该家族成员理化性质、基因结构、保守基序、进化关系、启动子区域结合位点及蛋白功能互作,解析核桃GRAS转录因子家族响应低温胁迫的转录因子,研究将为逆境应答过程中GRAS转录因子的调控网络与核桃抗逆分子遗传改良以及分子育种奠定基础。
1 材料与方法
1.1 材料与处理
供试材料核桃(Juglans regiaL.)种植于河北农业大学标本园,盆栽,同一砧木嫁接‘辽宁8号’(耐低温)和‘清香’(不耐低温),2年生苗。用于后续研究的试验材料分为正常组(冷处理0 h)和0.5 ℃冷处理48 h。采集第1片复叶中自单叶起左数第2叶片送至北京诺禾致源科技股份有限公司用于RNA-Seq测序,3株混合后为1次,共3次重复。
1.2 试验方法
1.2.1 核桃JrGRAS基因家族分析 根据TAIR(https://www.arabidopsis.org/)拟 南 芥JrGRAS家族蛋白序列信息应用HMMER 3.1b软件构建隐马尔科夫模型,并于NCBI搜索下载核桃蛋白序列(www.ncbi.nlm.nih. gov/genome/?term=txid51240[orgn],GCF_001411555.1),并结合转录组分析对家族成员进行鉴定。利用欧洲生物信息学研究所的PFAM蛋白质家族数据库分析蛋白保守结构域,利用在线分析工具Gene Structure Display Server和MEME(http://meme-suite.org/)对核桃JrGRAS家族基因进行基因结构和保守基序分析。利用MEGA7.0软件中的生物进化距离法(Neighbour-Joining, NJ)构建JrGRAS和AtGRASs家族系统发生树,Bootstrap值为1 000。
1.2.2 核桃JrGRAS基因的生物信息学分析 利用NCBI上的ORF Finder (https://www.ncbi.nlm.nih.gov/orffnder/)查找JrGRAS基因家族成员的ORF。蛋白质的理化性质使用ExPASy (https://web.expasy.org/protparam/)在线网站分析;利用NetPhos 3.1 Server和Net NGlyc 1.0 Server分别预测蛋白的糖基化和磷酸化位点;利用 SignalP 3.0 Server(http://www.cbs.dtu.dk/services/SignalP)在线工具对信号肽预测;TMHMM 法分析蛋白质的跨膜区:基于 HMM 方法(http://www.cbs.dtu.dk/services/TMHMM/)的蛋白质跨膜区预测工具;利用ngLOC与Nuc-PLoc在线软件预测亚细胞定位;利用STRING在线分析蛋白互作;利用Plantcare在线工具分析基因家族成员启动子序列功能。
1.2.3 核桃JrGRAS基因家族转录表达分析 利用转录组分析低温胁迫48 h后‘辽宁8号’(耐低温)和‘清香’(不耐低温)转录表达分析,以FPKM 为基因表达量衡量标准,以 padj <0.05 和log2(golden change >0)为筛选差异表达阈值,筛选差异表达基因。
2 结果与分析
2.1 核桃基因组GRAS家族成员鉴定及分析
2.1.1 核桃基因组GRAS家族成员基本信息及理化性质分析 利用拟南芥GRASs家族蛋白序列构建隐马尔科夫模型,结合RNA-seq分析,初步筛选出79个核桃JrGRASs家族基因。利用Pfam结构域分析,去除冗余后最终获得62个核桃GRASs家族基因(表1),编码63条蛋白质序列,根据分子量大小对其命名。该家族成员中基因长度最短的为1 371 bp(JrGRAS11),最长为5 713 bp(JrGRAS32);开放阅读框长度在1 263~ 2 472 bp;翻译得到的JrGRASs蛋白质的长度处于420 ~ 823个氨基酸之间;等电点在4.77~8.40之间,有97 %核桃JrGRASs家族成员为偏酸性蛋白。
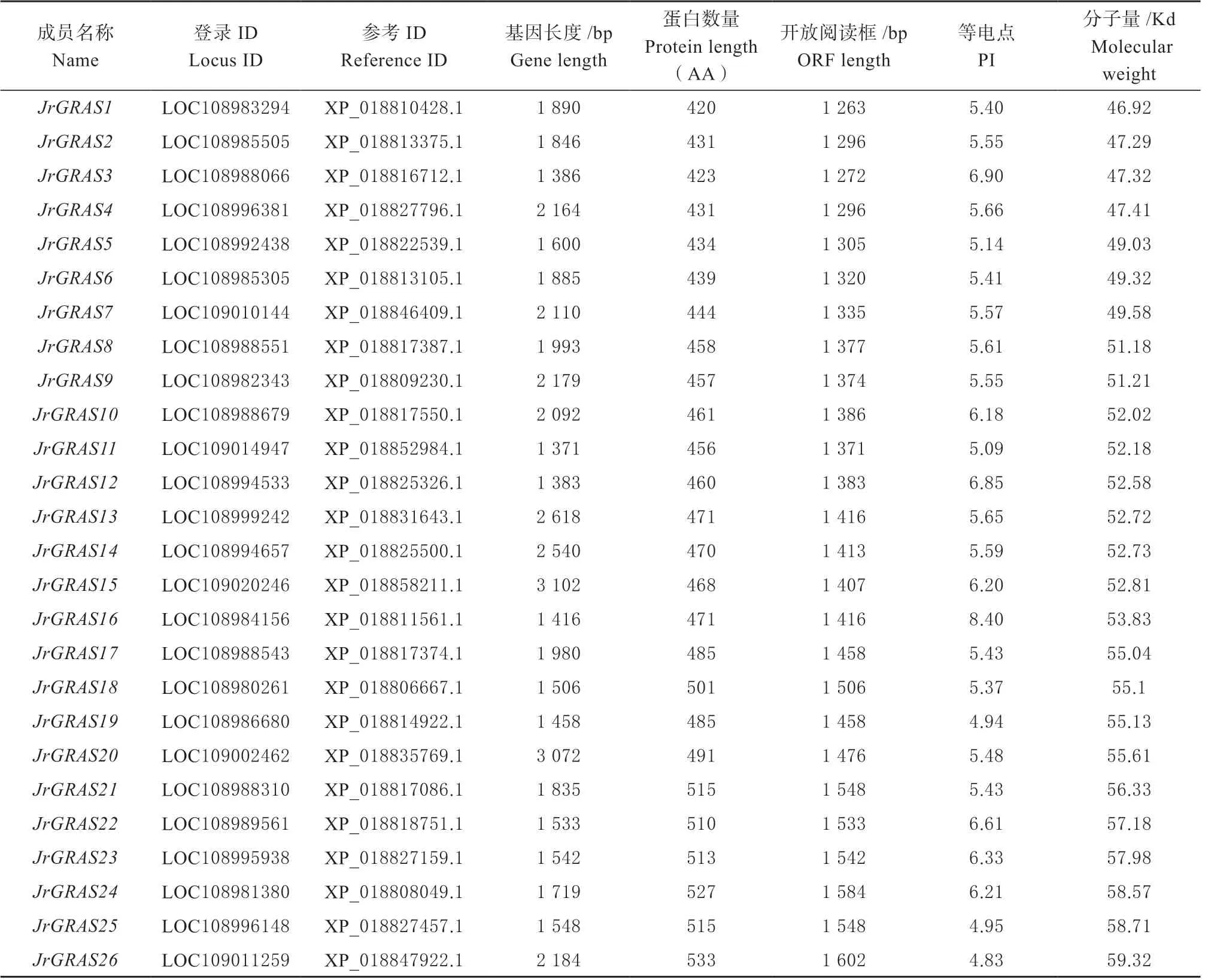
表1 核桃JrGRAS家族成员的基因信息Table 1 Basic information of JrGRAS family genes from walnut

续表:
利用ExPasy对基因的蛋白大小(kDa)、稳定系数等、疏水性、等蛋白理化性质进行预测(表2),JrGRASs的分子量在46.92~89.97 kD之间;JrGRASs蛋白的不稳定系数介于34.43~61.97之间,仅有17%为稳定蛋白,其余蛋白均为不稳定蛋白;JrGRASs蛋白的平均疏水性介于-0.626~-0.058之间,其家族蛋白均为亲水蛋白;利用 SignalP 3.0 Server在线工具和TMHMM法分析蛋白质的信号肽预测和跨膜结构,结果显示核桃JrGRASs家族除JrGRAS3、JrGRAS11、JrGRAS16、JrGRAS29、JrGRAS39、JrGRAS50和JrGRAS60外其余各成员无跨膜结构,除JrGRAS12外其余各成员无信号肽分泌蛋白;利用ngLOC和Nuc-PLoc在线软件预测结果显示,JrGRASs蛋白均定位于细胞核。
利 用Net NGlyc 1.0和NetPhos 3.1 Server预 测家族成员蛋白的磷酸化位点和糖基化,分析核桃JrGRASs家族成员在蛋白翻译后修饰的差异有助于后续对蛋白功能的研究。磷酸化位点结果显示JrGRASs家族蛋白均含有多个磷酸化位点(表2),主要体现在丝氨酸、苏氨酸和酪氨酸磷酸化位点数量的差异。其中,丝氨酸磷酸化位点在9~70个之间;苏氨酸磷酸化位点在3~24个之间;仅JrGRAS5和JrGRAS41不含有络氨酸磷酸化位点,其余蛋白含酪氨酸磷酸化位点在1~12个之间。通过对核桃JrGRASs家族成员N-糖基化和 O-糖化的潜在位点分析结果显示,除JrGRAS6、JrGRAS23、JrGRAS30和JrGRAS35外,其余JrGRASs蛋白的N-糖基化潜在位点数量在1~12个之间;另外核桃JrGRASs蛋白含有3~92个O-糖基化潜在位点。

表2 核桃JrGRAS家族蛋白的理化性质Table 2 Basic information of JrGRAS family genes in walnut

续表:
2.1.2 核桃基因组GRAS家族成员保守结构域分析 利用NCBI在线分析软件比对核桃GRAS家族成员的蛋白序列并分析其保守结构域(图1),看出核桃 63个家族成员含有典型的LAR1、LAR2、VHIID、PFYRE和SAM 5个保守的结构域,特别是VHIID区域高度保守,可以看出符合GRAS家族类型特点。
2.2 不同物种GRAS家族进化树分析
本研究对核桃(63个)、拟南芥(33个)GRAS 家族蛋白进行了系统发育分析(图2)。结果发现,核桃与拟南芥GRAS家族基因有一定的同源性。根据拟南芥分类将核桃分为9个亚族,HAM亚族最多,有17个成员,在LS亚组最少,只有1个。根据进化关系,在核桃中出现了一个新的亚族NEW CLASS,具体功能有待进一步研究。
2.3 核桃基因组GRAS家族基因结构与蛋白域保守结构域
为进一步研究核桃GRAS基因结构进化,首先对其外显子内含子结构进行分析(图3)。分析表明,除JrGRAS21、JrGRAS47、JrGRAS62、JrGRAS63,该GRAS家族成员均不含内含子,相同亚组中具有相似的基因结构。随后,利用 MEME 软件对这些蛋白序列和结构的保守性进行了分析(图4)。根据其保守基序分布,在核桃GRAS家族的63个成员间发现共同的保守基序,而且不同亚家族内的保守基序分布具有极高的相似度;但HAM亚家族中较其他亚族成员相比,缺少相应的保守基序,即motif 4。

图 2 核桃和拟南芥GRAS 家族基因的系统发育树分析Fig.2 Phylogenetic tree of JrGRAS family genes of Juglans regia and Arabidopsis thaliana
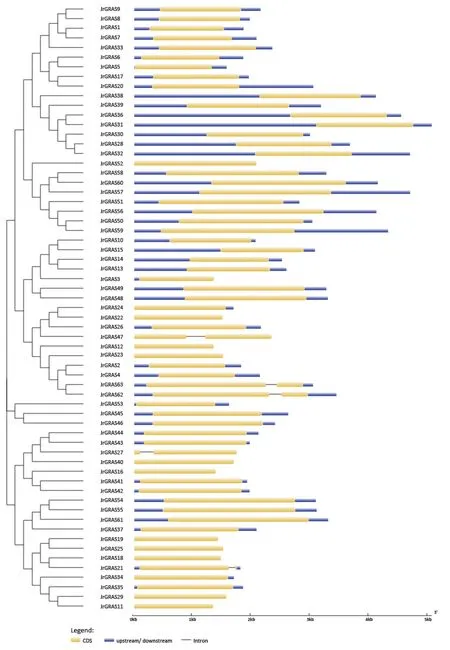
图 3 核桃JrGRAS家族基因结构Fig. 3 Gene structure analysis of JrGRAS family from Juglans regia
2.4 核桃GRAS家族基因启动子元件分析
利用Plantcare在线分析软件预测核桃GRAS基因启动子区与抗逆和激素相关元件的分布,结合基因结构分析,除无N端基因外,其他基因启动子区分析结果如图5所示,核桃GRAS基因启动子区存在丰富的激素信号和胁迫应答调控元件,较多成员含有光响应元件,可能与参与核桃响应非生物胁迫相关。
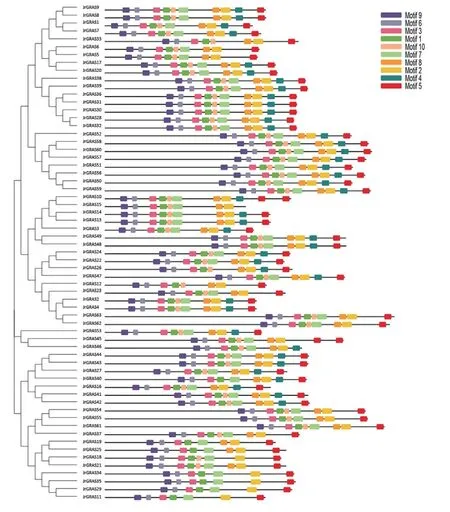
图 4 核桃JrGRAS家族蛋白保守基序分析Fig.4 Conserved motif analysis of JrGRAS family from Juglans regia

图 5 核桃GRAS启动子区与抗逆和激素相关元件分布Fig.5 Distribution of stress-related and hormone-related elements in the promoter region of JrGRAS genes
2.5 核桃GRAS家族蛋白互作预测
利用 STRING 分析该蛋白序列的互作蛋白(表3),以拟南芥蛋白数据库为参照,发现该家族成员中的差异表达基因与拟南芥SCR、SCL3、SHR、AT3G13840、PAT、RGL2、AT1G63100、LAS和SCL14同源关系较近,分析结果表明家族成员蛋白成员之间及与其他响应非生物胁迫蛋白和激素相关蛋白之间均可以发生互作,例如,JrGRAS8蛋白可以与GRAS家族成员HAM互作,JrGRAS14蛋白可以与GRAS家族成员赤霉素相关蛋白GAI蛋白互作;JrGRAS20蛋白与乙烯反应蛋白PLT1互作;JrGRAS39蛋白可以与生长素转运蛋白BIG蛋白互作;JrGRAS53蛋白与乙烯反应蛋白PLT1互作;JrGRAS41蛋白与介导CBF低温应激途径蛋白RGL2互作。通过对核桃GRAS家族蛋白互作预测有助于进一步解析GRAS家族成员作用机制。

表3 核桃GRAS家族蛋白互作信息Table 3 Protein interaction information of JrGRASs
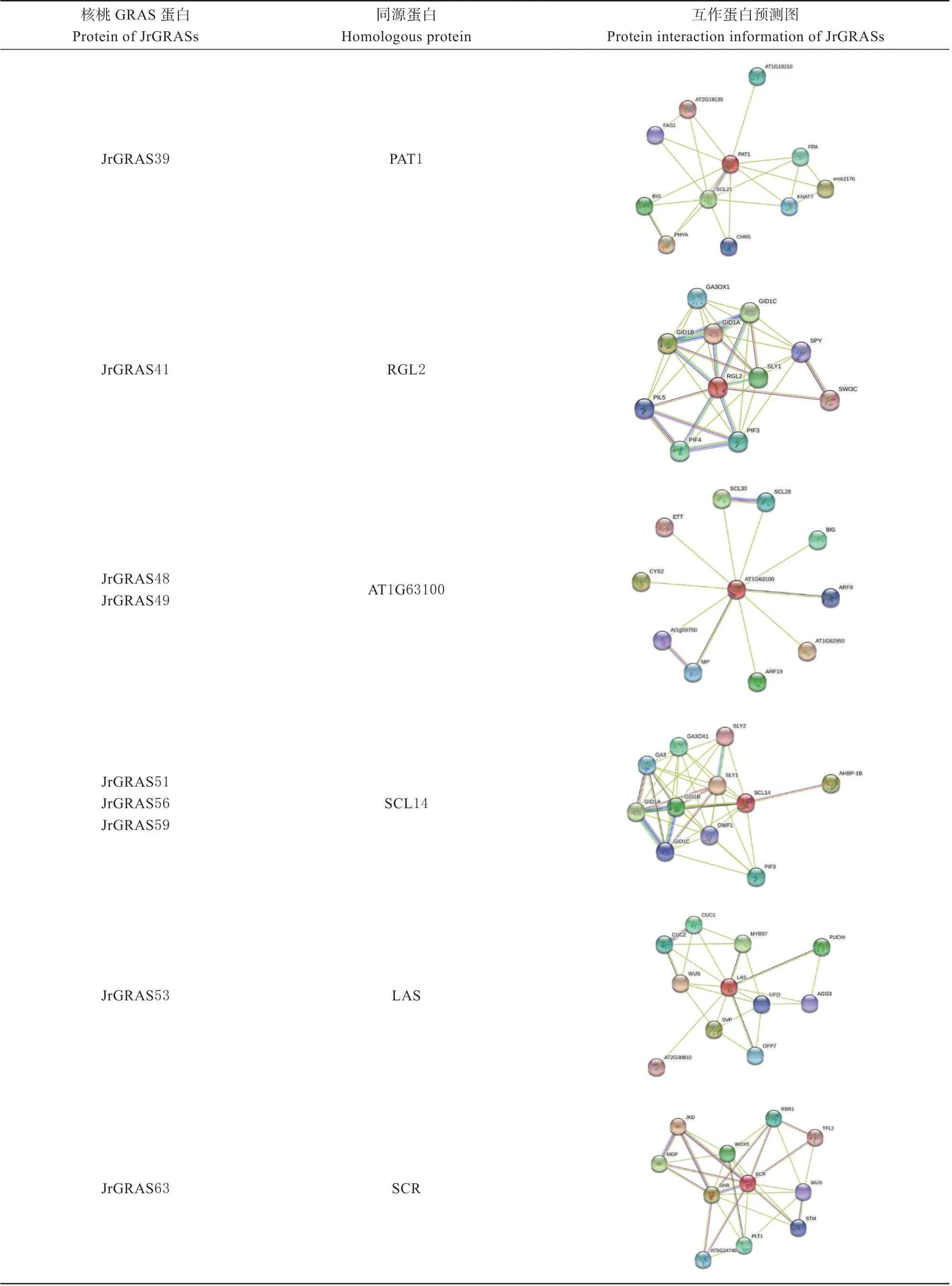
续表:
2.6 核桃GRAS家族成员转录表达分析
利用转录组分析低温胁迫48 h后‘辽宁8号’(耐低温)和‘清香’(不耐低温)转录表达分析,以 FPKM 为基因表达量衡量标准,核桃GRAS家族基因成员均出现了不同程度的变化(图6、7)。以 padj <0.05 and log2(golden change >0)为筛选差异表达阈值,发现在‘辽宁8号’中JrGRAS14、JrGRAS15、JrGRAS20、JrGRAS33、JrGRAS39、JrGRAS41、JrGRAS48、JrGRAS49、JrGRAS51、JrGRAS59和JrGRAS63为差异表达基因,而在‘清香’中为JrGRAS8、JrGRAS14、JrGRAS20、JrGRAS33、JrGRAS41、JrGRAS51、JrGRAS53和JrGRAS56。在‘辽宁 8 号’中,除JrGRAS14、JrGRAS15、JrGRAS59和JrGRAS63呈下降表达趋势外,其他7个基因成员呈上调表达趋势;在‘清香’中,除JrGRAS8、JrGRAS14、JrGRAS53和JrGRAS56呈下降表达趋势外,其他4个基因成员在低温条件下都增大了表达量。在‘辽宁8号’(耐低温)品种与‘清香’(不耐低温)品种共同差异表达基因为JrGRAS14、JrGRAS20、JrGRAS33、JrGRAS41、JrGRAS51和JrGRAS63,但 是 在‘辽 宁8号’(耐低温)品种特异性差异表达为JrGRAS15、JrGRAS39、JrGRAS48、JrGRAS49、JrGRAS59,在‘辽宁8号’(耐低温)品种特异性差异表达为JrGRAS53和JrGRAS56。本结果更有助于进一步为GRAS转录因子在低温胁迫中的调控机制研究奠定基础。

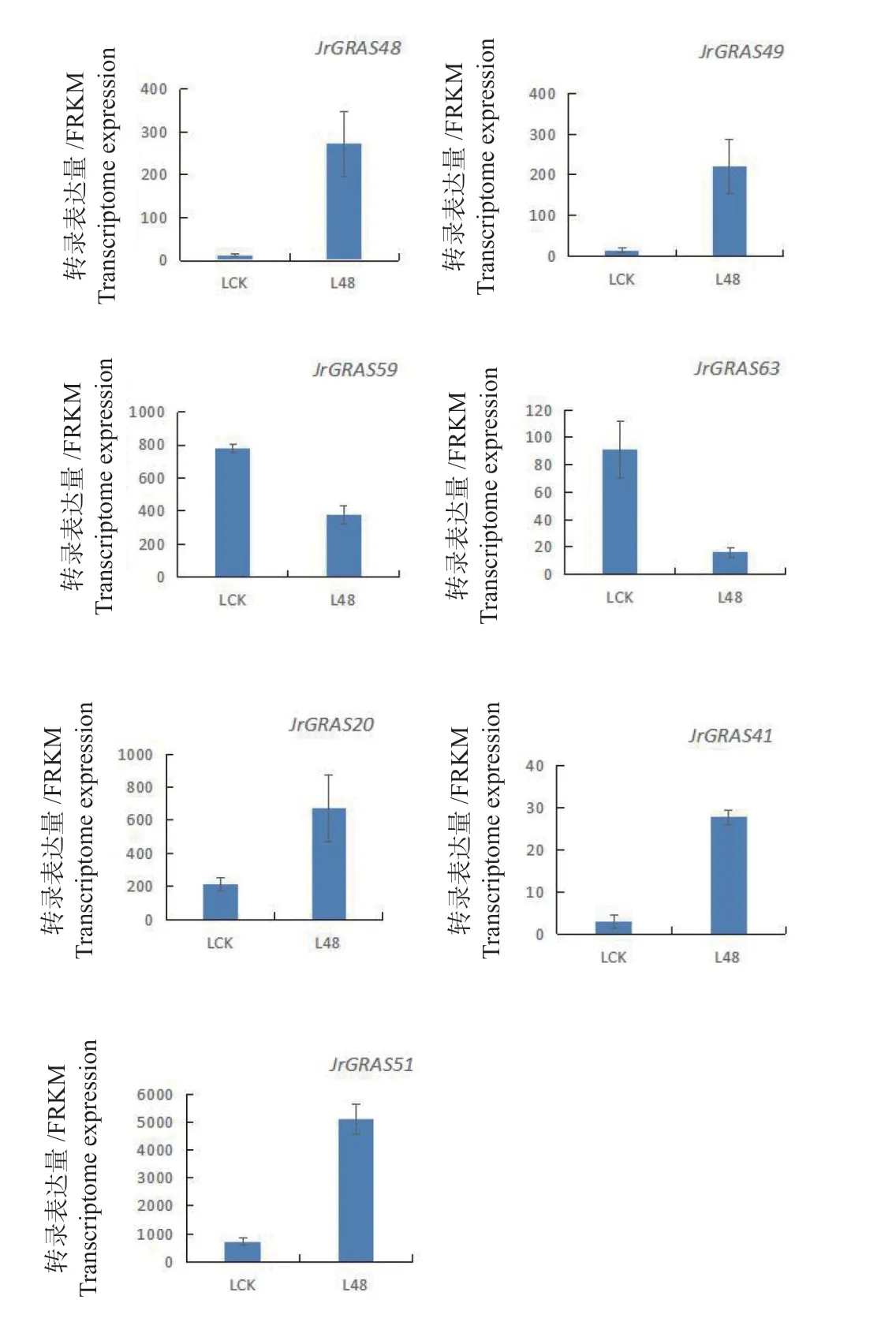
图 6 低温胁迫48h后‘辽宁 8 号’DEGs转录表达分析Fig.6 Transcriptional expression analysis of DEGs in‘Liaoning 8’after 48 hours of low temperature stress
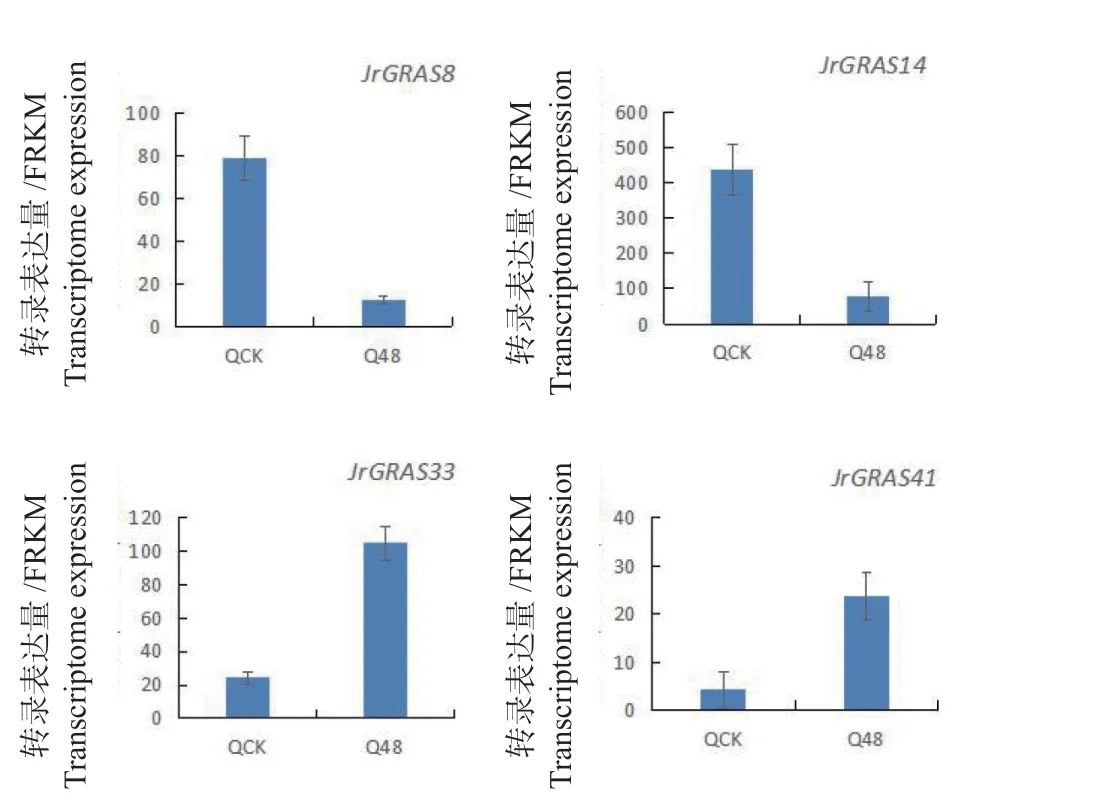

图 7 低温胁迫48h后‘清香’DEGs转录表达分析Fig.7 Transcriptional expression analysis of DEGs in‘Qingxiang’ after 48 hours of low temperature stress
3 讨论与结论
GRAS是在植物中参与生长发育和非生物胁迫重要的转录因子,而且在植物中广泛分布。目前在多种植物中已经鉴定出GRAS转录因子家族,桃48个[6],甜橙47个[7],葡萄91个[18],黄瓜37个[19]等。本研究通过转录组学与生物信息学结合鉴定出63个GRAS成员,由62条基因编码63个蛋白。GRAS结构域通常包含5个保守的结构域,2个亮氨酸七肽重复基序(LRI和LRII)位于以最突出的残基命名的VHIID基序的侧面,LR基序和VHIID基序对于蛋白质或DNA相互起重要作用[20]。利用NCBI在线分析软件比对核桃GRAS家族成员的蛋白序列并分析其保守结构域看出核桃63个家族成员含有典型 的LAR1、LAR2、VHIID、PFYRE和SAM 5个保守的结构域,可以看出符合GRAS家族类型特点,而且与桃[6]和拟南芥[21]中研究一致,也含有5个保守的结构域。
本研究将核桃和拟南芥GRAS家族蛋白进行了系统发育分析,根据拟南芥分类将核桃分为9个亚族,根据进化关系,在核桃中出现了一个新的亚族NEW CLASS,共7个家族成员,不属于已知的8个亚族,在桃[6]中也出现了区别于其他8个亚族的U族类似的现象,具体功能有待进一步研究。进行启动子功能预测发现发现核桃GRAS基因启动子区存在丰富的激素信号和胁迫应答调控元件[21-22],且较多成员含有光响应元件,进一步证明了可能与参与核桃响应非生物胁迫。利用 STRING 分析该蛋白序列的互作蛋白,以拟南芥蛋白数据库为参照,发现该家族成员中的差异表达基因与拟南芥SCR、SCL3、SHR、AT3G13840、PAT、RGL2、AT1G63100、LAS和SCL14同源关系较近,分析结果表明家族成员蛋白与其他蛋白之间均可以发生互作,而且有研究表明 GRAS家族成员蛋白与响应非生物胁迫相关,尤其在低温[23]、干旱[15]、盐[24]等。通过对核桃GRAS家族蛋白互作预测有助于进一步了解GRAS家族成员在核桃体内发挥的功能。
GRAS蛋白功能呈多样性,并在不同品种、不同组织和不同生长阶段所发挥的作用不尽相同[25-26]。目前,模式植物拟南芥的GRAS基因家族中的多个亚家族成员的功能已被验证[27]。本研究将同一砧木嫁接‘辽宁8号’(耐低温)和‘清香’(不耐低温)进行转录表达分析发现,核桃叶片中有多个GRAS家族成员响应低温处理14个DEGs,响应情况不尽相同。探索GRAS基因家族在核桃不同品种的表达差异有助于更好地了解其抗性表达,结合生物信息学进一步证实了转录组表达分析的准确性。这些研究将为我们解析核桃GRAS基因功能验证奠定基础,但具体作用机制有待进一步研究。
