CRISPR/Cas9技术介导Crx-iCreERT2红色荧光报告人胚胎干细胞系的构建及其三维视网膜类器官培养
2021-06-10杜雨馨刘依宗阎飞跃沈吟
杜雨馨 刘依宗 阎飞跃 沈吟
1武汉大学人民医院眼科中心 430060;2武汉大学医学研究院 430060
视网膜退行性疾病包括视网膜色素变性、Leber先天性黑矇、年龄相关性黄斑变性等,均伴随光感受器功能障碍和丧失,最终导致视力障碍和盲[1]。在疾病早期阶段,视网膜内尚有相当数量的光感受器细胞存在,将其作为靶细胞进行基因治疗和基因编辑是非常有前景的治疗方法。在光感受器细胞已大量丧失的疾病晚期阶段,以恢复视网膜光敏性为目的的替代策略正处于探索阶段,包括光遗传工具、光敏开关、视网膜假体和光感受器移植[2-4],其中光感受器移植是一种很有前途的再生策略,影响其治疗效果的一个重要因素为供体细胞的来源[5]。视网膜变性疾病的细胞治疗中首选活性强、有丝分裂后的原代光感受器细胞,即光感受器前体细胞[6-9]。移植后光感受器前体细胞较成熟的光感受器细胞有更高的存活率,在视网膜下间隙可有效成熟,对晚期视网膜变性的功能修复有一定效果[10-12]。以往研究利用2D培养系统从胚胎干细胞(embryonic stem cells,ESCs)和诱导多能干细胞(induced pluripotent stem cells,iPSCs)中获得可移植的光感受器,但其效率低,仅有不足20%的细胞表达光感受器特异性标志物[13]。3D培养是指在体外培养时为细胞提供一个接近体内微环境的培养技术。近年来其在体外生物科学领域迅速发展,实现了体外类器官的培养。2011年,Eiraku等[14]在体外培养光感受器方面取得了重大突破,首次通过3D培养技术将小鼠ESCs诱导分化为视杯。目前已有许多从人ESCs和iPSCs产生神经视网膜类器官的3D培养方案[15-17]。随着培养技术的进步,理论上可以实现从ESCs及iPSCs产生无限数量的可移植光感受器,光感受器移植用于临床的基本前提已经确立[18]。然而筛选出合适的光感受器前体细胞尚需抗原-抗体反应步骤,影响了细胞活性,且带抗体的细胞可能对移植效果有影响。成簇规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)/CRISPR关联(CRISPR associated,Cas)基因是一种原核生物的免疫系统,其可准确识别外源DNA,利用Cas蛋白将DNA双链切断,因此成为第3代基因组定点编辑技术[19]。利用CRISPR/Cas技术对细胞系进行基因编辑可实现所需细胞系的构建[20]。Crx是一种同源结构域转录因子,为光感受器前体细胞的分子标志物,可用于筛选适合移植的光感受器前体细胞。TdTomato是一种信号非常强的红色荧光蛋白,对细胞和小鼠无明显毒性,是理想的细胞成像工具。本研究中拟通过CRISPR/Cas技术构建Crx-iCreERT2荧光报告人ESCs系,其3D培养得到的视网膜类器官中表达的tdTomato荧光可指示光感受器前体细胞,为光感受器移植疗法提供供体来源及细胞筛选、为人类视网膜发育和疾病发生的相关研究提供支持。
1 材料与方法
1.1 材料
1.1.1细胞来源 H9人ESCs系(美国WiCell公司)。
1.1.2主要试剂及仪器 mTeSR1培养基(85850,美国Stem Cell公司);0.5 mol/L EDTA(174621)、PBS(干粉)(G0002),(武汉赛维尔生物科技有限公司);基质胶(356237,美国BD Biosciences公司);培养皿(CLS430165,美国Corning公司);细菌培养皿(BS-90-D,中国Biosharp公司);3D细胞培养96孔板(MS-9096VZ,日本Sumitomo Bakelite公司);杜氏磷酸缓冲盐溶液(Dulbecco's phosphate buffered saline,DPBS)(c14190500bt)、DMEM/F12+GlutaMAX(10565-018)、N2添加剂(17502-048)、MEM非必需氨基酸溶液(MEM non-essential amino acids,MEM NEAA)(11140-050)、稳定型胰蛋白酶替代酶(12563-011)、丙酮酸钠(11360-070)、G-MEM培养基(1710-035)、青链霉素双抗(15140-122)、血清替代物(10828-028)(美国Gibco公司);SMO拮抗剂(HY-12848/CS-4176,美国MedChemExpress公司);Y-27632 HCl(S1049,美国Selleck公司);胎牛血清(fetal bovine serum,FBS)(04-001-1A-AUS,以色列Biological Industries公司);2-巯基乙醇(M-3148)、脱氧核糖核酸酶Ⅰ(DNase Ⅰ)(D5025)、视黄酸(R2625)(美国Sigma公司);兔抗人SOX2一抗(AF2018)(美国R&D Systems公司);兔抗人NANOG一抗(4903S)、小鼠抗人SSEA4一抗(4755S)(美国Cell Signaling Technology公司);兔抗人OCT4(abs106544)(上海爱必信生物科技有限公司);兔抗小鼠BRN3A一抗(ab245230)(英国Abcam公司);兔抗大鼠CALBINDIN一抗(cb38)(瑞士SWANT公司);Wnt信号抑制剂Ⅰ(681669)(Wnt Antagonist Ⅰ,IWR-1-endo)、山羊抗人CHAT一抗(AB144P)、兔抗人RECOVERIN一抗(ab5585)(美国Millipore公司);兔抗人PKCα一抗(sc-208)(美国Santa Cruz公司);驴抗兔IgG Alexa Flour-488(711-545-152)、驴抗山羊IgG Alexa Flour-488(705-545-147)、驴抗绵羊IgG Alexa Flour-488(713-545-147)、驴抗小鼠IgG Alexa Flour-594(715-585-151)(美国Jackson ImmunoResearch公司);DAPI(D1306,美国Life Technologies公司);抗荧光淬灭封片剂(G1401,武汉谷歌生物科技有限公司);多聚甲醛(80096618,上海国药集团化学试剂有限公司);牛血清白蛋白(4240GR100,德国Biofroxx公司);TRI试剂(93289,美国Sigma-Aldrich公司)。离心机(5424R,德国Eppendorf公司);倒置荧光显微镜(IX73,日本Olympus公司);激光扫描共聚焦显微镜(LSM880,德国Zeiss公司);培养箱(CLM-170B-8-NF)、生物安全柜(AC2-4S1)(新加坡Esco公司);水浴锅(DK-S22,上海精宏公司);冰冻切片机(CM1950,德国Leica公司);流式细胞分析仪(LSRFortessa X-20 Cell Analyzer,美国BD Biosciences公司)。
1.2 方法
1.2.1CRISPR/Cas9介导Crx-iCreERT2 H9红色荧光报告细胞系构建 对H9细胞系靶位点序列进行PCR扩增并测序验证,确认其是否与Genebank和Ensembl所给序列一致,扩增引物信息见表1。在hES-ZLM-001基因Exon4和3’非翻译区(untranslated region,UTR)之间终止密码子前插入P2A-tdTomato-P2A-iCreERT2,利用CRISPR/Cas9技术制备hES-ZLM-001敲进H9细胞系(图1)。基于sgRNA的设计原则,在靶位点区域设计多条sgRNA。基于CRISPR/Cas9技术进行sgRNA活性检测。综合考虑活性、特异性等因素选择符合要求的sgRNA进行下一步实验。经过酶切鉴定和测序,确认打靶载体构建完成。将打靶载体电转H9细胞系后,进行药物筛选、阳性克隆富集。在野生型基因序列中设计引物hES-ZLM-001-L-GT-F、hES-ZLM-001-L-GT-F3和hES-ZLM-001-R-GT-R,在外源序列中设计引物hES-ZLM-001-L-GT-R、hES-ZLM-001-R-GT-F和Puro-GT-F(表1)。使用hES-ZLM-001-L-GT-F3/hES-ZLM-001-L-GT-R、hES-ZLM-001-R-GT-F/hES-ZLM-001-R-GT-R和hES-ZLM-001-L-GT-F/Puro-GT-F这3对引物扩增突变型等位基因,使用hES-ZLM-001-L-GT-F3/hES-ZLM-001-R-GT-R引物同时扩增野生型和突变等位基因。对PCR扩增产物进行测序,根据测序结果和测序峰图判断具体基因型:纯合/杂合/野生型,最终得到去抗性敲进阳性细胞克隆。

图1 CRISPR/Cas9介导Crx-iCreERT2 H9红色荧光报告细胞系构建流程图 在hES-ZLM-001基因的Exon4和3’非翻译区之间终止密码子前插入P2A-tdTomato-P2A-iCreERT2
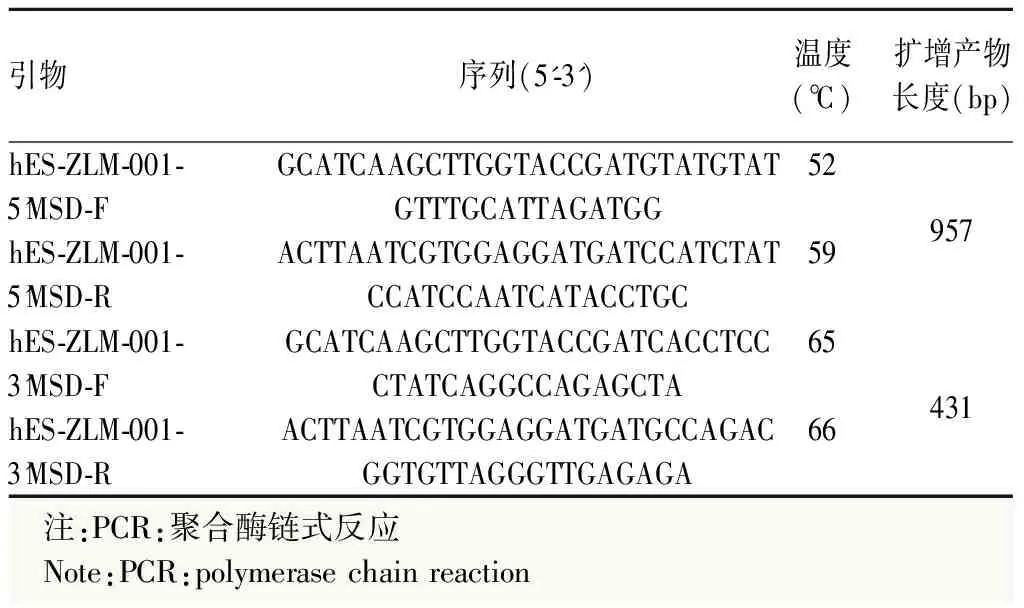
表1 hES-ZLM-001基因的PCR引物信息
1.2.2流式细胞分析法验证细胞系干性 分别向H9细胞系及1-A07细胞系的培养皿内加入EDTA消化液,孵育6~8 min,低速(1 200 r/min)离心5 min去上清,用DPBS培养基重悬细胞,细胞计数。将细胞悬液转移至离心管内,保证每个离心管内细胞数为1×107~5×107,低速离心5 min去上清,用质量分数4%多聚甲醛4 ℃固定1 h,低速离心5 min去上清,PBS清洗后低速离心5 min去上清;用体积分数4%牛血清白蛋白和2% TRI在4 ℃封闭过夜,低速离心5 min去上清;分别向含H9细胞悬液(阳性对照)及1-A07细胞悬液的离心管中加入OCT4(1∶ 500)一抗,另一管H9细胞悬液(阴性对照)不加一抗,4 ℃孵育24 h,低速离心5 min去上清,PBS清洗后低速离心5 min去上清;向各个离心管内加相应荧光标记二抗(1∶ 500),4 ℃避光孵育过夜,低速离心5 min去上清,PBS清洗后低速离心5 min去上清。用PBS重悬细胞,200目尼龙网过滤后将其转移至流式管中,应用流式细胞仪检测,观察OCT4阳性细胞比例。
1.2.3免疫荧光染色法验证细胞系干性 将24 mm×24 mm盖玻片置于浓硫酸中过夜,次日用自来水冲洗后放入无水乙醇中浸泡6 h,冲洗后高压消毒并烘干;将盖玻片放入质量浓度0.1 mg/ml多聚赖氨酸溶液中浸泡5 min,晾干备用。向ESCs的培养皿内加入EDTA消化液,孵育6~8 min,1 200 r/min离心5 min去上清,用mTeSR1培养基重悬细胞,密度约为3.5×105个/ml;将处理好的玻片放入6孔板内,将细胞悬液逐滴滴到玻片上,放入培养箱培养,待细胞达70%~80%融合时,吸去培养基,使用质量分数4%多聚甲醛固定20 min,PBS清洗;用0.5% TRI室温通透20 min,PBS漂洗;用10%牛血清白蛋白和0.5% TRI在4 ℃条件下封闭30 min,吸去封闭液;加入SOX2(1∶ 1 000)、NANOG(1∶ 200)、SSEA4(1∶ 500)一抗,4 ℃孵育过夜,PBS漂洗;加相应荧光标记二抗(1∶ 500),37 ℃避光孵育30 min,PBS清洗;加DAPI溶液(1∶ 100),避光染核5 min,PBS漂洗后使用抗荧光淬灭封片剂封片。在荧光显微镜下观察细胞中各分子标志物的表达情况。
1.2.4细胞系核型分析 取构建成功的细胞系,光学显微镜下观察细胞状态、密度,待细胞融合面积占整个培养皿70%~80%时,于含0.2 μg/ml秋水仙素的mTeSR1培养基中37 ℃培养2 h。向培养皿内加入EDTA消化液孵育6~8 min,1 200 r/min离心5 min去上清,用mTeSR1培养基重悬并轻轻吹散均匀。经低渗处理、预固定、固定后,吸取细胞悬液,滴至预冷的载玻片,室温下干燥。滴加Giemsa工作液,孵育20~30 min,自来水冲洗终止染色并烘干,使用封片剂封片。在光学显微镜下观察细胞核,使用Chromosome Analysis Suite(ChAS)Software进行细胞核型分析。
1.2.5细胞系3D培养诱导分化为视网膜类器官 将构建的细胞系培养于含mTeSR1培养基的基质胶包被培养皿中,待细胞融合度达70%~80%时传代或诱导分化。参照文献[21]的方法诱导分化人ESCs,将人ESCs酶解成单细胞,用含Y-27632的Medium Ⅰ培养基重悬细胞,置于3D细胞培养96孔板中,细胞接种密度为9×103个/孔,每孔100 μl,当天记录为分化第0天;分化第2天,向每孔加入质量分数1%基质胶;分化第6天,用不含Y-27632的Medium Ⅰ培养基更换孔内一半原培养基;分化第12天,将每孔内的拟胚体转移到细菌培养皿中,使用含1%基质胶的Medium Ⅱ培养基继续培养;分化第18天,将拟胚体切割成4~5小块后,转移到新的细菌培养皿中,使用含视黄酸的Medium Ⅲ培养基继续培养,之后每7 d换液1次。分化第100天时,开始使用不含视黄酸的Medium Ⅲ培养基。培养至分化第30天开始,每隔15 d取样进行1次检测,直至分化第180天,Medium Ⅰ、Ⅱ、Ⅲ培养基分别对应图中D0~D12、D12~D18、D18以后所用培养基(图2)。
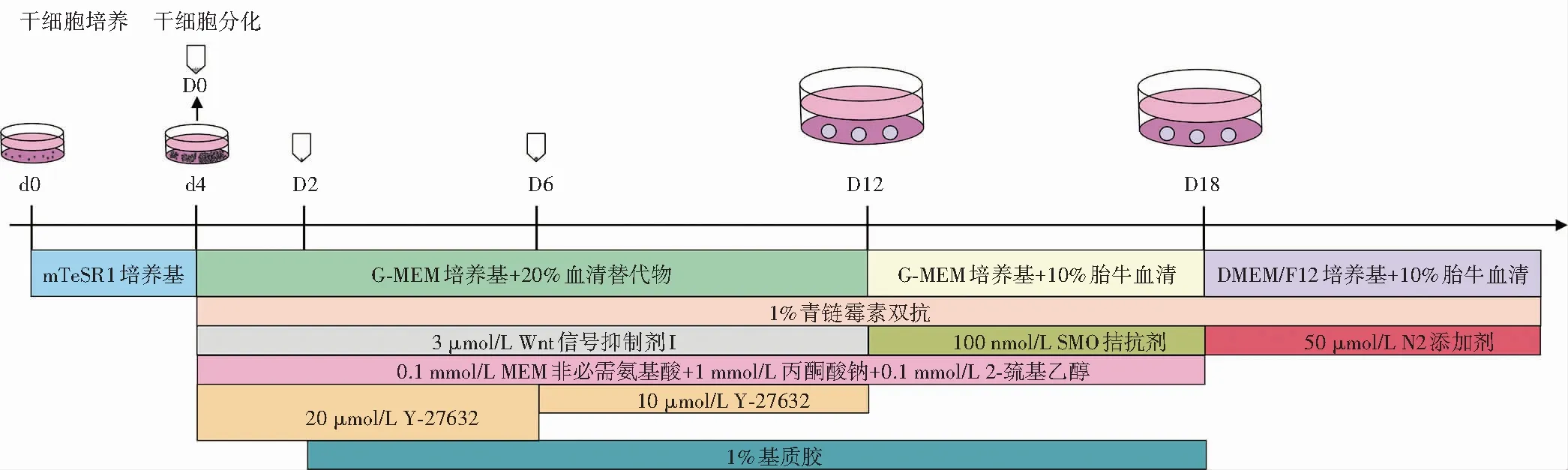
图2 干细胞培养及诱导分化流程 d:干细胞培养天数;D:干细胞分化天数
1.2.6免疫荧光染色法检测视网膜类器官中各类神经细胞蛋白的表达 培养至分化第30天开始,每隔15 d进行1次收样,直至分化第180天。取培养的视网膜类器官,用4%多聚甲醛在4 ℃固定1 h,进行OCT包埋,行14 μm厚冰冻切片;取切片用4%牛血清白蛋白和0.5% TRI试剂封闭1 h,滴加神经节细胞标志物BRN3A(1∶ 200)、水平细胞标志物CALBINDIN(1∶ 500)、无长突细胞标志物CHAT(1∶ 200)、光感受器细胞标志物RECOVERIN(1∶ 500)、双极细胞标志物PKCα(1∶ 500),4 ℃孵育过夜,PBS漂洗;滴加相应荧光标记二抗,室温避光孵育1 h,PBS漂洗;滴加DAPI溶液,室温下避光染核5 min,PBS漂洗后抗荧光淬灭封片剂封片。激光扫描共聚焦显微镜下观察样本各标志物的表达情况,以此来判断视网膜类器官中是否存在相应种类的细胞。
2 结果
2.1 Crx-iCreERT2 H9红色荧光报告细胞系打靶载体的构建
经测序验证,hES-ZLM-001基因扩增产物序列与Genebank DNA序列数据库和Ensembl基因组数据库中所提供序列一致。在靶位点区域共设计16条sgRNA,其中sgRNA1~8为5’端引物,sgRNA9~16为3’端引物。基于CRISPR/Cas9技术的活性检测结果显示,5’端引物sgRNA1、sgRNA2、sgRNA8活性较高,3’端引物sgRNA11、sgRNA12、sgRNA13活性较高(图3)。最终选择sgRNA8和sgRNA12作为sgRNA。打靶载体分别经限制内切酶EcoRI+ScaI、BamHI+HindIII和BgIII处理后,相应获得3、4和4个酶切产物,产物的长度和测序结果与目标产物一致,确认打靶载体构建完成(图4)。
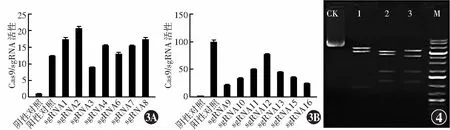
图3 sgRNA引物活性检测 A:5’端sgRNA引物活性检测 sgRNA1、sgRNA2和sgRNA8活性较高 B:3’端sgRNA引物活性检测 sgRNA11、sgRNA12和sgRNA13活性较高 图4 打靶载体酶切验证 琼脂糖凝胶电泳结果显示不同限制内切酶的酶切产物均与目标产物相一致 CK:阴性对照;1:限制性内切酶EcoRI+ScaI(目标产物为6 494 bp+5 308 bp+934 bp);2:限制性内切酶BamHI+HindIII(目标产物为5 227 bp+4 445 bp+1 867 bp+1 197 bp);3:限制性内切酶BgIII(目标产物为5 579 bp+4 124 bp+1 871 bp+1 162 bp);M:DNA标志物
2.2 Crx-iCreERT2 H9红色荧光报告细胞系基因型筛选及干性鉴定
对待筛选的细胞系克隆进行PCR测序,根据测序来判断细胞系具体基因型,综合考虑PCR结果及细胞株状态后,最终得到4个去抗性敲进阳性克隆(表2),分别为1-C06、1-B06、1-C07和1-A07(图5)。通过流式分析确认1-A07细胞系干性良好(图6)。免疫荧光染色检测结果显示1-A07细胞系中ESC分子标志物SOX2、NANOG和SSEA4均呈阳性表达(图7)。核型分析表明,1-A07细胞系核型无异常,为46,XX(图8)。结果显示,外源性tdTomato-P2A-iCreERT2段重组位置正确,且该干细胞系正常表达干细胞标志物,核型分析结果无异常,可用于后续实验。
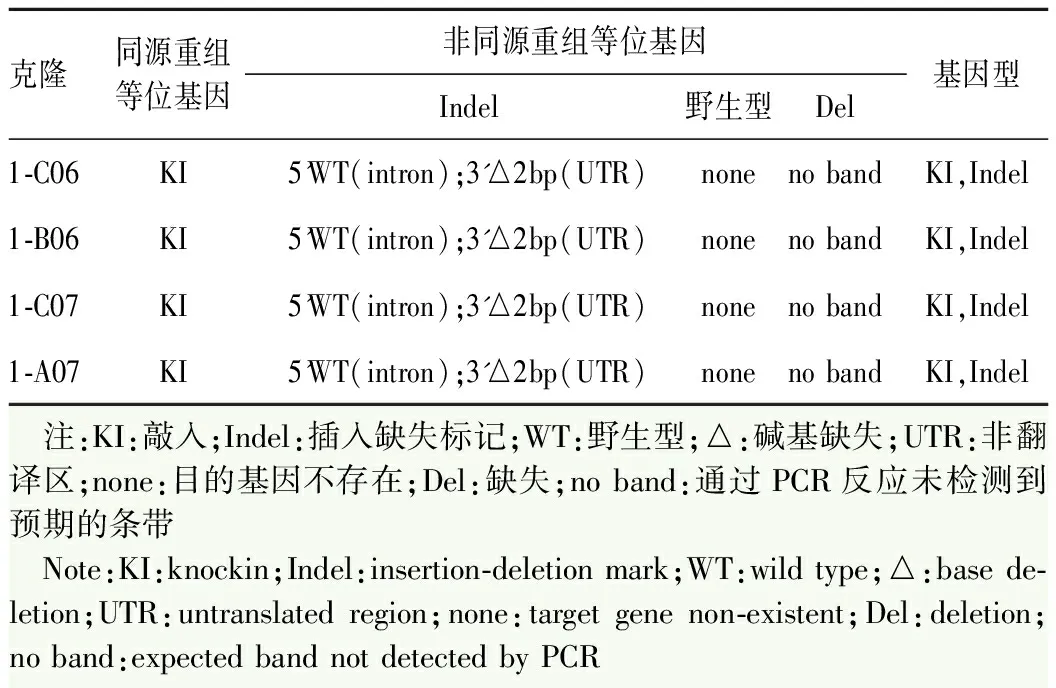
表2 4个去抗性敲进阳性克隆信息

图5 各细胞克隆不同引物扩增产物的琼脂糖凝胶电泳图 对12个待筛选的克隆进行PCR扩增,综合考虑PCR结果及细胞株状态后,最终得到4个去抗性敲进阳性克隆,分别标记为1-A07、1-B06、1-C06和1-C07 A:hES-ZLM-001-L-GT-F3/hES-ZLM-001-L-GT-R引物扩增产物电泳图 B:hES-ZLM-001-R-GT-F/hES-ZLM-001-R-GT-R引物扩增产物电泳图 C:hES-ZLM-001-L-GT-F3/hES-ZLM-001-R-GT-R引物扩增产物电泳图 D:hES-ZLM-001-L-GT-F/Puro-GT-F引物扩增产物电泳图 +:阳性对照;WT:H9野生型细胞系对照;H2O:空白对照 图6 各细胞系流式细胞分析 A:阴性对照(H9细胞系无抗体)的流式分析结果 OCT4阳性细胞占0.241% B:1-A07细胞系的流式分析结果 OCT4阳性细胞占98.7%,表明1-A07细胞系干性良好 C:阳性对照(H9细胞系抗体染色)的流式分析结果 OCT4阳性细胞占99.6%,表明H9细胞系干性良好

图7 细胞爬片免疫荧光染色(标尺=100 μm) A、C:细胞核呈蓝色荧光(DAPI,Alexa Fluor-405) B:SOX2染色阳性,呈绿色荧光(Alexa Fluor-488) D:NANOG染色阳性,呈绿色荧光(Alexa Fluor-488) E:SSEA4染色阳性,呈红色荧光(Alexa Fluor-594)

图8 1-A07细胞系核型分析 1-A07细胞系的核型分析结果为46 XX,染色体数量和形态无异常 图9 光学显微镜下观察Crx-iCreERT2 H9红色荧光报告细胞系的体外自发分化(×100,标尺=200 μm) A:ESCs细胞培养后4 d,细胞互相连接连成片,细胞之间呈致密连接,不同细胞团片之间尚留有部分空间 B:分化第2天,细胞聚集成一球状,球状细胞团位于孔中央底部,周围有部分散在细胞 C:分化第6天,细胞聚集成一致密球状,较之前体积增大,周围散在细胞基本消失,边缘处较其他部分略微透明 D:分化第12天,球状拟胚体体积较之前进一步增大,边缘处出现突起的半透明小囊泡结构 E:分化第18天,切割后的拟胚体 F:分化第21天,被切割后的小囊泡逐渐形成视杯,且视杯体积逐渐增大 G:分化第30天,视网膜类器官基本形成,较透亮,呈淡黄色,并逐渐增大 H、I:分化第45天和第60天,视网膜类器官逐渐增大 J:分化第75天,视网膜类器官中央厚,边缘稍薄 K、L:分化第150天和第165天,视网膜类器官形态、体积均无明显变化
2.3 Crx-iCreERT2 H9红色荧光报告细胞系体外自发分化为视网膜类器官
分化第2天,细胞聚集成一球状,周围有部分散在细胞;分化第6天,细胞聚集成一致密球状,较之前体积增大,周围散在细胞基本消失,细胞团边缘处较其他部分略透明;分化第12天,可观察到球状拟胚体体积较之前进一步增大,边缘处出现突起的半透明小囊泡结构;拟胚体被切割后小囊泡逐渐形成视杯,且视杯体积逐渐增大;分化第30天,视网膜类器官形成,较透亮,呈淡黄色,并逐渐增大;分化后第75天,视网膜类器官中央厚,边缘稍薄,并逐渐增大、增厚;分化第150天,视网膜类器官形态、体积无明显变化(图9)。
2.4 不同发育阶段视网膜类器官tdTomato荧光表达
TdTomato荧光表达标记的为表达Crx的光感受器前体细胞。分化第30天,在视网膜类器官内侧开始出现少量tdTomato荧光表达;分化第45天,荧光表达多集中在中深层;分化第60天和第75天,荧光表达主要集中在中深层,部分开始出现在顶层;分化第90天,荧光表达主要集中在顶层;分化第150天,荧光表达达峰值,随后荧光强度无明显变化(图10)。
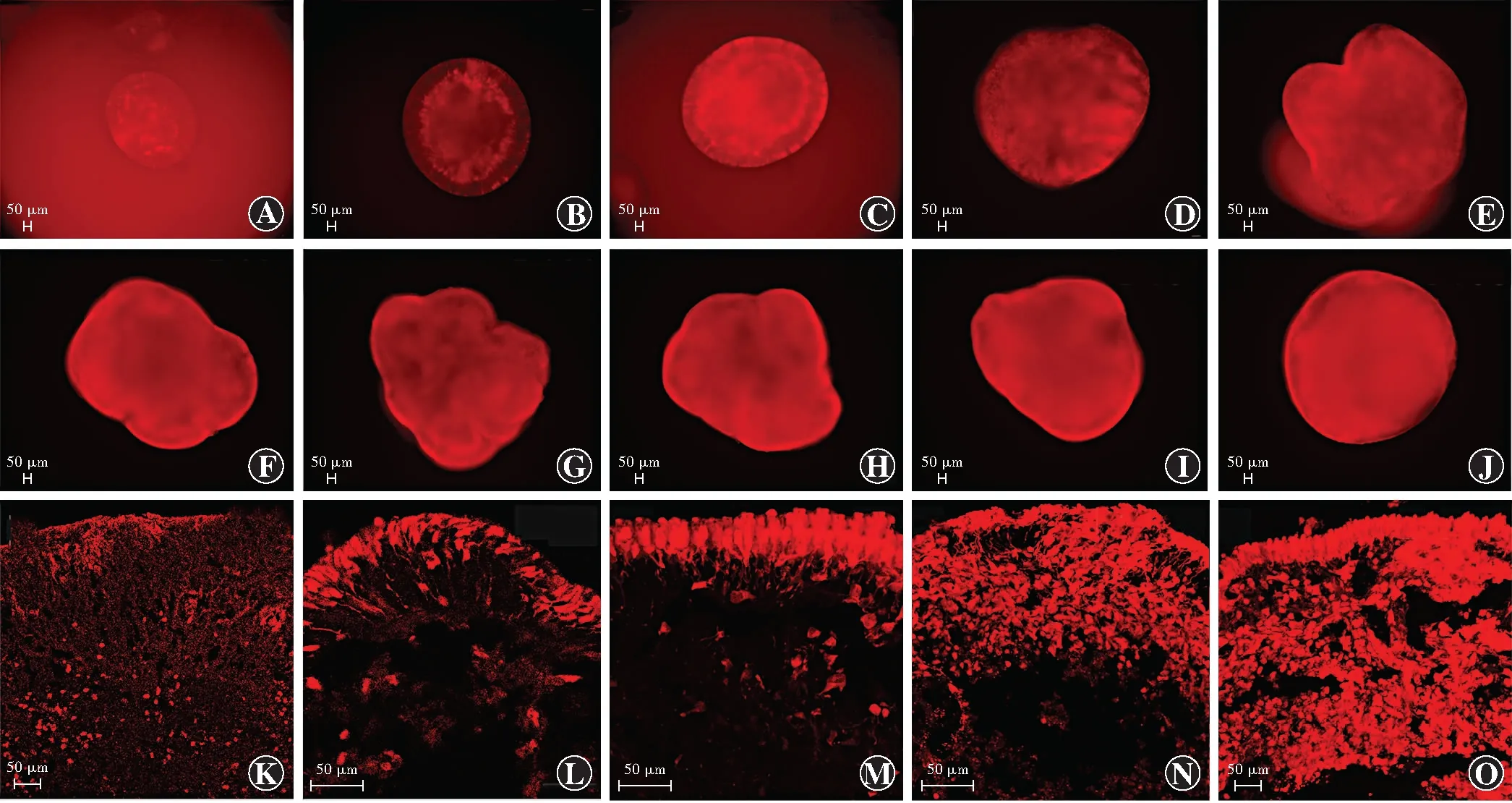
图10 不同发育阶段视网膜类器官tdTomato荧光表达情况(标尺=50 μm) A:分化第30天,在类器官深层开始出现少量tdTomato荧光表达 B:分化第45天,中深层有tdTomato荧光表达 C:分化第60天,在类器官顶层出现少量tdTomato荧光表达 D~I:分化第75、90、105、120、135和150天,类器官tdTomato荧光逐渐增强 J:分化第165天,类器官tdTomato荧光无明显变化 K:分化第60天,类器官冰冻切片tdTomato荧光表达主要分布于中深层,少量分布于顶层 L:分化第90天,类器官tdTomato荧光表达主要分布于顶层 M~N:分化第120和150天,类器官冰冻切片tdTomato荧光表达逐渐增强 O:分化第180天类器官冰冻切片tdTomato荧光表达与分化第150天时无明显变化
2.5 视网膜类器官中各标志蛋白表达情况
分化第30天,在类器官深层已出现较多BRN3A性神经节细胞,为视网膜类器官中最早出现的神经细胞类型,同时在视网膜类器官中深层开始零星出现CALBINDIN阳性水平细胞,以及CHAT阳性无长突细胞;分化第45天,在视网膜类器官最顶层开始零星出现RECOVERIN阳性光感受器细胞;分化第90天,在视网膜类器官中深层出现少量PKCα阳性双极细胞(图11)。
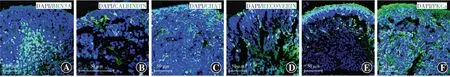
图11 免疫荧光染色观察视网膜类器官中各细胞标志物表达(FITC,标尺=50 μm) A:分化第30天,在视网膜类器官深层有大量BRN3A阳性神经节细胞 B:分化第30天,在视网膜类器官深层开始零星出现CALBINDIN阳性水平细胞 C:分化第30天,在视网膜类器官中深层开始零星出现CHAT阳性无长突细胞 D:分化第45天,在视网膜类器官最顶层及中深层零星出现RECOVERIN阳性光感受器细胞 E:分化第120天,RECOVERIN阳性光感受器细胞数量较分化第45天增多,仍为少量零星分布 F:分化第90天在视网膜类器官中深层零星出现PKCα阳性双极细胞
3 讨论
本研究通过CRISPR/Cas9技术介导顺利构建了Crx-iCreERT2 H9红色荧光报告细胞系,且该细胞系核型分析结果无异常,具有干性特征,可体外自发分化为视网膜类器官。通过免疫荧光染色检测视网膜类器官中神经细胞蛋白的表达后发现,该视网膜类器官细胞类型同人类正常视网膜一致,即含有神经节细胞、水平细胞、无长突细胞、光感受器细胞和双极细胞;并且各类细胞出现的时间顺序与人胚胎视网膜发育过程相符,即最先出现神经节细胞,随后水平细胞、无长突细胞、光感受器细胞相继出现,双极细胞最晚出现;视网膜类器官同人类正常视网膜中各类细胞的空间排布也基本一致,神经节细胞位于最深层,水平细胞、无长突细胞、双极细胞位于中深层,光感受器细胞位于顶层。通过本法获得的视网膜类器官遵循一定的发育时间和空间顺序,接近于正常的人类视网膜发育过程[22-23]。
视网膜类器官中的光感受器细胞大部分位于顶层,然而,与人类正常视网膜中光感受器细胞空间分布不一致的是,视网膜类器官的中深层有部分RECOVERIN阳性光感受器细胞散在分布。与之对应的,分化第60天时Crx阳性光感受器前体细胞大部分位于中深层,之后在中深层逐渐减少,在顶层分布逐渐增多;至分化第90天时,Crx阳性光感受器前体细胞大部分位于顶层,少部分位于中深层。视网膜类器官分化早期出现在中深层的光感受器前体细胞性质尚不清楚。目前没有报道描述人胎儿视网膜中光感受器前体的异位现象[24]。光感受器前体的这种异位现象也许同样存在于人胎儿视网膜中,由于变化细微而被忽略。出现在中深层的光感受器细胞是否具有与顶层的光感受器细胞一样的成熟度和亚型目前尚不清楚,有待后续进行研究。
大多数类型的视网膜变性主要损害光感受器细胞,利用视网膜类器官作为供体来源补足缺失的光感受器细胞具有一定的可行性。利用流式细胞分选技术从视网膜类器官中筛选出Crx阳性光感受器前体细胞,有针对性地进行移植;由于分化后30~90 d时tdTomato荧光表达逐渐增多,因此选择分化90 d以后的视网膜类器官作为供体较合适。已有研究将供体神经视网膜整体移植到视网膜变性的啮齿类动物模型中,供体视网膜内的光感受器细胞通过宿主的视觉通路连接到宿主神经节细胞,且宿主的视觉活动有一定地恢复[25]。
体外培养的视网膜类器官有一个共性的问题——不均一性,即由同一株细胞系诱导分化而来的类器官,同一批分化的类器官,乃至同一培养容器中的类器官,其大小、成熟程度可能存在差异。本研究中的视网膜类器官同样存在发育大小和成熟度的不均一,因此我们通过比较其体积大小和tdTomato荧光表达情况,选用其中发育最成熟的视网膜类器官用于后续研究。目前有研究者使用机器人和生物反应器来进行标准化工作并扩大生产规模,这些方法已经被用于脑类器官的生成和视网膜类器官的生成[26-27]。
本研究中建立的Crx-iCreERT2 H9红色荧光报告细胞系及其3D培养视网膜类器官技术是一种强大的工具,可以帮助实现人类视网膜发育和疾病产生的相关研究,并促进致盲疾病治疗方法的开发。
利益冲突所有作者均声明不存在任何利益冲突
