基于精准医学与MDT模式在进展期或复发结直肠癌中的临床应用价值
2021-06-10段训凰李道生曾祥胜石春燕邓建华
段训凰 李道生 曾祥胜 石春燕 邓建华
我国结直肠癌的发病率和死亡率均呈上升趋势,且呈年轻化趋势,初诊时较多患者已属中晚期,不可完全手术切除。早期发现、早期治疗、规范治疗和精准治疗仍然是提高结直肠癌患者生存率的重要途径。包括使用手术、放疗、化疗和靶向免疫治疗等手段在内的多学科综合治疗(multi-disciplinary team,MDT)的作用显得日益重要。随着精准医学治疗概念的提出,尤其是对转移性或者复发的晚期结直肠癌患者,根据特异性分子标志物或基因检测结果,可有针对性地进行分层治疗。
对非转移性结肠癌接受根治性术后,伴有高危因素的患者接受辅助化疗可减低复发转移风险。这些复发风险因素的评估目前仍基于影像学及病理学的基础上做出判断,在辅助治疗过程中亦不可避免地出现部分患者的治疗不足或过度治疗。然而,一些无明显高危因素的Ⅱ期结肠癌患者出现复发、转移,而有高危因素的患者却未出现复发的情况[1],而且没有具体的标准模式,则提示我们肿瘤存在异质性,也就是具有不同的生物学行为,而这种异质性就会使不同的个体对治疗,尤其是放疗、化疗或靶向治疗的敏感性不同。
我院自2015年开展MDT工作以来,取得了一定的成绩和经验。因此本研究联合MDT模式及精准医学检测模式用于40例进展期或复发的结直肠癌患者的治疗,现总结如下。
1 资料与方法
1.1 一般资料
选取2018年6月至2019年12月我院收治的进展期或复发的结直肠癌患者40例,入选标准包括病理确诊,影像评估为进展期或复发,根据RESIST疗效评估标准定义有可测量的靶病灶;肿瘤内科制定诊疗方案并且记录。
1.2 精准医学检测
1.2.1 MLH1、MSH2检测 MLH1、MSH2表达采用免疫组化技术,结果判断标准:MLH1、MSH2蛋白的表达阳性均定位于细胞核内,依据染色强度和阳性细胞率来进行计算评分。染色强度的评价标准为0分:无染色,1分:弱染色,2分:中等染色,3分:强染色。阳性细胞率:0为<1%;1为≥1%~25%;2为>25%~50%;3为>50<75%;4为>75%。最后以染色强度与阳性细胞率之和作为评分:0~2分为阴性,3~5分为阳性,6~7分为强阳性。
1.2.2 RAS基因状态、BRAF基因状态检测 采用免疫组织化学SP法进行检测,免疫组织化学SP试剂盒及DAB 显色试剂盒购自北京中杉生物技术有限公司。严格按SP 试剂盒说明书进行实验操作。K-Ras及BRAF蛋白阳性表达均为细胞质或细胞膜内出现棕黄色细颗粒,在细胞靶部位着色者计为阳性细胞。
1.2.3 MDT协作会诊 包括影像科、病理科、消化内科、肿瘤科、普通外科等。
1.3 统计分析
应用SPSS 22.0统计软件包进行统计分析。
2 结果
40例患者中,MLH1、MSH2表达阳性者39例,MLH1、MSH2阴性者1例;MLH1、MSH2表达阳性两者之间具有较好的一致性,表达阳性率较高,占97.5%。在治疗上给予化疗联合靶向治疗,靶向治疗药物选择西妥昔抗或贝伐珠单抗;MSH1、MSH2表达缺失者联合免疫治疗和化疗。
RAS基因野生型占29例,基因突变者11例;BRAF突变者3例,野生型占37例。RAS基因与BRAF基因状态不具有同步突变的概率。针对伴有基因突变的患者选择化疗联合贝伐珠单抗。
针对精准医学检测及MDT会诊的结果,更改治疗方案有5例,占比12.5%。肿瘤专科评估和多学科协作的评估显示,肿瘤的TNM分期及治疗策略均有所调整,都可能存在评估不足或者评估过度的问题,在原发灶的评估中,专科评估的T3/T4期分别为30例和10例,N分期的评估中,N2/N2以下的分期分别为27和13例,远处转移的分别为34例和6例,接受术前治疗的和直接行手术治疗的分别为34例和6例。在多学科MDT的评估后,T3/T4期分别为25例和15例,N2/N2以下的分期分别为32和8例,远处转移的分别为28例和12例,接受术前治疗的和直接行手术治疗的分别为36例和4例,差异均无统计学意义(P>0.05)。见表1。
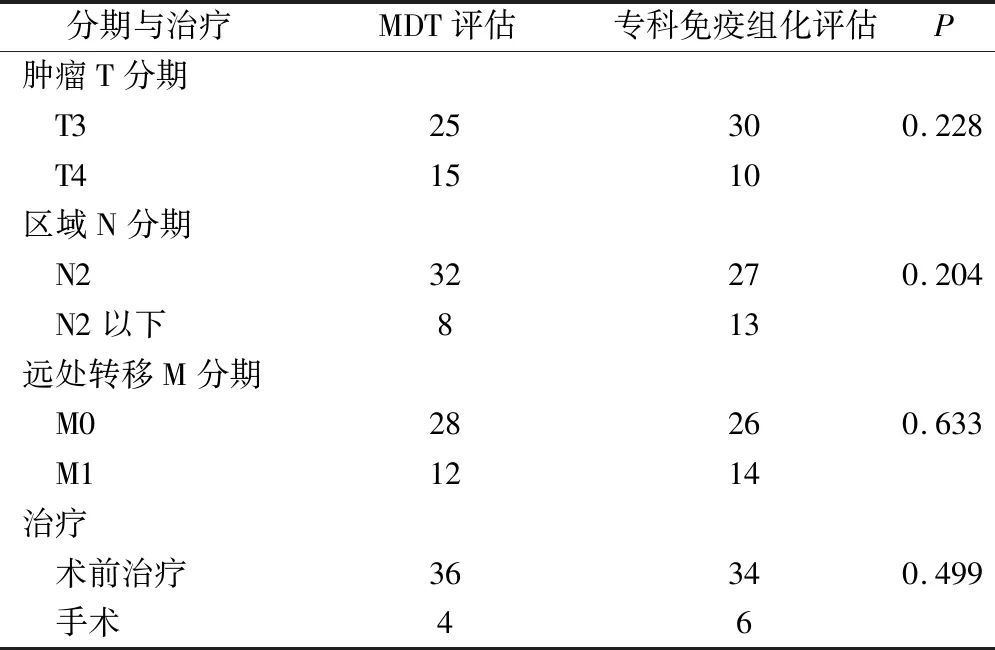
表1 MDT评估与专科免疫组化检测评估对TNM分期和治疗的影响/例
3 讨论
全球每年新发结直肠癌140万例,仅次于乳腺癌和肺癌,因结直肠癌死亡人数约69万例,位列恶性肿瘤相关死因的第4位;在好发于男性的肿瘤中,结直肠癌的发生率居第3 位;在好发于女性的恶性肿瘤中,结直肠癌的发生率排第2 位。早发现、早治疗、规范治疗仍是提高结直肠癌患者生存率的主要途径。然而,结直肠癌患者在被确诊时有50%~60%患者的肿瘤已发生转移,其中80 %~90 %患者的转移为不可切除的肝转移。所以,包括使用手术、放疗、化疗和生物治疗等手段在内的多学科综合治疗(multi-disciplinary team,MDT)的作用显得日益重要[2]。随着精准医学治疗概念的提出,尤其是对转移性或者复发的晚期结直肠癌患者,根据特异性的分子标志物或基因检测结果,有针对性地进行分子靶向治疗或联合化疗已成为研究热点之一[2]。
随着人们对肿瘤特征的认识越来越深入,以往单纯依靠外科手术治疗实体瘤的观点已遭淘汰,取而代之的是在循证医学的基础上,联合外科、 放疗、 化疗 、 影像学、 病理学等多科室专家共同商讨最佳治疗个体化治疗方案的协作模式。我们国家最新的结肠癌诊治规范中,就特别强调了MDT在结直肠癌规范中的作用,尤其是进展期或复发转移性结直肠癌。针对非转移性结肠癌的治疗模式,目前以完整结肠系膜切除术联合辅助放、 化疗是其Ⅲ期患者的标准治疗方案,辅助化疗则推荐选用 奥沙利铂、氟尿嘧啶等并于围术期 6个月内完成。对存在肿瘤的高危因素的患者中,如病理为低分化、脉管神经侵犯、送检淋巴结<12枚、术前伴有肠梗阻等高危因素的Ⅱ期结肠癌患者,亦推荐术后进行标准辅助化疗,从而降低复发风险。然而,一些无明显高危因素的Ⅱ期结肠癌患者出现复发、 转移,而有高危因素的患者却未出现复发的情况,而且没有具体的标准模式,则提示我们肿瘤存在异质性,也就是具有不同的生物学行为,这种异质性不仅存在同一个体患者,也存在于不同的患者中。这种差异的存在,就会使不同的个体间对治疗,尤其是放疗、化疗或靶向治疗的敏感性不同。
错配修复(MMR)具有修复DNA碱基错配,有利于DNA复制高保真性,有利于维持基因组的稳定性和降低自发性突变等,成员有hMLH-1、hMSH-2、hPMS-1和hPMS-2蛋白,其中hMLH-1和hMSH-2蛋白是MMR家族中的主要成员,在结直肠癌发生演变中起重要用。
近期出版的结肠癌诊治规范就特别强调了MDT在结直肠癌规范中的作用。目前我国在精准医学的快速发展时期,结直肠癌的精准治疗和全程管理得到广泛应用,尽管这种技术发展和配备不平衡,但带来的临床获益得到我国专家学者一致认同[3-4]。因此我们开展了基于精准医学与MDT模式结合在进展期或复发结直肠癌中的临床研究,通过精准医学检测包括MLH1、MSH2、RAS基因状态、BRAF基因状态等、MDT团队会诊协作[5],制定治疗决策,更改治疗方案有5例,占比12.5%,这与既往的研究结论具有一致性,也体现了基因检测及多学科的综合治疗在进展期肠癌或晚期肠癌中的应用价值;肿瘤的TNM分期及治疗策略均有所调整。专科评估都可能存在评估不足或者评估过度的问题,在原发灶的评估中,专科评估的T3/T4期分别为30例/10例,N分期的评估中,N2/N2以下的分期分别为27和13例,远处转移的分别为34例和6例,接受术前治疗的和直接行手术治疗的分别为34例和6例。经多学科MDT评估后,T3/T4期分别为25例和15例,N2/N2以下的分期分别为32和8例,远处转移的分别为28例和12例,接受术前治疗的和直接行手术治疗的分别为36例和4例,尽管差异未达统计学意义,但多学科会诊在局部肿瘤侵犯与区域淋巴结鉴别方面还是显示出更多的积极意义,部分研究未达统计学差异可能与本研究的样本量相对偏小有关,希望通过扩大样本量及多中心的评估来进一步证实多学科会诊的具体的价值。
从我们的研究结果可以看到,不同的患者中存在MLH1、MSH2、RAS基因状态、BRAF基因状态的表达差异,这种差异同样会给我们的临床治疗选择提供更多的证据。
