NSE、CYFRA21-1、miR141在肺癌诊断中的价值
2021-06-10马玲玲杨秋伟
马玲玲 杨秋伟 任 磊
神经元特异性烯醇化酶(NSE)是癌细胞骨架结构蛋白,在癌细胞凋亡或者癌细胞破碎的过程中,NSE可显著释放入血[1];细胞角蛋白19片段(CYFRA21-1)作为细胞器或者细胞内蛋白的分解产物,能够反应癌细胞的增殖浸润风险,加剧肿瘤细胞的生物学特征的改变[2];微小RNA141(miR-141)是微小RNA家族成员,近年来的研究表明,微小RNA家族能够在肿瘤细胞的增殖调控中发挥作用[3]。本次研究选取我院肿瘤科经病理学检查证实的肺癌患者92例,探讨了NSE、CYFRA21-1、miR141的表达情况,并初步分析NSE、CYFRA21-1、miR141的诊断学价值。
1 材料与方法
1.1 一般资料
选取我院2017年5月至2019年10月经病理学检查证实的肺癌患者92例作为肺癌组、健康体检对象90例作为对照组。入选标准:①肺癌的诊断标准参考中华医学会制定的标准[4];②所有肺癌患者均经过胸部CT、MRI,纤支镜病理学活检或术后病理学证实;③接受血清肿瘤标志物检查前,患者无放化疗病史;④对照组为我院体检中心体检结果正常的对象;⑤本研究符合《赫尔透辛基宣言》相关医学伦理规定,经我院医学伦理委员会批准。排除标准:①合并其他部位恶性肿瘤的患者;②未经病理学检查确诊;③资料缺失。肺癌组男性53例、女性39例,年龄42~75岁,平均(59.2±11.3)岁;TNM分期:Ⅰ期20例、Ⅱ期37例、Ⅲ期25例、Ⅳ期10例;淋巴结转移阳性46例;病理学分型:非小细胞肺癌75例、小细胞肺癌17例。对照组,男性46例、女性44例,年龄39~75岁,平均(57.7±14.2)岁。2组研究对象的年龄、性别比较,无统计学差异(P>0.05)。
1.2 检测方法
采用ELISA法进行NSE、CYFRA21-1的检测,采集受试者的肘部静脉血5 ml,1 000 r/min离心10 min,取上清液待测。抗原浓度的测定使用十字交叉法,采用碳酸盐缓冲液进行稀释抗原后,加入96孔的酶标板中,并盖好板盖,放置在4 ℃的冰箱中过夜,然后蒸馏水冲洗3次(5 min),轻轻叩击酶标板进行甩干。在每孔中加入200 μl的脱脂牛奶(5%),放置在4 ℃的冰箱再次过夜,再经蒸馏水冲洗3次(5 min),加入稀释好的抗体(购自abcum公司 浓度1∶800)后,再次使用蒸馏水冲洗3次(5 min),每孔中加入100 μl的底物,显色后在酶标仪上进行吸光度的检测;对检查者的肘部静脉血进行采集(3 ml),以3 000 r/min离心20 min,取其上层液体,并提取RNA(试剂盒由北京奥维亚生物公司生产),逆转录成cRNA后进行基因扩增,采用primer 5软件进行检测基因的合成和引物设计,采用GADPH作为内参,miR141引物5'CAAGGACCAACTACAACC 3':下游5'TGCCTCTTCTTTAATTG3',经历45个循环后进行曲线溶解,每个孔设置3个复孔,取平均值。
1.3 统计学处理
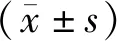
2 结果
2.1 2组的血清NSE、CYFRA21-1、miR141水平比较
肺癌组患者的NSE、CYFRA21-1、miR141水平均显著高于对照组(P<0.05);见表1。

表1 肺癌组和对照组的血清NSE、CYFRA21-1、miR141水平比较
2.2 血清NSE、CYFRA21-1、miR141水平变化与肺癌TNM分期、淋巴结转移、病理学类型的关系
肺癌组患者的NSE水平与TNM分期、淋巴结转移、肺癌的病理学类型有关(P<0.05)。CYFRA21-1水平与淋巴结转移有关(P<0.05);miR141水平与TNM分期、淋巴结转移有关(P<0.05);见表2。

表2 血清NSE、CYFRA21-1、miR141水平变化与肺癌TNM分期、淋巴结转移、病理学类型的关系
2.3 血清NSE、CYFRA21-1、miR141水平在诊断肺癌中的价值
绘制ROC曲线,血清NSE、CYFRA21-1、miR141水平在诊断肺癌中的AUC值分别为0.730、0.672、0.836;三项指标联合应用在诊断肺癌中的AUC值为0.918;见图1。

图1 血清NSE、CYFRA21-1、miR141水平在诊断肺癌的ROC曲线
3 讨论
在不同病理性内外环境的诱导下,肺泡上皮细胞或者鳞状上皮细胞的持续性病变,能够增加支气管来源或者肺泡上皮细胞来源恶性肿瘤的发生风险。同时在长期吸烟、气溶胶颗粒吸入或者其他有害物质污染的环境中,肺癌的整体发病水平可持续上升[4-5]。临床上15%以上的肺癌临床确诊时已处于疾病的中晚期,失去了早期根治性手术机会[6]。而通过对于肺癌患者的早期诊断方式的研究,能够为肺癌的手术治疗或者治疗后临床预后的随访提供参考。肺部CT能够在肺癌的诊断过程中发挥作用,但肺部CT检查耗时较长,同时缺乏定量化监测的价值。肺部结节穿刺活检,能够在肺癌的早期诊断过程发挥金标准作用,但胸部结节穿刺活检属于有创检查,其费用较高,患者的接受程度较低。现阶段多数研究者探讨了癌胚抗原、鳞状细胞癌抗原及糖链蛋白199等在肺癌诊断过程中的价值,认为相关肿瘤非特异度蛋白的表达上升,能够显著提高肺癌早期诊断的灵敏度,但其诊断的整体漏诊率或者误诊率水平仍然较高[7]。
NSE是神经特异性烯醇化酶相关因子,其主要存在于脑组织或者神经胶质成分中,在癌细胞膜破碎的过程中,NSE可显著释放入血。CYFRA21-1作为癌细胞骨架结构蛋白,在癌细胞增殖的过程中,细胞骨架结构的合成速度的增加,能够促进外周血中CYFRA21-1的上升;miR141是微小RNA家族成员,其能够参与到肿瘤信号通路PI3K的调控激活过程,诱导癌细胞内转录相关因子的上调,最终促进癌细胞增殖失控[8]。回顾相关研究,多数研究分析了NSE、CYFRA21-1在肺癌患者中的表达,认为在肺癌患者中,NSE、CYFRA21-1的表达浓度明显上升[9-11],但对于miR141的分析不足。
本次研究发现,在肺癌患者血清中,NSE、CYFRA21-1、miR141蛋白的表达阳性率水平均明显上升,高于健康体检对照组,统计学差异显著,表明NSE、CYFRA21-1、miR141在肺癌患者中存在明显的高表达态势,这主要与肺癌细胞的异常增殖、癌细胞骨架蛋白的过度合成及肿瘤细胞转录调控的异常等因素有关。另外,过度上升的miR141还能够反馈性诱导癌细胞膜上离子通道蛋白的异常开放,提高了癌细胞膜内第二信使浓度,最终促进了肺癌的发生。有其他研究者也认为,在肺癌患者血清中,miR141的表达浓度可随着肺癌患者的病情进展而显著上升,特别是在肺癌患者临床预后较差或者短期内病死风险较高的患者中,miR141的表达浓度可翻倍上升[12]。本次研究还发现,NSE、CYFRA21-1、miR141的表达与肺癌患者的临床病理特征密切相关,其中在不同TNM分期、是否淋巴结转移、非小细胞肺癌患者中,NSE浓度明显上升,高于临床病理特征较轻或者小细胞肺癌患者,统计学差异显著。NSE的上升对于临床病理特征的影响,在于其能够提高肺癌细胞粘附淋巴结组织的能力,促进了癌细胞浸润深度和浸润范围的增加;CYFRA21-1在发生淋巴结转移的患者中浓度较高,表明CYFRA21-1能够影响到肿瘤细胞的淋巴结转移过程,这主要考虑由于CYFRA21-1能够提高肿瘤细胞膜上内皮粘附分子adherin 的表达浓度,促进了肿瘤细胞的淋巴结转移[13];miR141在TNM分期较晚或者发生淋巴结转移的患者中浓度较高,表明miR141同样能够显著促进肺癌患者临床病理特征的进展。诊断学分析可见,NSE、CYFRA21-1、miR141在联合诊断肺癌的过程中具有重要的应用价值,其联合诊断的AUC曲线下面积可超过0.9,提示其检测价值较为可靠。
综上所述,在肺癌患者中,NSE、CYFRA21-1、miR141的表达浓度明显上升,临床上通过联合检测NSE、CYFRA21-1、miR141,能够提高肺癌的诊断效能。
