腹腔镜胃癌根治术患者组织中PPARγ辅激活因子1α及长链非编码转录因子7表达及其临床意义
2021-06-10赵小勇吴瑞卿
赵小勇 吴瑞卿 王 尚
胃癌是消化道常见的恶性肿瘤的1种,发病率和死亡率较高[1-2],近年来通过腹腔镜治疗胃癌已有广泛的应用[3-4]。PGC1α是PGC-1(PPARγ coactivator-1) 家族的一个成员,是线粒体增殖的重要调节因子,促进线粒体的氧化表达,提高线粒体氧化功能,介导多种组织的能量代谢途径中的转录调控。lncRNA主要位于细胞核内,作为修饰染色质复合物的支架,调节基因的表达。已有研究表明lncRNA与癌症的发生、发展、转移、复发密切关系[5-6]。PGC1α、lncTCF7已被证实在多种恶性肿瘤的发生、发展中有重要作用。本研究旨在分析腹腔镜胃癌根治术后患者体内PGC1α和lncTCF7表达情况,探讨腹腔镜胃癌根治术的疗效,PGC1α和lncTCF7对胃癌发生发展的重要意义,对腹腔镜胃癌根治术患者预后的监测效果。
1 材料与方法
1.1 一般资料
对我院2016年8月至2017年8月住院行腹腔镜胃癌根治术患者50例作为研究对象,其中男性20例,女性30例,年龄36~74岁,平均年龄(51.5±2.9) 岁;纳入标准为均接受术前胃镜检查,病理活组织检查结果证实为原发性胃癌。排除标准:①术前曾接受放射和(或)化学治疗等转化治疗;②因出血、梗阻、穿孔等进行急诊手术;③由于术后并发症、意外等导致非肿瘤性因素的死亡;④术后病理检查结果均符合胃癌病理学诊断标准,并排除其他胃恶性肿瘤如淋巴瘤等;⑤单纯接受消化道重建等非根治性切除术。本次研究的患者与家属均知晓本次研究并签署知情同意书,研究经伦理委员会批准后展开。
1.2 细胞株和质粒载体
lncTCF7高表达的胃癌细胞株AGS购自中国科学院上海细胞生物学研究所。人胚肾细胞HEK-293T为病毒包装细胞,来自美国菌种保藏中心,并由上海市肿瘤研究所癌基因及相关基因国家重点实验室保存。RNA干扰慢病毒载体系统购自上海吉玛制药技术有限公司,该系统包括LV2穿梭载体、包装质粒混合物pPACK-GAG、pPACK-REV和pPACK-VSV-G包装载体。
1.3 检测方法
免疫组化检测:PGC1α检测试剂盒购自上海语纯生物有限公司,于根治术中收集患者胃癌病理组织,对组织进行染色后制作病理切片,计算其免疫组化评分。
qRT-PCR检测:收集患者新鲜胃癌组织标本,在液氮下研磨并置于1.5 ml的EP管中,1 000 r/min离心5 min,将上清液弃去,QIAGEN RNA提取试剂盒(优宁维,中国)提取细胞的总RNA。利用分光光度计测量RNA吸光度值,计算RNA浓度。罗氏(ROCHE,瑞士)对lncTCF7基因进行qRT-PCR检测。
1.4 随访
通过定期复查、门诊随访等方式直接联系患者本人或家属获得随访资料,以2020年8月1日作为随访终点,以无病生存期(全因死亡、肿瘤转移或复发)和总生存期(全因死亡)评价患者临床预后。
1.5 统计学分析
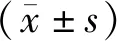
2 结果
2.1 PGC1α、lncTCF7 的表达与胃癌患者临床病理特征的关系
胃癌患者PGC1α、lncTCF7相对表达量与肿瘤分化程度、浸润深度及淋巴结转移有关(P<0.05),与性别、年龄、肿瘤直径无关(P>0.05),见表1。

表1 PGC1α、lncTCF7 的相对表达量与胃癌患者临床病理特征的关系
2.2 PGC1α的表达与患者临床预后的关系
截至随访终点,50例纳入胃癌患者共12例死亡,6例转移或复发;以PGC1α免疫组化评分中位数进行分组,PGC1α高表达组无进展生存期和总生存期均低于PGC1α低表达组,差异具有统计学意义(P<0.05),见表2。
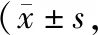
表2 PGC1α的表达与患者临床预后的关系月)
2.3 lncTCF7 mRNA水平与患者临床预后的关系
以lncTCF7 mRNA相对表达中位数进行分组,lncTCF7 mRNA高表达组无进展生存期和总生存期均低于 lncTCF7 mRNA低表达组,差异具有统计学意义(P<0.05),见表3。
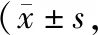
表3 LncTCF7 mRNA水平患者临床预后的关系月)
2.4 胃癌患者不良预后的多因素分析
将PGC1α的表达与 lncTCF7 mRNA水平作为检验变量,患者随访终点时临床结局作为结局变量,校正其它常量因素后,回归分析结果显示PGC1α的高表达与lncTCF7 mRNA高水平是根治性胃癌术后患者不良预后的独立危险因素(P>0.05),见表4。

表4 胃癌患者不良预后的多因素分析
3 讨论
研究发现肿瘤细胞的线粒体功能完备且与肿瘤发生发展过程密切相关[7-8]。本研究结果显示了在29.3%的胃癌患者组织中检测到了PGC1α的明显高表达。PGC1α在不同肿瘤中的表达受不同癌基因或信号通路的调控,以适应在特定的肿瘤微环境下肿瘤细胞的代谢所需。胃癌患者PGC1α、lncTCF7水平与肿瘤分化程度、浸润深度及淋巴结转移有关(P<0.05),与性别、年龄、肿瘤直径无关。在肿瘤转移方面,研究发现小鼠乳腺癌转移模型中循环肿瘤细胞倾向于通过PGC1α维持线粒体代谢以保持侵袭性[9-10]。
本研究发现腹腔镜根治术后胃癌患者的PGC1α免疫组化评分、lncTCF7 mRNA相对表达与胃癌预后显著相关。既往研究发现,干扰lncTCF7的表达可以抑制胃癌细胞侵袭转移的能力,提示lncTCF7可能是胃癌侵袭、转移的关键分子[11-12]。因此lncTCF7有望作为胃癌的发生、发展和预后的判断生物标志物。
综上所述,腹腔镜根治术后PGC1α预测胃癌患者的预后具有重要的临床意义,受限于病例数较少等限制,统计学结论可能存在一定的偏倚,研究结论有待更多的研究证实。
