鞘氨醇单胞菌对微囊藻毒素-RR的降解作用与影响因素分析
2021-06-10刘剀剡袁梦玹浦跃朴
刘剀剡 丁 勤 袁梦玹 浦跃朴
(东南大学环境医学工程教育部重点实验室, 南京 210009)
微囊藻毒素(Microcystins,MCs)是淡水中常见的具有肝肾毒性的藻类毒素[1-2],亚洲湖泊和河流中最主要的MCs变体为微囊藻毒素-RR(Microcystin-RR,MC-RR)和微囊藻毒素-LR(Microcystin-LR,MC-LR)[3].人类活动和全球变暖使得自然水体温度逐年升高,水体富营养化愈发普遍,MCs污染情况日趋严重[4-6].
微生物降解是清除水体MCs的主要途径[7-8],鞘氨醇单胞菌(Sphingopyxissp.)是发现最早、研究较多的MCs降解菌[9].鞘氨醇单胞菌通过4种MCs降解基因(mlrA、mlrB、mlrC和mlrD)编码的4种蛋白酶(MlrA、MlrB和MlrC和MlrD)发挥作用,其中MlrA作为细菌降解MCs的起始酶而受到重点关注[10-14].已有研究[14-16]表明,细菌降解MCs与水体温度、营养基质浓度、pH值及有机污染物种类等因素有关,但影响因素的作用途径及机制尚未见报道.
本文以携带4种MCs降解基因的鞘氨醇单胞菌m6为研究对象,旨在通过对不同条件下MC-RR浓度、降解产物、基因mlrA及酶MlrA活性的检测与分析,探究鞘氨醇单胞菌对MC-RR的降解能力、影响因素和作用机制,为生物降解MCs技术的现实应用提供理论依据和技术支持.
1 材料与方法
1.1 主要试剂和仪器
本文所用主要试剂和仪器如下:MC-RR纯品(质量分数大于等于95%,中国台湾藻研);LB肉汤(中国青岛海博);高效液相色谱仪(HPLC,1260,美国安捷伦),超高效液相串联多级质谱仪(UPLC-MS/MS,triple TOF 5600+,美国爱博才思),实时荧光定量PCR仪(7500,美国赛默飞世尔);无机盐液体培养基(MSM培养基),包含1.0 g/L MgSO4·7H2O,0.5 g/L KH2PO4,4.0 g/L K2HPO4,1.0 g/L NaCl,0.02 g/L CaCl2,0.005 g/L FeSO4,0.005 g/L MnCl2·4H2O,0.005 g/L ZnCl2,0.000 5 g/L CuCl2,pH=7.0.
1.2 鞘氨醇单胞菌降解MC-RR
取m6菌株单克隆于LB肉汤中培养36 h,4 ℃ 5 000 r/min 离心10 min收集菌体,去离子水洗涤2次后重悬于1.0 mg/L MC-RR的MSM培养基中,置于30 ℃ 150 r/min摇床进行降解反应,每组3个平行,以不含菌的反应体系为空白对照组,定时取样分析,并在波长600 nm处测定吸光度(OD600).
1.3 影响因素实验
在不同反应温度(20、30和40 ℃)、营养基质(加磷组K2HPO4质量浓度100 mg/L,加氮组NaNO3质量浓度100 mg/L,加碳组葡萄糖质量浓度100 mg/L)、MC-LR添加量(质量浓度0、0.5和1.0 mg/L)条件下分别进行鞘氨醇单胞菌降解MC-RR实验,每组3个平行,以不含菌的反应体系为空白对照组、不同营养基质实验中以MSM培养基组为阴性对照组,定时取样分析.
1.4 MC-RR降解产物分析
参考Ding等[14]的检测方法测定MC-RR降解产物,鉴定产物种类.
1.5 mlrA基因表达检测
使用Primer Premier 5.0软件设计引物序列,委托上海捷瑞公司合成.16S rDNA作为内参基因,引物序列参见表1.根据SYBR®Premix Ex Taq Ⅱ试剂盒说明书进行实时荧光定量聚合酶链反应并检测,结合2-ΔΔCt法分析mlrA基因相对表达量[14].

表1 相关引物序列
1.6 MlrA重组酶降解MC-RR
取重组大肠杆菌pGEx-4T-1-mlrA/BL21单克隆至LB肉汤中(含卡那霉素质量浓度50 mg/L)培养,经异丙基硫代半乳糖苷诱导表达,收集菌体并于冰上破碎处理后得酶MlrA,用于MC-RR降解实验.每组3个平行,以不加酶液的反应体系为空白对照组,含有空载质粒的大肠杆菌代替实验菌为阴性对照组,定时取样分析.
1.7 数据分析
使用Excel 2016、GraphPad Prism 8、SPSS 22.0软件进行数据分析,利用方差分析检验数据显著性差异,用Tukey法检验计算P值,当P<0.05时认为差异显著,P<0.001时认为差异极为显著.
2 结果与讨论
2.1 鞘氨醇单胞菌对MC-RR的降解作用与途径
菌株生长情况及MC-RR降解曲线如图1所示.吸光度OD600缓慢上升,说明细菌生物量逐渐增长.m6菌降解MC-RR能力较强,最高降解速率达0.29 mg/(L·h),1 h内MC-RR降解了10.81%,6 h内1.0 mg/L MC-RR完全降解.

图1 鞘氨醇单胞菌降解MC-RR
对样品做进一步的质谱分析,共检测到4种降解产物的5个分子离子峰,并将相关信息汇总于表2,降解产物有:线性MC-RR C49H77N13O13,四肽化合物C32H47N4O8(3-氨基-9-甲氧基-2,6,8-3甲基-10-苯基-4,6-二烯酸-异谷氨酰-脱氢丙氨酰-丙氨酸,Adda-Glu-Mdha-Ala),三肽化合物C12H19N3O6(异谷氨酰-脱氢丙氨酰-丙氨酸,Glu-Mdha-Ala)和单氨酸基团C20H29NO3(3-氨基-9-甲氧基-2,6,8-3甲基-10-苯基-4,6-二烯酸,Adda).据此推测鞘氨醇单胞菌对MC-RR的降解途径如图2所示:首先环状MC-RR C49H75N13O12中Adda 基团与精氨酸间的肽键断裂,生成线性MC-RR;进而丙氨酸与精氨酸之间的肽键断裂,生成C32H47N4O8;最后降解生成C20H29NO3和C12H19N3O6.该途径与Bourne等[11]的研究结果相似.

表2 MC-RR的降解产物

图2 推测的MC-RR降解途径
2.2 鞘氨醇单胞菌降解MC-RR的影响因素
如图3(a)所示,在20 ~ 40 ℃范围内降解最适温度为30 ℃,MC-RR降解速率最高(0.29 mg/(L·h)),40 ℃时降解速率降至0.21 mg/(L·h),20 ℃时降至0.20 mg/(L·h),说明MC-RR的降解受到温度的显著影响(P<0.05).

(a) 温度

(b) 营养基质

(c) MC-LR
图3(b)显示加磷组MC-RR最高降解速率为0.37 mg/(L·h),比阴性对照组提高了27.59%,说明提高磷浓度可明显促进鞘氨醇单胞菌对MC-RR的降解(P<0.05).加入其他碳源后MC-RR降解速率锐减至0.052 mg/(L·h),下降了86.71%,说明降解受到抑制(P<0.05).而刘凯英等[17]认为加入其他碳源后可增强微生物对MC-RR的利用效率,该研究使用的DHU-38菌为荧光假单胞菌,菌株种属与本文不同,可能是造成研究结果差异的原因之一.
图3(c)为添加不同质量浓度MC-LR后MC-RR的降解曲线.添加质量浓度0.5 mg/L MC-LR使MC-RR降解速率降低了3.42%,添加质量浓度1.0 mg/L MC-LR后则降低了4.44%.Yang等[18]也研究发现多种MCs共存时,其中一种MC的降解速率受到抑制.根据Wan等[19]的报道,太湖梅梁湾监测点MCs总质量浓度范围为8.60~21 237.60 ng/L,其中MC-LR的质量浓度范围为2~15 839.2 ng/L,MC-RR的质量浓度范围为2~3 013.65 ng/L,两者检出率均为100%.因此,研究多种MCs共同降解更具有实际应用价值.
2.3 不同影响因素下MC-RR的降解产物
经质谱分析,发现4种降解产物在各实验组中均有检出(见表3),表明不同影响因素作用下降解产物种类无差异,即MC-RR降解途径未改变.该降解途径中MlrA作为MC-RR降解的起始酶,对后续降解起着决定性作用[20-21],因此应关注不同影响因素对MlrA及其编码基因mlrA的作用及机制.
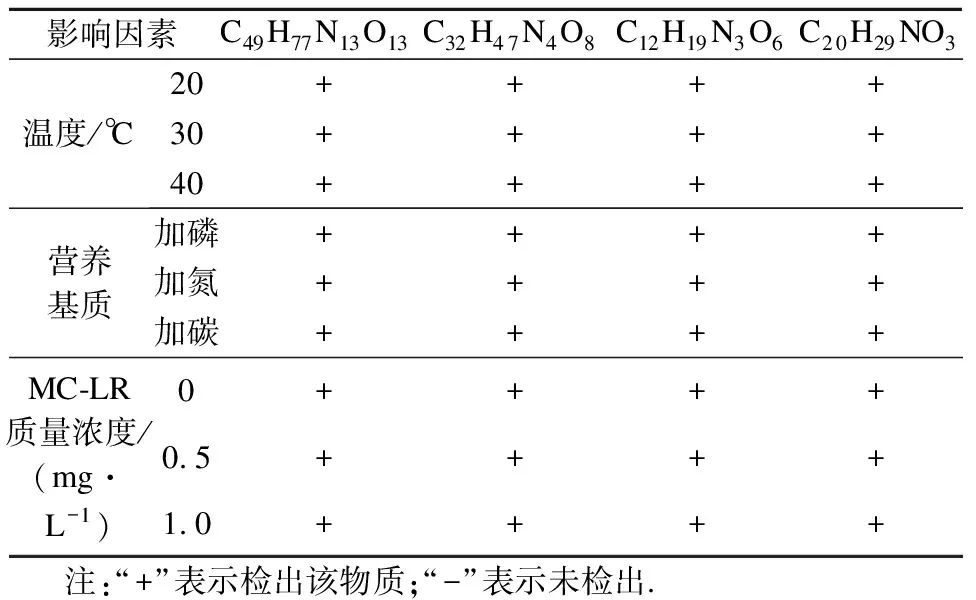
表3 不同影响因素下MC-RR的降解产物
2.4 不同影响因素下mlrA基因表达
如图4(a)所示,各温度组mlrA基因表达量均上调,差异不显著(P>0.05).这说明在20~40 ℃范围内,基因mlrA表达活性较高,能适应太湖蓝藻萌发期和水华暴发期的环境温度[22-23].
图4(b)中加磷组mlrA表达量最高,较阴性对照组提高了49.74%;加碳组mlrA表达量最低,为阴性对照组的13.29%.不同营养基质中的mlrA表达量存在极显著差异(P<0.001),说明营养基质影响mlrA表达量,进而造成MC-RR降解速率变化.也有研究[24]认为,提高磷浓度会增强对磷需求量大的降解菌的微生物活性,促进MCs降解速率.
由图4(c)可知,mlrA表达量随MCs总浓度变大而上升.添加质量浓度为1.0 mg/L的 MC-LR使mlrA表达量提高23.00%,说明mlrA的表达量依赖于底物浓度.当前研究普遍认为MCs作为胞外信号分子可诱导mlrA表达[25-26],且MCs浓度越高则mlrA的转录越快速,表达量上调倍数越高[27].

(a) 温度

(b) 营养基质
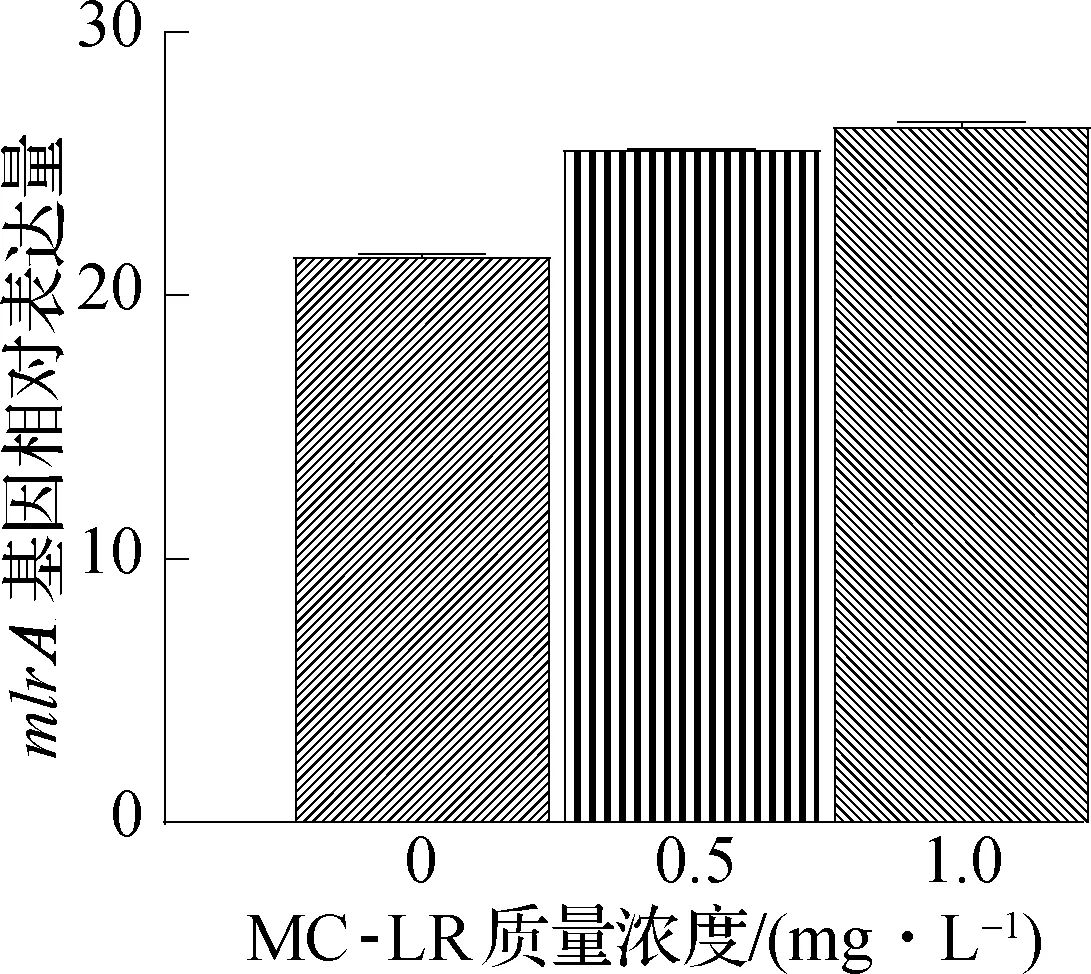
(c) MC-LR
2.5 MlrA降解MC-RR
MlrA催化降解MC-RR的结果如图5(a)所示.MlrA能在20 ~ 40 ℃温度下催化MC-RR降解,此范围内最适温度为30 ℃.各组间速率差异显著(P<0.05),说明反应温度通过改变MlrA的催化活性对MC-RR降解产生影响.
如图5(b)所示,添加质量浓度为0.5 mg/L的MC-LR后,MC-RR最高降解速率下降至0.41 mg/(L·h),降低了24.52%;添加质量浓度为1.0 mg/L的MC-LR则使MC-RR最高降解速率降低了61.11%,表明MC-LR和MC-RR同时被MlrA催化时出现了速率抑制.有研究[1,28]认为MCs降解菌(B-9)可识别肽序MeAsp-Arg-Adda并选择性水解肽键Arg-Adda,从而降解含有肽键Arg-Adda的MCs类似物.MC-LR和MC-RR均具有肽序MeAsp-Arg-Adda及肽键Arg-Adda,二者降解途径类似[29],MlrA同时催化时形成了酶竞争从而导致降解速率降低.

(a) 温度

(b) MC-LR
MCs的分子特性赋予其结构多变性,但目前研究主要集中在MC-LR、MC-RR及微囊藻毒素-YR(Microcystin-YR,MC-YR)三种毒素上.对不同底物催化作用认识的局限性导致MlrA的底物选择机制及其与各种MCs之间的结合机制尚不明确,因此后续研究将进一步阐明降解酶与MCs之间的构效关系.
3 结论
1) 鞘氨醇单胞菌具有高效的MC-RR降解作用,最高降解速率为0.29 mg/(L·h), 同时受到反应温度、营养基质和同类毒素浓度的影响.
2) 鞘氨醇单胞菌对MC-RR和 MC-LR的降解途径相似:首先环状MC-RR中Adda 基团与精氨酸间的肽键断裂,生成线性MC-RR;进而丙氨酸与精氨酸之间的肽键断裂,生成C32H47N4O8;最后降解生成C20H29NO3和C12H19N3O6.降解途径不受反应温度、营养基质和同类毒素浓度的影响.
3) 营养基质可调控mlrA基因表达量进而影响MC-RR降解速率:提高反应体系磷浓度对mlrA表现为促进作用,降解速率提高27.59%;提高碳浓度对mlrA表现为抑制作用,降解速率下降86.71%.反应温度可改变MlrA活性,同类毒素之间对MlrA存在竞争,影响MC-RR降解速率.
