不同部位冷却牛肉成熟过程中水分变化研究
2021-06-09左惠心朱立贤牛乐宝张一敏
左惠心 温 彬 朱立贤 罗 欣 牛乐宝 张一敏
(山东农业大学食品科学与工程学院,泰安 271018)
0 引言
肉品保水性(Water-holding capacity,WHC)是指肌肉受到外力作用时保持其原有水分与添加水分的能力。牛肉的保水性作为一种重要的加工品质,对牛肉产品的质量产生重要影响[1]。不同部位牛肉的品质具有显著差异,保水性不仅对牛肉的风味、嫩度、多汁性等产生重要的影响,而且具有经济意义[2-3]。明确不同部位冷却牛肉在成熟过程中保水性的差异和变化规律,有助于采取相应的措施控制牛肉汁液损失。
不同部位的牛肉在价格和食用品质方面存在巨大差异[4],不同部位牛肉的保水性也存在差异[5]。为了控制肉品汁液损失,减小因汁液损失而导致的企业经济损失,研究不同部位肌肉的保水性至关重要。目前,关于不同类型肌肉的食用品质研究多集中在嫩度方面[6],涉及不同部位保水性的差异及其原因的研究较少。文献[7]研究表明,不同部位肌肉的食用品质(肉色、嫩度、保水性和风味等)具有一定的差异性,且宰后不同部位肌肉的成熟速率也不同。在肉品贮藏、加工和运输过程中,任何导致肌细胞结构完整性破坏的因素都会引起肉品的保水性下降[8-9]。文献[10]研究发现,24、48、120 h的肌肉中,肌原纤维外空间存在差异,导致了肌肉中水分分布存在差异。但关于不同部位肌肉在成熟过程中的变化和产生差异的原因尚未进行分析。
因此,本文以冷却牛背最长肌、半膜肌和腰大肌作为研究对象,从贮藏损失、横向弛豫特性和肌肉结构等方面阐述3种部位冷却牛肉在成熟过程中保水性的变化,分析产生差异的原因,以期为提高牛肉的保水性提供理论依据。
1 材料与方法
1.1 材料与试剂
本实验所用牛肉样品采自山东省阳信县某公司,挑选8头质量相近、18~24月龄的杂交公牛(鲁西黄牛×西门塔尔牛),屠宰后胴体在排酸库冷却成熟24 h,取左半胴体的背最长肌(第12根胸肋到腰椎末尾)、半膜肌、腰大肌部位,将肉样于4℃环境温度下运回实验室,将肉样分割成2.54 cm厚度的牛排并进行托盘包装,进行后续实验。
蔗糖(分析纯)、无水乙醇、二甲苯、盐酸、氨水、中性树胶,国药集团化学试剂有限公司;氯化钠(分析纯),天津市凯通化学试剂有限公司;苏木素染液套装,武汉塞维尔生物科技有限公司。
1.2 仪器与设备
AB104-S型分析天平(瑞士Mettler Toledo公司);BD-145HDE型冷藏冷冻转换柜(青岛海尔特种电冰柜有限公司);NMI20-015V-I型核磁共振成像仪(上海纽迈电子科技有限公司);BX41型光学显微镜(日本Olympus公司);JJ-12J型脱水机、JB-P5型包埋机(武汉俊杰电子有限公司);RM2016型病理切片机(上海徕卡仪器有限公司);Nikon Eclipse E100型光学显微镜(日本Nikon公司);Nikon DS-U3型成像系统(日本Nikon公司)。
1.3 实验方法
1.3.1贮藏损失的测定
参照文献[11]的方法,将各部位牛肉分割为2.54 cm厚度的牛排后,称其质量m1并记录,托盘包装后置于环境温度为0 ~ 4℃的冷库中避光成熟,分别在成熟2、3、5、7 d取出牛排,用滤纸吸干牛肉渗出的汁液,再次称量记为m2。重复3次取平均值。贮藏损失率W计算公式为
1.3.2横向弛豫特性的测定
参照文献[12]的方法并稍作修改。低场核磁共振(Low field nuclear magnetic resonance, LF-NMR)测定前将仪器预热30 min以上,测试温度为32℃。测定样品前使用标准油样采用自由感应衰减(Free induction decay,FID)序列(质子共振频率为21 MHz,等待时间为2 000 ms,接收机带宽为100 kHz,开始采样时间为0.05 ms,模拟增益为20,数字增益为3,累加次数为4)进行校准。肉样延肌纤维方向分切为1 cm×1 cm×2 cm的肉条,称量后轻轻放入直径为12 mm的核磁试管底部,32℃水浴加热至肉样内部恒温,擦干管壁后进行测定。样品的测定采用CPMG(Carr-Purcell-Meiboom-Gill)序列,质子共振频率为21 MHz,等待时间为2 500 ms,接收机带宽为250 kHz,测量回波间隔为0.6 ms,回波次数为10 000,累加次数为8。肉样平行测定3份取平均值,数据进行归一化处理。
1.3.3核磁成像的测定
参照文献[12]的方法并稍作修改。肉样的核磁成像测定前将仪器预热30 min,测试温度为32℃。在测试样品前,使用标准油样进行校准,并对样品进行定位预扫描后进行正式成像。重复时间为500 ms,测量回波间隔为20 ms,重复次数为4,成像尺寸为50 mm× 50 mm,肉样成像厚度为3 mm,同一样品进行2层成像,成像方式为横断面,图像保存为fid文件格式进行后续伪彩处理。
1.3.4肌节长度的测定
参照文献[13-14]的方法并稍做修改。在成熟1、2、3、5、7 d取背最长肌、半膜肌和腰大肌的牛肉样品2 g,置于50 mL烧杯中,加入4℃预冷的0.25 mol/L蔗糖溶液18 mL,低速匀浆(转速约为6 000 r/min)1 min,然后取悬浮液制作载玻片,在Olympus BX41型光学显微镜下放大1 000倍观察并拍照,每个样品取5个平行样(载玻片),每个样品拍摄25幅图像,总共测量125次。使用Image-Pro Plus 6.0软件测量肌节长度。125次测量结果的平均值即为该样品的肌节长度。
1.3.5肌细胞显微图像及肌纤维直径的测定
参照文献[12]的方法并稍作修改。在各成熟时间点沿肌纤维方向取肉样,置于脂肪专用固定液固定24 h以上,对样品修整后进行梯度酒精脱水并进行石蜡包埋和切片,依次将切片放入二甲苯Ⅰ 20 min、二甲苯Ⅱ 20 min、无水乙醇Ⅱ 5 min、75%酒精5 min后用自来水清洗。之后用苏木素染色3~5 min,盐酸水溶液分化,氨水水溶液返蓝,水洗。随后将切片依次入85%、95%的梯度酒精脱水,入伊红染液中染色5 min。再将切片依次放入无水乙醇Ⅰ 5 min、无水乙醇Ⅱ 5 min、无水乙醇Ⅲ 5 min、二甲苯Ⅰ 5 min、二甲苯Ⅱ 5 min后进行中性树胶封片。最后进行显微镜镜检,对图像进行采集。数据分析时,使用Pannoramic Viewer将采集的图像放大为原样品的200倍,并使用Adobe Photoshop CC 除去肌纤维间的结缔组织,通过Image-Pro Plus 6.0测量获得肌纤维直径。每份样品取50个结果,取平均值记为该样品的肌纤维直径。
1.4 数据分析
数据采用IBM SPSS Statistics 20.0软件以成熟时间、部位为固定因子,采用一般线性模型(General linear model,GLM)进行统计分析,用多重比较选择(Least significant difference,LSD)比较主效应因素。采用Image-Pro Plus 6.0分析肌节长度和肌纤维直径数据,低场核磁共振数据通过核磁共振成像仪自带的反演软件、采用联合迭代重建技术(Simultaneous iterative reconstruction technique,SIRT)方法反演获得,核磁成像伪彩图通过纽迈核磁共振图像处理软件V1.0分析获得。采用Orign 2018软件对数据制图。所有结果以平均值±标准差的形式表示。
2 结果与分析
2.1 不同部位牛肉成熟过程中贮藏损失变化
贮藏损失率表示牛肉在成熟过程中流失的汁液占总质量的百分比,相同时间点贮藏损失率越小表明其保水性越好,是衡量牛肉保水性的重要指标之一。从表1可以看出,成熟时间和部位对贮藏损失影响显著(P<0.01),成熟时间和部位的交互作用对贮藏损失影响不显著(P>0.05)。随着成熟的进行,贮藏损失率平均值由1.09%显著上升至2.34%(P<0.05),说明3种部位牛肉随成熟时间的延长,汁液流失显著增多。腰大肌的贮藏损失率(1.36%)显著低于背最长肌(1.86%)和半膜肌(2.09%)(P<0.05),说明腰大肌的保水性高于其余两组。贮藏损失率与成熟时间呈正相关(表1),表明随成熟时间延长,汁液流失更严重。文献[15]也表明贮藏处理的时间越长,贮藏损失越高。文献[16]同样表明牛背最长肌无论在托盘、真空还是气调包装中进行贮藏,其贮藏损失均持续上升。肌细胞结构的完整性受到破坏而导致肌肉汁液渗漏可能是其主要原因[9]。

表1 不同部位牛肉成熟过程中贮藏损失变化
2.2 不同部位牛肉成熟过程中横向弛豫特性变化
低场核磁共振通过测定肉品中氢原子核在磁场中的弛豫特性可以分析肉品中水分的分布和状态[12]。图1为牛肉成熟过程中横向弛豫特性的变化,图中出现了3种峰,峰Ⅰ、峰Ⅱ及峰Ⅲ分别代表结合水(0~10 ms)、不易流动水(10~100 ms)和自由水(100~1 000 ms),这与文献[17]的研究结果相一致。从图中可以看出,随着成熟时间的延长,3种部位牛肉的不易流动水(峰Ⅱ)的峰高呈现下降趋势,但结合水与自由水的变化趋势不明显。因此为了更好地分析3种水分的变化,对各峰的峰面积及其比例进行了显著性分析(表2),从而更好地分析水分随成熟时间的变化。
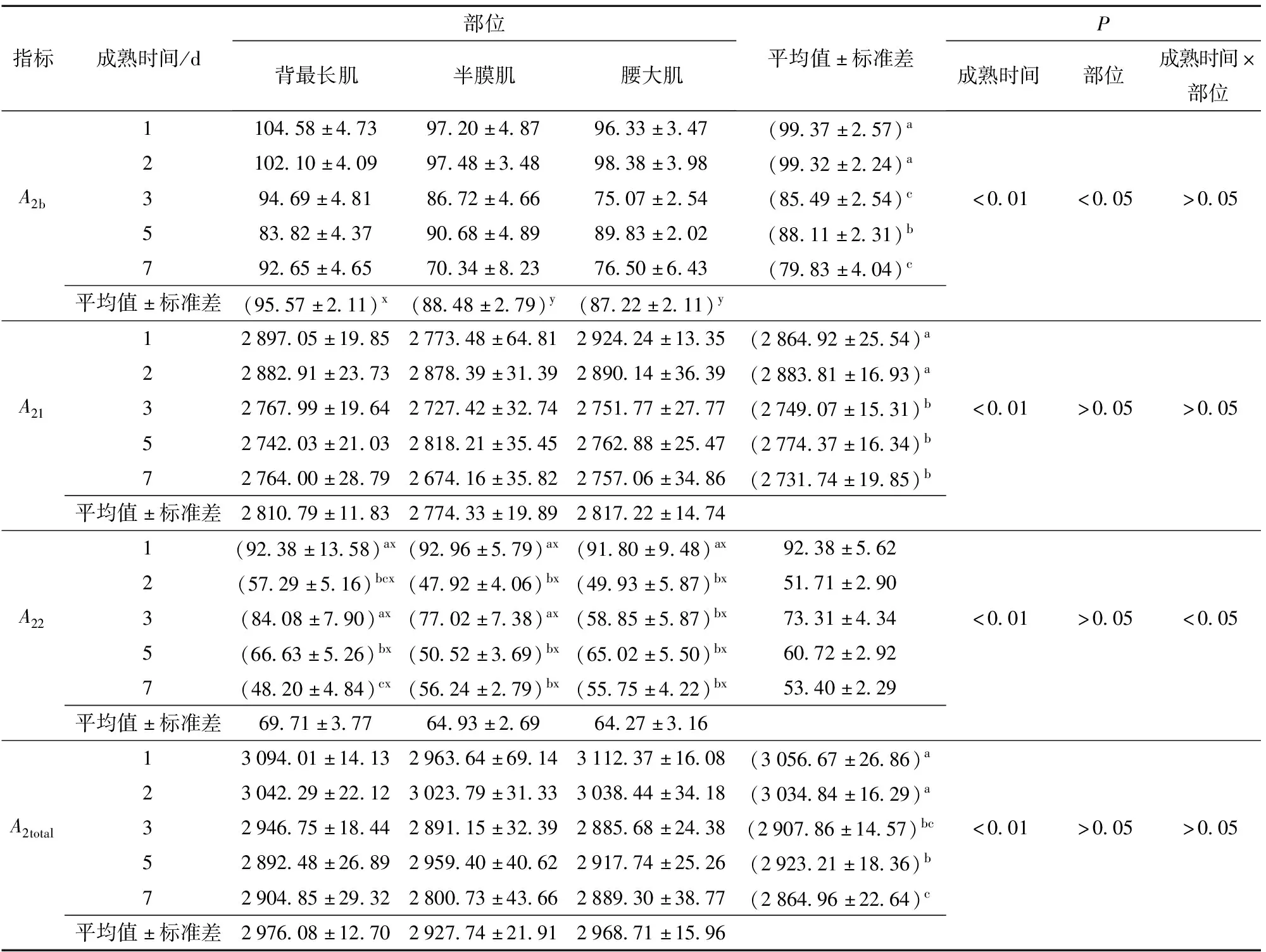
表2 不同部位牛肉成熟过程中弛豫峰面积A2变化
2.2.1弛豫峰面积变化
由表2可知,随着成熟时间的延长,3种部位牛肉的A2b由1 d的99.37显著降低至7 d的79.83,背最长肌的A2b显著高于半膜肌与腰大肌(P<0.05),后者之间无显著差异(P>0.05)。文献[18]认为,由于结合水占据总水分的比例不大,其整体的变化对肌肉保水性无太大影响。对于不易流动水峰面积A21,仅成熟时间对A21影响显著(P<0.01),部位对A21影响不显著(P>0.05),且成熟时间和部位的交互作用对A21影响不显著(P>0.05)。结合图1与表2可以看出,随成熟时间的延长,不易流动水峰面积从1 d的2 864.92显著降低至7 d的2 731.74(P<0.05),但3种部位牛肉的A21差异不显著(P>0.05),这意味着不易流动水的含量随成熟时间显著下降(P<0.05),3种部位之间的不易流动水含量无显著差异(P>0.05)。自由水的峰面积A22在成熟过程中的变化与A21类似,随成熟时间呈现显著下降趋势(P<0.05)。
2.2.2弛豫峰比例变化
弛豫峰面积百分比P2b、P21和P22反映了肉中结合水、不易流动水和自由水在总水分中所占的比例。由表3可知,背最长肌P2b在成熟1~3 d的变化不显著(P>0.05),但在5 d显著降低至2.88%(P<0.05),半膜肌P2b的变化较晚,在7 d时由3.04%显著降低至2.44%(P<0.05),腰大肌的变化趋势与背最长肌和半膜肌均不同,于成熟3 d显著降低至2.60%后,之后显著升高至3.09%,在7 d又显著降低至2.60%(P<0.05),结合水比例的剧烈变化可能是不同部位牛肉自由水的损失速度不同所造成的。

表3 不同部位牛肉成熟过程中弛豫峰面积百分比P2变化
对于不易流动水峰面积百分比P21,3种部位牛肉的P21在成熟过程中变化趋势相同,均随成熟时间的进行呈现显著下降后上升的趋势(P<0.05),在成熟7 d,3种部位牛肉的P21均超过95%,显著高于1 d(P<0.05)。且对比3种部位牛肉的P21发现,仅在成熟3 d腰大肌的P21显著高于背最长肌和半膜肌(P<0.05),在其余时间点P21的差异不显著(P>0.05)。P22变化的趋势与P21不同,在成熟1 ~ 2 d时,背最长肌、半膜肌和腰大肌的P22分别显著降低至1.89%、1.60%和1.66%(P<0.05),在2 ~ 3 d又显著升高(P<0.05),且不同部位牛肉间的P22也有所差异。P22的变化表明在成熟期间自由水变化的复杂性,且不同部位牛肉间的自由水变化存在差异,但结合表2可以发现,A2b、A21和A22随成熟时间的进行而降低(P<0.05),因此认为在成熟期间3种部位牛肉的结合水、不易流动水和自由水均减少,结合水的变化表明部分蛋白质发生变性,与蛋白质结合较弱的部分结合水流出肌细胞外[19-20]。3种水分比例的变化表明在成熟过程中,肉中水分的变化是动态的过程,且由于重力的作用,自由水逐渐流失。成熟2~5 d内P22增加的原因可能是成熟过程中部分肌原纤维间的水分转移至肌原纤维外的间隙,即不易流动水逐步向自由水转化,较高的自由水比例造成成熟后期汁液损失增加[21]。
2.3 不同部位牛肉成熟过程中核磁成像变化
图2表示成熟过程中3种部位牛肉氢质子密度成像图,颜色越深表示氢质子密度越高,即自由水含水率高。颜色越浅表示肉中的氢质子密度越低,自由水含水率越低[12,22]。随着成熟时间延长,核磁成像图像的颜色越来越浅,表明肉中的水分在损失。文献[18]在测量时发现低保水性的样品边缘亮度增加,但在本研究中不同部位间核磁成像的变化结果之间的差异不大,且结合贮藏损失的结果分析,半膜肌的核磁成像边缘与内部区域相比未见明显的亮度,可以得出3种部位冷却牛肉的水分流失速率无明显差异。此外,核磁图像中出现亮色的条带与成熟过程中的汁液流失通道的形成有关[23]。
分析部位之间保水性间的差异,除去肌肉类型的差异[7]和蛋白质降解速率的差异[24-25]等因素,肉中的水分分布和转化是影响保水性的又一大因素[23]。在整个成熟期间内,仅在成熟3 d腰大肌的P21显著高于背最长肌和半膜肌(P<0.05),在其余时间点P21的差异不显著(P>0.05)。此外3种部位牛肉的总水分相对含量之间(A2total)无显著性差异(P>0.05),核磁成像的结果同样支持该结论,颜色的变化并无明显差异。因此分析认为3种部位牛肉保水性存在差异的原因不是水分分布和含水率的差异性造成的。
2.4 不同部位牛肉成熟过程中肌细胞变化
图3为背最长肌、半膜肌与腰大肌在成熟过程中的HE染色(苏木精-伊红染色法)图像,从图中可以看出在成熟前期肌细胞排列紧密且肌细胞维持良好的形态,腰大肌的细胞排列更紧密,背最长肌和半膜肌细胞间的空隙较大,随着成熟的进行,细胞不再维持良好的形态且发生破裂,致使细胞中的水分更易流失。文献[26]认为肌肉中的生理生化反应会对肌肉的组织形态和结构产生影响,并且会使随后的蛋白质变性呈现一定程度的差异,肌细胞的伸缩随之受到影响,最终对牛肉的保水性产生影响。
2.4.1不同部位牛肉成熟过程中肌纤维直径变化
由图4(图中a~d不同字母表示同一部位不同成熟时间差异达到显著水平(P<0.05),x、y、z不同字母表示同一成熟时间不同部位差异达到显著水平(P<0.05))可以看出,在成熟过程中3种部位牛肉的肌纤维直径均呈现先显著上升后下降的过程(P<0.05),在成熟1~2 d牛肉的肌纤维直径呈现显著升高趋势,2~7 d均呈现显著降低的趋势(P<0.05)。在整个成熟时间内,腰大肌的肌纤维直径均显著低于背最长肌与半膜肌(P<0.05),表明腰大肌的肌纤维直径最低。成熟前5 d背最长肌的肌纤维直径显著高于半膜肌(P<0.05),直到成熟7 d时,背最长肌与半膜肌的肌纤维直径无显著差异(P>0.05)。文献[23]表明,肌肉纵向收缩的过程对肉中水分的流动性具有重要的影响,包括肌纤维、肌原纤维直径的改变及肌节长度的改变,改变了弛豫水分的特征。结合图3可以分析出,在成熟过程中,成熟前期(1~2 d)肌细胞发生膨胀,在成熟后期肌细胞皱缩并发生破裂,最终导致成熟7 d总水分损失的升高。
2.4.2不同部位牛肉成熟过程中肌节长度变化
表4为成熟过程中不同部位牛肉肌节长度的变化,部位、成熟时间及其交互作用对肌节长度影响显著(P<0.01)。在成熟期间,对比不同部位牛肉的肌节长度来看,腰大肌的肌节长度显著高于背最长肌和半膜肌,半膜肌的肌节长度最小(P<0.05)。对比不同部位牛肉的肌肉结构指标发现,腰大肌的肌纤维直径均显著低于背最长肌与半膜肌(P<0.05),而腰大肌在整个成熟期间内的肌节长度显著高于背最长肌和半膜肌(P<0.05)。由于肌节的单位体积是恒定的,在成熟过程中,3种部位之间随着肌节的缩短造成肌原纤维直径变大,肌细胞内肌原纤维之间的空隙减小;同时伴随肌纤维直径的减小(图4),胞内空间进一步减小,造成肌原纤维间汁液流失,因而导致保水性降低[27]。由表4可知,在成熟后期,不同部位牛肉的肌节长度均呈现不同程度的增加,背最长肌和半膜肌在成熟7 d的肌节长度已经超过成熟1 d,但腰大肌的肌节长度在成熟后期变化幅度不大。文献[28]认为肌节长度的变化影响肌球蛋白与肌动蛋白之间的储水空间,通常认为肌节长度越长,保水性越好,这与本研究结果一致。
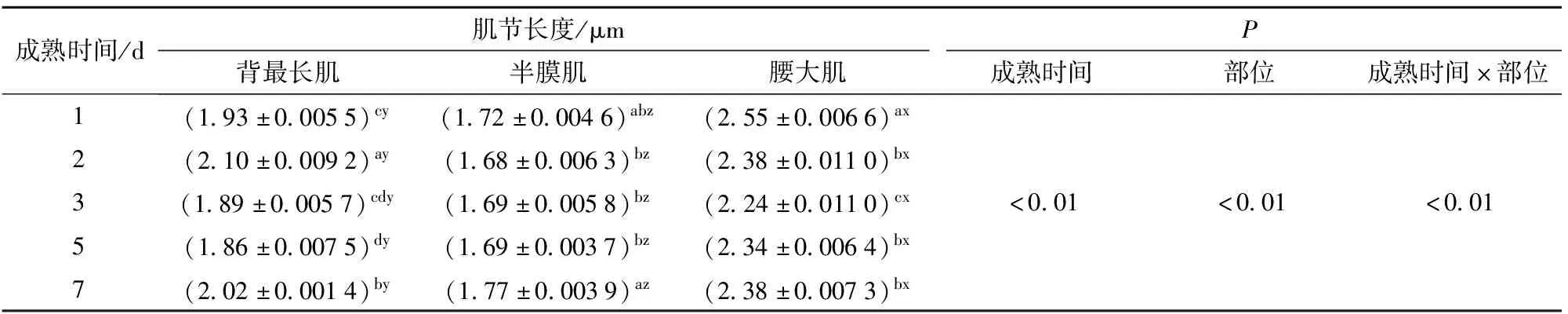
表4 成熟过程中不同部位牛肉肌节长度
3 结束语
在成熟过程中,腰大肌的贮藏损失显著低于背最长肌与半膜肌(P<0.05),背最长肌和半膜肌的贮藏损失无显著差异(P>0.05)。LF-NMR结果表明,3种部位牛肉水分变化和流失的速率一致,水分的变化速率并不是造成不同部位牛肉保水性存在差异的原因。不同部位牛肉的肌肉结构存在差异,肌纤维直径和肌节长度通过改变肌原纤维外部空间而影响保水性。本研究利用低场核磁共振技术、显微成像技术对不同部位牛肉在成熟过程中的水分变化进行探讨,为研究肉品保水性和不同部位肉品质差异提供理论依据。
