不同前处理方法在鸡体液或组织FAA检测中的研究
2021-06-09杜光英曾选智杨永兴甘文斌张燕鸣黄艳芳陶琳丽
陈 琛, 杜光英, 曾选智, 杨永兴, 甘文斌,陶 冶, 张燕鸣, 黄艳芳, 陶琳丽*, 张 曦*
(1.云南农业大学动物科学技术学院,云南省动物营养与饲料重点实验室,云南昆明650201;2.云南省兽药饲料检测所,云南昆明650201;3.云南省饲料工业协会,云南昆明650201)
氨基酸作为一类非常重要的营养及功能性物质,在鸡体内的代谢过程及代谢效果可通过鸡体液或组织中FAA的定性与定量分析来表征,但当前关于鸡体液或组织中FAA检测的相关报道较少,因此针对其开展研究是十分必要的。在通用型检测中,检测FAA可用的仪器分析方法有高效液相色谱法(李维等,2016)、超高效液相色谱法(董尚文等,2018)、气相色谱-质谱联用法(黄志等,2017)、毛细管电泳法等(陈惜贞,2007),其中最主要的是高效液相色谱法,该法因衍生的先后可分为柱前衍生和柱后衍生两类,而柱后衍生随即发展出氨基酸检测专属仪器—氨基酸自动分析仪。总体来说,氨基酸自动分析仪的灵敏度不如高效液相色谱仪,但其在分离度、重现性、操作简便性和方法可移植性等方面均具有较佳的表现(孙蕊等,2018)。本研究使用氨基酸自动分析仪完成样品检测。
由于鸡不同体液或组织成分复杂各异,存在各种干扰因素,FAA的含量也存在很大差异,因此研究去除这些干扰的前处理方法就显得十分关键。本试验针对FAA吸收代谢途径,以血清、肝脏和肌肉组织这些可较好表征代谢的样品作为研究对象,研究适用于这些体液或组织样本的前处理方法,致力于提升鸡体液或组织样品净化程度的同时,优化步骤,提高分析准确性,保障检测分析结果。针对影响鸡体液或组织FAA检测的干扰物质,本试验选取3种具有代表性的鸡体液或组织(胸肌、血清、肝脏组织),分别采用盐析、醇沉和有机酸化学沉淀法来去除体液样品中的蛋白杂质,利用高速离心沉淀大分子杂质,比较经不同前处理后的检测效果,实现样品的净化,方法的优搭。
1 材料与方法
1.1 试剂与材料 出栏土杂鸡;硫酸铵、乙醇、SSA、三氯乙酸(TCA),均为国产分析纯试剂。
41种氨基酸混合标样:赖氨酸(Lys)、蛋氨酸(Met)、苏氨酸(Thr)、精氨酸(Arg)、酪氨酸(Tyr)、脯氨酸(Pro)、谷氨酸(Glu)、半胱氨酸(Cys)、天冬氨酸(Asp)、天冬酰胺(Asn)、丙氨酸(Ala)、丝氨酸(Ser)、甘氨酸(Gly)、缬氨酸(Val)、色氨酸(Trp)、苯丙氨酸(Phe)、亮氨酸(Leu)、异亮氨酸(Ile)、组氨 酸 (His)、 羟 基 脯 氨 酸 (Hypro)、 乙 醇 胺(EOHNH2)、鸟氨酸(Orn)、氯化铵(NH4)、羟基赖氨酸(Hylys)、鹅肌肽(Ans)、肌肽(Car)、1-甲基组氨酸(1Mehis)、3-甲基组氨酸(3Mehis)、磷-丝氨酸(P-Ser)、尿素(Urea)、牛磺酸(Tau)、磷-乙醇胺(PEA)、肌氨酸(Sar)、α-氨基肥酸(α-AAA)、α-氨基正丁酸(α-ABA)、β-羟基异丁酸(β-AiBA)、γ-氨基正异丁酸(γ-ABA)、β-羟基丙酸(β-Ala)、瓜氨酸(Cit)、胱硫醚(Cystha)、高胱氨酸(H-Cysteine),购自德国曼默博尔公司,氨基酸的浓度均为100 nmol/mL。
10%的SSA溶液:精确称取100 g的SSA,加超纯水1 L,混匀充分溶解。
10%的TCA溶液:精确称取100 g的TCA,加超纯水1 L,混匀充分溶解。
饱和硫酸铵溶液:称取硫酸铵80 g溶解到100 mL水中,加热到80℃左右,溶解部分过滤,其余的再溶,仍有一部分结晶,过滤的溶液当降到室温时就会有结晶,平衡1~2 d,取上清液用氨水调节pH至7.2使用。
流动相A、B、C、D、E、F,反应液R,清洗液W均购自德国曼默博尔公司。(其中,R为衍生剂茚三酮,用前需要活化,每500 mL衍生剂加1 mL活化剂混匀,现配现用)
1.2 仪器与设备 A 300氨基酸自动分析仪(membraPure);GT16-3A型高速台式离心机(北京时代北利离心机有限公司);TD5A-WS低速大容量离心机(湖南湘立科学仪器有限公司);EUK2-20TY实验室超纯水器(南京欧铠环境科技有限公司);SHA-B恒温振荡器(常州智博瑞仪器制造有限公司);GENIUS 3涡旋混匀器(IKA@VORTEX);SCIENT2-IID超声波细胞粉碎机(宁波新芝生物科技股份有限公司);FSH-2A可调高速匀浆机(常州智博瑞仪器制造有限公司);AL104电子天平(METTLER TOLEDO)。
1.3 试验方法 胸肌、腿肌:将屠宰冻存的胸肌腿肌取出解冻,精确称取5 g(精确至0.0001 g)肌肉,按重量(g):体积(mL)=1:3的比例加入3倍体积10%的SSA溶液,匀浆,置于4℃冰箱中冷藏静置60 min,之后14500 r/min离心15 min,经0.22μm滤膜过滤后上机分析。
血清:屠宰鸡只时直接进行颈部采血,新鲜血液放入离心管内静置,以3500 r/min离心10 min,取上清液,密封,记号,-80℃冻存,备用。上机前,取备用血清1 mL于离心管内,加入10%的SSA溶液1 mL,混匀,置于4℃冰箱中冷藏静置60 min,之后14500 r/min离心15 min,经0.22μm滤膜过滤后上机分析。
肝脏组织、肠道组织:将屠宰冻存的组织样品取出解冻,精确称取组织块或食糜2 g(精确至0.0001 g)于50 mL离心管内,按重量(g):体积(mL)=1:9的比例加入9倍体积的生理盐水(0.9%的氯化钠溶液),匀浆,6000 r/min离心15 min,取上清液1 mL加入10%的SSA溶液2 mL,混匀,置于4℃冰箱中冷藏静置60 min后,以14500 r/min离心15 min,经0.22μm滤膜过滤后上机分析。
为对比不同除杂试剂对检测结果的影响,选择3种体液按照上述步骤依次更换10%的SSA溶液为饱和硫酸铵溶液,无水乙醇,10%的TCA溶液,其余步骤不变。另选择其中某一体液或组织样品,分别使用高速匀浆机与超声波粉碎机匀浆,比较不同色谱效果。
1.4 色谱柱条件 检测参数设置:阳离子交换柱,柱温50℃,泵压20 bar;流动相(洗脱液):A、B、C、D、E、F,流速200μL/min;反应液:R,流速100μL/min;衍生反应器温度:120℃;进样量:30μL。
1.5 统计与分析 不同体液样品的稀释因子根据样品前处理过程推算所得,输入仪器自带软件,内标法计算各FAA含量,所有数据采用Mcrosoft Excel软件进行整理。
2 结果与分析
2.1 不同前处理方法的选择 使用饱和硫酸铵溶液处理的样品上机后仪器基线漂移十分严重,因此排除盐析作为蛋白沉淀剂使用的前处理方法。超声波粉碎匀浆相比高速匀浆机匀浆色谱图峰高更高一点,响应值较高,因此匀浆均采用超声波细胞粉碎机。41种FAA标品上机后的色谱图如图1所示,鸡体液FAA含量均由标品内标仪器自带软件计算所得。
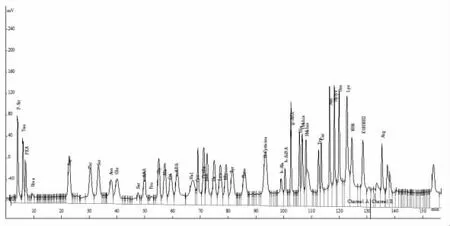
图1 41种FAA标准品色谱图
2.2 鸡体液FAA含量的检测结果
2.2.1 鸡胸肌FAA的含量 使用3种不同除杂剂按相同步骤进行前处理后,鸡胸肌中41种FAA总含量、12种蛋白质编码必需FAA含量、必需FAA占总FAA比例以及19种蛋白质编码FAA各自的含量见表1。
由表1可知,用3种化学试剂处理鸡胸肌样品,FAA检测结果有所差异。使用SSA处理的鸡胸肌总FAA的含量为2~3 g/kg。用TCA处理的各氨基酸峰值响应普遍偏高,这可能与TCA自身化学特性有关。而乙醇处理过的样品色谱峰杂峰较多,峰图效果不如SSA处理过的分离度好,总FAA含量偏高,必需FAA占总FAA比例反而偏低。故用10%SSA处理的样品上机较适,其中必需FAA占总FAA比例为15.08%,在19种蛋白质编码FAA中,鸡必需FAA占12种,其中赖氨酸含量最高,精氨酸和脯氨酸次之,异亮氨酸含量最低,非必需氨基酸中丙氨酸含量最高,天冬酰胺和天冬氨酸含量最低。
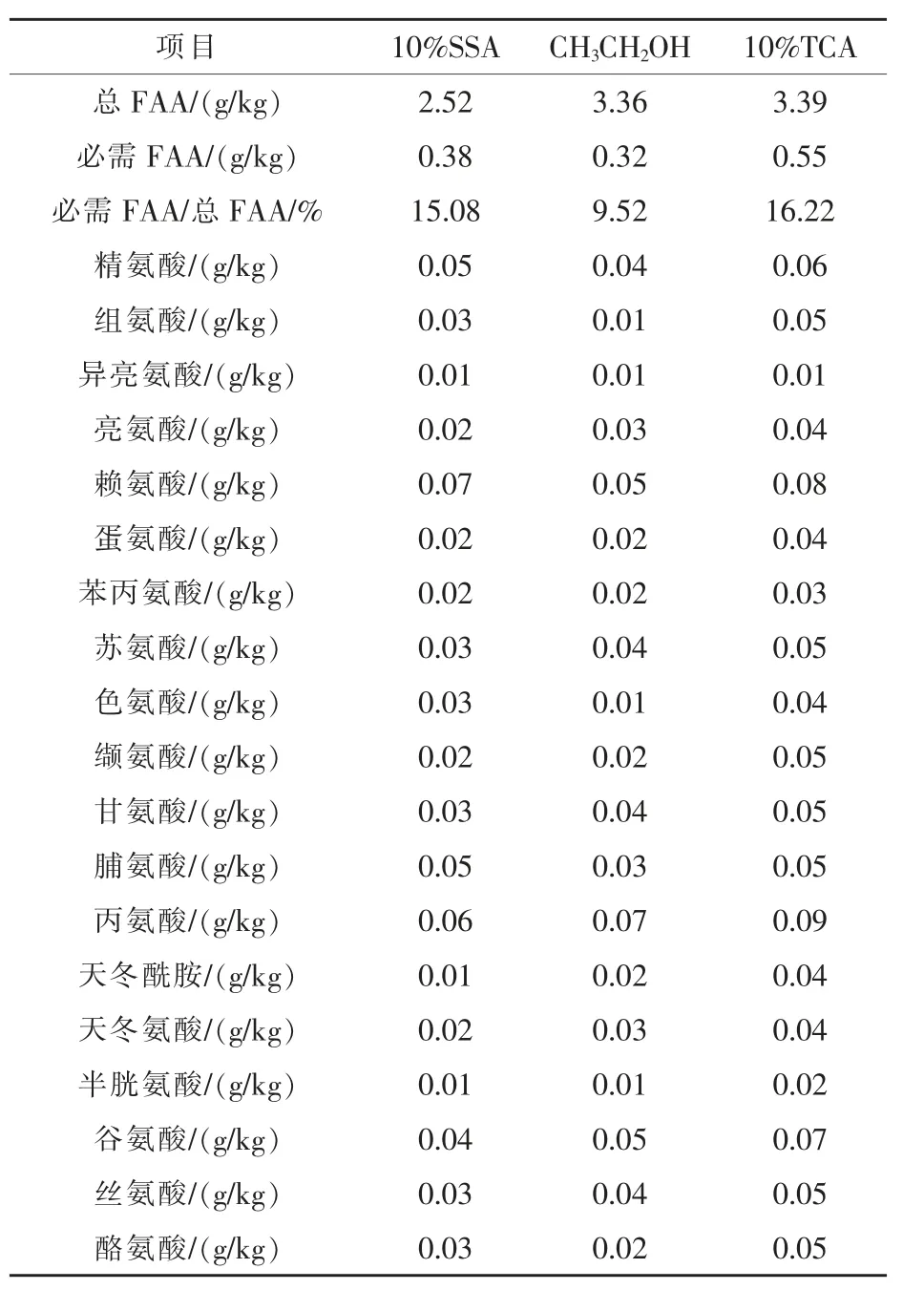
表1 鸡胸肌FAA的含量
2.2.2 鸡血清FAA的含量 使用3种不同除杂剂按相同步骤进行前处理后,鸡血清中41种FAA总含量、12种蛋白质编码必需FAA含量、必需FAA占总FAA比例以及19种蛋白质编码FAA各自的含量见表2。
由表2可知,用3种化学试剂处理鸡血清样品,FAA检测结果有所差异。使用SSA处理的鸡血清总FAA含量为11.36 g/L,峰图效果最优。乙醇处理的样品明显和其他两种试剂处理的结果相差较大,FAA总量均高于其他两种试剂处理结果的2倍左右,导致必需FAA占总FAA的比例大幅降低约10~17个百分点,再结合色谱图情况,用乙醇作为沉淀剂除杂检测结果并不理想。故以10%SSA处理的样品检测结果为准,必需FAA占总FAA的比例为43.93%,在20种蛋白质编码FAA中,鸡必需FAA占12种,其中脯氨酸含量最高,赖氨酸次之,精氨酸再次,异亮氨酸含量最低,非必需FAA中丙氨酸含量最高,丝氨酸次之,天冬酰胺含量最低。
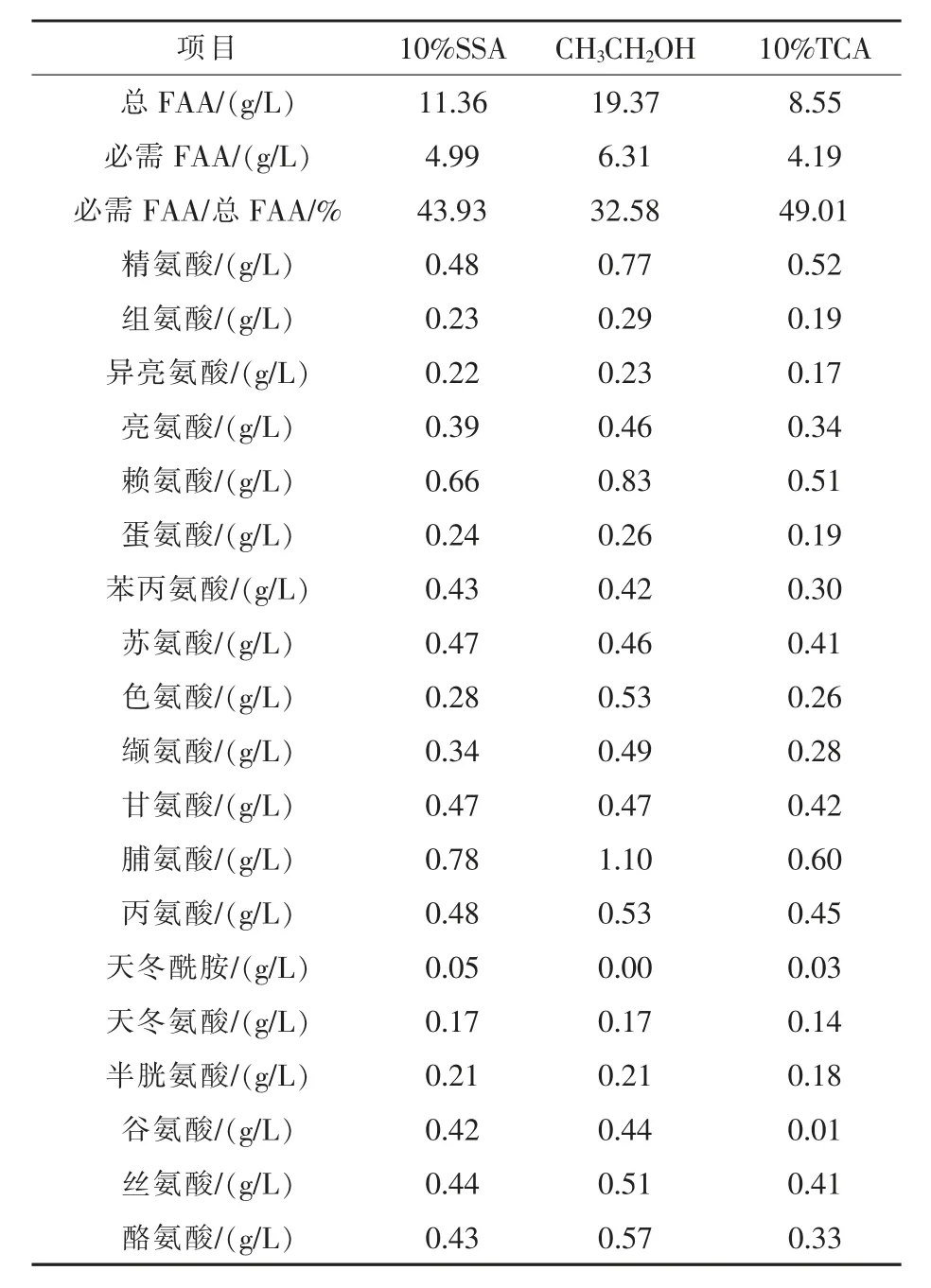
表2 鸡血清FAA的含量
2.2.3 鸡肝脏FAA的含量 使用3种不同除杂剂按相同步骤进行前处理后,鸡肝脏中41种FAA总含量、12种蛋白质编码必需FAA含量、必需FAA占总FAA比例以及19种蛋白质编码FAA各自的含量见表3。
由表3可知,用3种化学试剂处理鸡肝脏样品,FAA检测结果有所差异。使用SSA处理的鸡肝脏总FAA含量为11.62 g/kg,TCA处理后的FAA总量相对SSA处理的结果偏高,乙醇处理的样品FAA总量高于SSA,但必需FAA含量均低于其余两种试剂处理的样品,所以必需FAA占总FAA比例亦偏低很多,且每种必需FAA含量与其余两组样品差异也很大。故以10%SSA处理的样品检测结果为准,必需FAA占总FAA的比例为35.28%,在20种蛋白质编码FAA中,鸡必需FAA占12种,其中精氨酸含量最高,脯氨酸次之,赖氨酸再次,异亮氨酸和蛋氨酸含量最低,非必需FAA中谷氨酸含量最高,半胱氨酸含量最低。
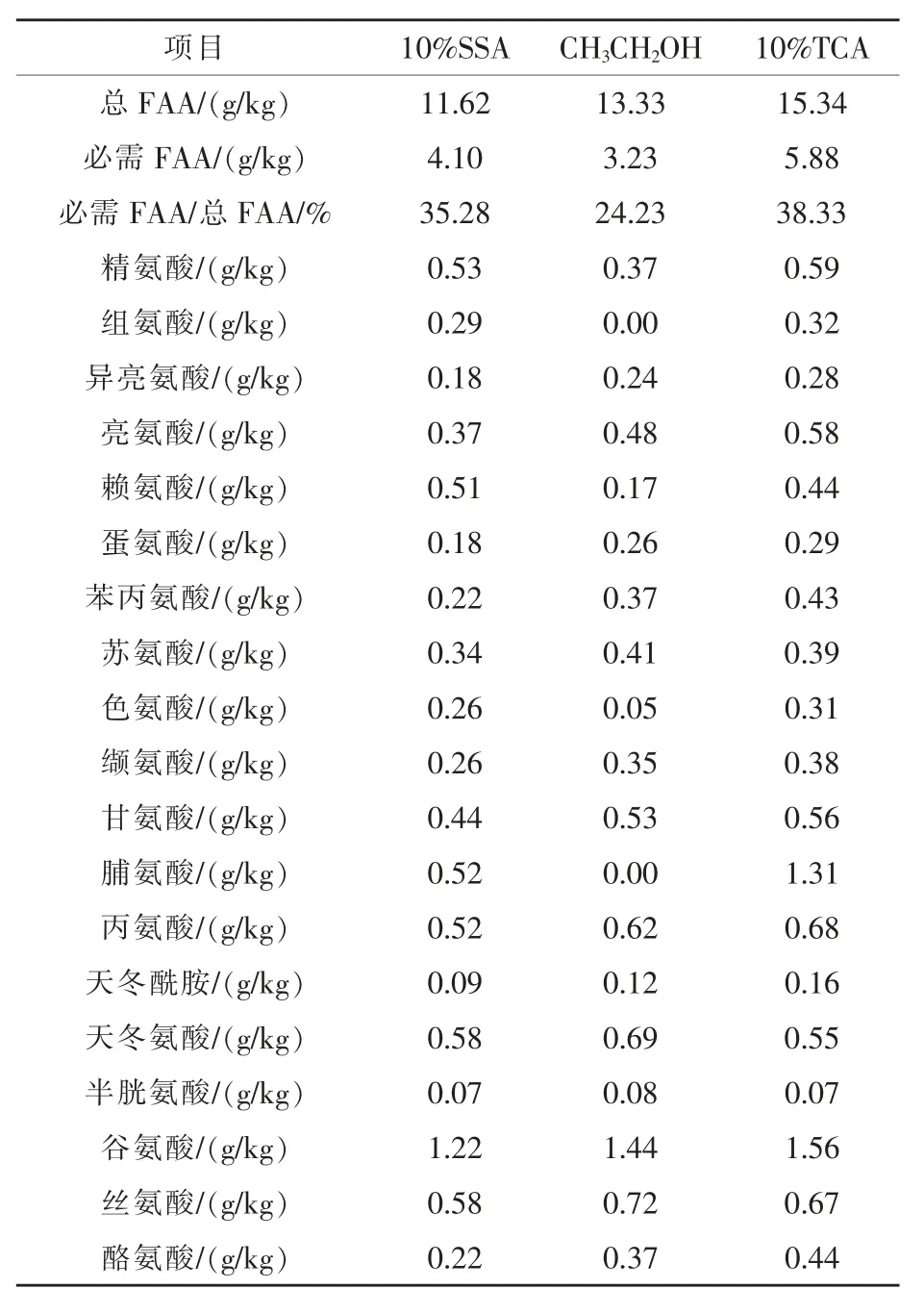
表3 鸡肝脏FAA的含量
3 讨论
样品前处理是检测分析的重中之重 研究采用柱后衍生法完成检测,即使用氨基酸自动分析仪,完成样品色谱分析。色谱分析包含样品采集、样品前处理、色谱分析、数据处理与结果这一系列过程。样品前处理所耗时间占样品分析时间的60%,远大于色谱分析的时间,前处理过程会消耗大量的溶剂及其他化学品,占分析的消耗成本最大,并且其是整个试验中重复性和准确性最差的环节,是影响结果好坏的决定性步骤。适当的样品前处理,不仅可保护价格昂贵的离子交换树脂,对于分析结果的准确可靠和灵敏性亦具有决定性作用。由于分析对象鸡体液或组织的组成、浓度、物理形态等均能影响色谱分析,因而对鸡体液或组织样品的前处理就成为提高分析测定效率,改善和优化色谱分析的关键环节。
3.1 FAA检测前处理方法 前人多数研究均以血清作为检测对象,前处理过程存在异曲同工之处。周文举(1987)在测牛血清FAA时,取血清加2%的SSA溶液(1:2.5)混合,振荡30 min后,1500 r/min离心15 min,取无蛋白的上清液为上机试样,使用日立835-50型氨基酸自动分析仪检测。冯鑫等(2017)分析家兔血清FAA时,采用心脏取血,低速离心制备待测血清;上机前,取血清加入8%的SSA溶液(1:1)混合,充分振荡混匀,以15000 r/min离心15 min除杂,取上清液过膜,滤后样品按照日立L-8900氨基酸分析仪使用说明书上机操作。王军萍(1988)测定中华鳖血清时,取血清与8%的SSA溶液也是1:1混合。朱振声(1997)在测定人血清FAA时,取人空腹前前臂静脉血1~1.5 mL,置于含肝素抗凝、无离子离心管中,立即离心(3000 r/min,10 min,40℃)后,取一定量血清,按1:4加5%的SSA溶液混合摇匀,4℃环境放置10 min,再高速离心沉淀杂蛋白(18000 r/min,20 min,4℃),取上清液上机或置15℃以上环境塞盖保存,保存时间不超过3 d。王小艳等(2013)在测定乳牛乳静脉血液FAA时,处理待测血清样本和上述类似,上机前取血清加10%的SSA溶液以1:4混合,高速离心过膜后保存于-20℃冰箱备用。本研究针对鸡血清采用的前处理方法亦是遵循以上基本步骤,用制备好的血清与沉淀剂(1:1)混合,4℃静置1 h,高速离心过膜后即可上机,分析效果可满足色谱要求。
对于肝脏FAA的检测,相关报道较少。周铭文等(2015)在测定石斑鱼肝脏中的FAA时,取组织与4%的SSA溶液(1:4或1:2)混合,超声波仪超声匀质5 min后,15000 r/min离心15 min,将上清液全部转移至25 mL容量瓶中,沉淀物再用上述方法提取1次,合并上清液,混匀,用0.02 mol/L盐酸溶液定容,溶液经0.45μm滤膜过滤后,上机测定FAA含量。韦京豫等(2000)将雄性大鼠处死后取肝脏,用5%的SSA溶液研磨,离心后取上清液,使用日立835-50型氨基酸自动分析仪检测。本研究针对鸡肝脏组织、肠道组织采用的前处理方法步骤一致,由于这两类组织FAA含量较高,因此均先精确称取组织加生理盐水(1:9)匀浆,再取上清液加入沉淀剂(1:2)混合,4℃静置1 h,高速离心过膜后即可上机,分析效果亦能满足色谱要求。
对于肌肉组织FAA的检测,相关研究则较为丰富。樊艳凤等(2018)称取鸡胸样品加入0.02 mol/L盐酸溶液(1:3),充分均质后用0.02 mol/L的盐酸溶液定容至25 mL,1000g离心10 min;取上清液加入8%的SSA溶液(1:1)混合,于4℃冰箱中静置30 min后,12000 r/min离心10 min,再取上清液加入正己烷(1:1),混匀后10000 r/min离心10 min,取下层液体,过孔径0.22μm滤膜后用氨基酸自动分析仪检测。王帅等(2017)用TCA除样品蛋白,使用氨基酸分析仪测定中华绒鳌蟹肝胰腺和体肉中的FAA。张苏平等(2017)测定4种贝类肌肉FAA时,精确称取组织加入0.02 mol/L的稀盐酸(1:15),充分均质后用超声波清洗,再用冷冻离心机(5000 r/min,4℃)离心10 min,收集上清液;将剩余残渣加入0.02 mol/L稀盐酸后搅拌,再次离心(5000 r/min,4℃)5 min,合并上清液,定容至50 mL;定容后取溶液加入5%的SSA溶液(1:1)混合,离心(10000 r/min,4℃)10 min,经0.22μm水相滤膜过滤后,上机检测。Findley等(1978)在测定蓝蟹肌肉或血浆的FAA时,将肌肉或血浆样品与4%的SSA溶液(3:1)混合,超声波粉碎匀质,13000 r/min离心沉淀杂质,取上清液经0.45μm滤膜过滤后上机。林建伟等(2015)检测对虾肌肉FAA的前处理方法同前。王燕等(2003)研究撒坝火腿中FAA时,精确取样后加入10%的SSA溶液(1:20)混匀,于4℃下放置20 h,4℃高速离心10 min后取上清液,用4 mol/L的NaOH溶液调整滤液pH至6.0,并定容至50 mL,经10 kDa超滤膜超滤除去大分子后,用氨基酸自动分析仪检测。马建爽等(2015)检测肉鸡肌肉FAA时,称取肌肉组织样加入去离子水(1:4),在冰浴中用分散器高速匀浆3次(22000 r/min,每次10 s,间隔10 s),然后加入与去离子水同体积的10%的SSA溶液,振荡混合,静置10 min,于4℃下高速离心10 min,用定量滤纸过滤,滤液用4 mol/L的LiOH溶液调pH至2.2,再用去离子水定容,经滤膜过滤后用全自动氨基酸分析仪检测。Liao等(2009)测定猪肉中FAA时,亦是先取肉样加入8%的SSA溶液,冰水中匀浆,用8000 r/min离心13 min,取上清液用0.45μm滤膜过滤后即可上机。可见以上对于肌肉中FAA前处理方法大多较为复杂,旨在使上机液浓度与pH合宜,本研究针对鸡胸肌、腿肌的前处理方法参考了以上方法,通过预试探究后确定了适合鸡肌肉FAA检测较为快速简便的前处理方法,精确取样后加入沉淀剂匀浆(1:3),4℃静置1 h后,高速离心过膜后即可上机,分析效果亦能达到色谱要求。
3.2 不同蛋白沉淀剂对检测结果的影响 氨基酸自动分析仪的流动相成分均为不同浓度的盐溶液,洗脱过程为梯度洗脱,因此使用同为盐类物质的硫酸铵去除蛋白会导致盐类物质残留在柱子内,造成样品检测失败,冲洗柱子耗费试剂与时间,从而影响仪器使用寿命,因此盐析沉淀除杂并不适用于该研究的前处理。而超声粉碎不仅可破碎体组织,还可将组织细胞内的成分充分破出,所以较机械匀浆检测响应值高,结果更为准确。
在前处理过程中使用不同化学试剂沉淀蛋白时,会不可避免地造成程度不同的基质效应,导致检测响应值受到影响,表现出结果上的差异。胸肌FAA总量用SSA处理的检测结果与樊艳凤等(2018)相近,鸡3种体液或组织FAA总量表现为肝脏>血清>胸肌,用TCA处理的与其表现一致,乙醇则不完全一致;用SSA处理的鸡3种体液或组织中必需FAA含量表现为血清>肝脏>胸肌,与用TCA处理的一致,乙醇处理的有异;用SSA、TCA和乙醇处理的鸡3种体液或组织中必需FAA占总FAA的比例表现同前。总的来说,检测鸡体液或组织FAA推荐使用SSA或TCA这两种有机酸进行蛋白除杂,两者处理的样品结果较为接近,但大多体液或组织样品的总FAA、必需FAA以及必需FAA占总FAA比例均表现为TCA处理的样品值高于SSA,这可能与TCA自身性质有关,随蛋白分子量增大,它可能渗入分子内部,匀浆产热时会造成样品中部分蛋白酸水解,导致FAA检测响应值普遍增大,且TCA毒性较大,属于致癌物质,因此应慎用。乙醇与有机酸处理的结果差异较大,从色谱图表现来看,杂峰亦最多,因此会导致检测响应值不太准确。
4 结论
使用氨基酸分析仪检测鸡体液或组织FAA时,针对不同体液或组织样品需采用不同的前处理方法。其中,蛋白杂质沉淀采用有机酸中的磺基水扬酸,组织匀浆采用超声波粉碎较为理想。
