3,22-二羟基何伯烷的单晶结构及波谱学数据
2021-06-09郭文文
姜 垒,付 阳,郭文文,郑 果,王 强,*
1. 河南省科学院高新技术研究中心,河南 郑州 450002;2. 河南省生殖健康科学技术研究院,河南 郑州 450002
引 言
何伯烷型三萜,例如3α,22-二羟基何伯烷(化合物1)、3β,22-二羟基何伯烷(化合物2)、3-氧代-22-羟基何伯烷(化合物 3),以及 3β,22-二羟基-21α-H-何伯烷(化合物 4)(图 1)[1-6]等,是一类重要的天然产物,广泛分布于各种植物的叶和茎皮中.其中,化合物1和化合物2可以通过还原化合物 3得到[1,7],两者的绝对构型通常基于化学反应[2,4-6]或关键的核磁共振(NMR)数据,包括1H NMR和/或13C NMR数据来判定[2,3].然而,文献[2,3,8]报道的NMR数据并不完整.

图1 四种天然何伯烷型五环三萜的结构Fig. 1 The structures of four hopane natural products
本文在制备得到纯的化合物1和化合物2的基础上,利用X-射线单晶衍射(XRD)实验测得了化合物2的绝对构型,并完整归属了这两个化合物的1H NMR和13C NMR数据.
1 实验部分
1.1 化合物制备
起始原料化合物3从达玛树脂(Damar resin)中分离得到.根据文献[4]方法,化合物3溶于甲醇和二氧六环的混合溶剂,NaBH4作为还原剂,加热回流还原化合物3,得到的主产物为β-异构体(化合物2).然而,与文献[8]所述不同的是,快速柱色谱并不能分离纯化这两个异构体(化合物1和化合物2).此外,无论用甲醇做溶剂、NaBH4为还原试剂,还是四氢呋喃作溶剂、三异丁基硼氢化锂(L-selectride)为还原试剂,均不能得到单一构型化合物,两种方法得到的化合物1和化合物2的摩尔比分别为1:9和6:4(利用1H NMR谱图计算).鉴于两种异构体均需要进行1H和13C NMR归属,我们选择三异丁基硼氢化锂作为还原试剂来获得纯的化合物1和化合物2.
化合物1和化合物2的制备如图2所示.将化合物3(221 mg,0.5 mmol)溶于2,6-二甲基吡啶(2,6-Lutidine,10 mL),冰浴下加入三乙基硅基三氟甲磺酸酯(TESOTf)2.6 mL(2.6 mmol),滴加完毕后室温搅拌3 h,经薄层色谱(TLC)检测反应完毕后,加水、乙酸乙酯萃取,硅胶柱分离得到化合物5(3-氧代-22-三乙基硅基何伯烷)(268 mg,96.2%).将化合物5(200 mg,0.36 mmol)溶于无水二氯甲烷(10 mL),-78 ℃加入三异丁基硼氢化锂2.0 mL(1.0 mol/L四氢呋喃溶液),低温下继续搅拌4 h,反应完毕后加水,二氯甲烷萃取,硅胶柱分离得到化合物6a(114 mg,56.6%)和6b(76 mg,37.8%).称取化合物 6a(3α-羟基-22-三乙基硅基何伯烷)和6b(3β-羟基-22-三乙基硅基何伯烷)各56 mg(0.1 mmol)分别溶于10 mL四氢呋喃,室温下各加入四丁基氟化铵(TBAF)1 mL(1.0 mol/L四氢呋喃溶液),继续搅拌6 h,反应完毕后蒸干溶剂,加水和二氯甲烷萃取,硅胶柱色谱分离得到化合物1(39 mg,87.7%)和化合物2(40 mg,89.9%).
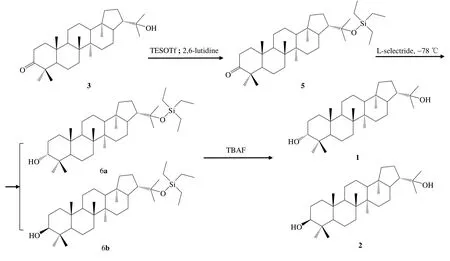
图2 化合物1和化合物2的合成路线Fig. 2 Synthesis of compound 1 and compound 2
上述方法也成功用于白桦脂酸衍生物[9]和核苷类化合物[10]α-、β-异构体的分离,表明该方法适用于极性相似的α-、β-异构体的分离纯化.
1.2 XRD实验
为了确认化合物1和化合物2的绝对构型,以便正确归属两个化合物的1H和13C NMR数据,以二氯甲烷和甲醇作为结晶溶剂,得到了化合物2的无色、块状单晶(多次实验未能得到化合物1的单晶).选择0.20×0.18×0.15 mm3大小的晶体,在Agilent SuperNova Diffraction单晶衍射仪上,采用经石墨单色化的Cu Kα射线(λ=1.541 78 Å)进行测量,各衍射数据在293 K下收集.
1.3 NMR实验
样品溶于氘代吡啶(pyridine-d5),并以吡啶作为内标定标(δH7.22,δC123.9).1D和2D NMR实验均在配备OneNMR Probe探头的Agilent 400-MR型NMR谱仪上完成.1H NMR和13C NMR的工作频率分别为399.79 MHz和100.54 MHz,谱宽分别为4 006.4 Hz和25 000 Hz.2D谱包括NOESY和2D梯度场1H-1H COSY、1H-13C HSQC和1H-13C HMBC谱,均采用标准脉冲程序.1H-1H COSY的F2(1H)和F1(1H)维谱宽均为 4 006.4 Hz,采样数据点阵t2×t1=1 024×256,累加次数为 8;NOESY的F2(1H)和F1(1H)维谱宽均为2 800 Hz,采样数据点阵t2×t1=1 024×256,累加次数为16;HSQC的F2(1H)和F1(13C)维谱宽分别为6 410 Hz和20 100 Hz,采样数据点阵t2×t1=1 024×256,累加次数为16;HMBC的F2(1H)和F1(13C)维谱宽分别为3 788 Hz和16 084 Hz,采样数据点阵t2×t1=1 024×512,累加次数为32.
2 结果与讨论
2.1 化合物2的单晶衍射数据分析
通过XRD实验进一步证实了3β,22-二羟基何伯烷(化合物2)的立体化学结构,化合物2的透视图如图3所示.该化合物的晶体学数据作为补充出版物(CCDC1868374)保存于剑桥晶体数据中心(Cambridge Crystallographic Data Centre,12 Union Road,Cambridge CB2 1EZ,UK),可以免费申请数据副本(E-mail: deposit@ccdc.cam.ac.uk).表1中列出了化合物 2的晶体数据和细节信息.XRD分析显示化合物 2的晶体为单斜晶系,空间群为C2.四个六元碳环(A、B、C、D)均为椅式构象,而五元碳环(E)中C17、C19、C20和C21形成一个平面(平均偏差为0.029 6°),为信封式构象.O1-C3和O2-C22的键长分别为1.452(5) Å和1.542(7) Å(1 Å=0.1 nm).

图3 化合物2的单晶结构Fig. 3 The single-crystal structure of compound 2

表1 化合物2的单晶数据Table 1 Crystallographic data and structure refinement details of compound 2
2.2 NMR谱图分析
2.2.1 化合物2的归属
化合物2的1H NMR(图S1,可扫描文章首页OSID码或在文章网页版查看)谱中能够直接清晰辨认的有 8个甲基和δH0.82(1H,dd,J=11.4/1.9 Hz)、δH2.24(1H,ddt,J=13.1/4.7/2.4 Hz)、δH2.42(1H,dt,J=11.9/9.0 Hz)、δH3.49(1H,dt,J=10.3/5.6 Hz)、δH4.94(1H,s)、δH5.75(1H,d,J=5.3 Hz)等六个质子.HSQC谱(图S2)显示δH4.94(1H,s)和δH5.75(1H,d,J=5.3 Hz)这两处质子为活泼氢(无相关信号),根据化学位移,结合1H-1H COSY(图S3)可归属δH3.49(1H,dt,J=10.3/5.6 Hz)为 H-3,δH5.75(1H,d,J=5.3 Hz)为 3-OH,δH4.94(1H,s)为 22-OH,结合HSQC谱归属δC78.5(叔)为C-3.13C NMR谱(图S4)中显示化合物2有30个碳原子,DEPT谱(图S5)表明化合物2有8个伯碳、10个仲碳、6个叔碳和6个季碳.HMBC(图4)谱中,H-3和δC16.8(伯)、δC29.2(伯)、δC39.9(季),3-OH和C-3、δC28.8(仲)、δC39.9(季),22-OH和δC30.3(伯)、δC31.9(伯)、δC52.0(叔)、δC72.9(季)远程偶合相关,可准确归属C2 [δC28.8(仲)]、C4 [δC39.9(季)]、C21 [δC52.0(叔)]、C22 [δC72.9(季)];借助 HSQC 谱,以及 H-3和 H-23 之间的 NOE 效应(图 S6),H-2 [δH1.89(2H,m)]、H-21 [δH2.42(1H,dt,J=11.1/9.0 Hz)]、H-23 [δH1.28(3H,s)]、H-24 [δH1.08(3H,s)]、C-23 [δC29.2(伯)]、C-24 [δC16.8(伯)]也得到准确归属.借助于HMBC谱中与C-23和C-24的远程偶合相关信号,将1H NMR谱中最高场的质子δH0.82(1H,dd,J=11.4/1.9 Hz)归属为 H-5,结合 HSQC 谱可指认出 C-5 [δC56.1(叔)].HMBC谱显示,δC16.6(伯)和H-5远程偶合相关,归属为C-25,借由HSQC谱图可知δH0.90(3H,s)为 H-25.接下来,借助于 HMBC 谱中 H-25 与 C-1 [δC39.6(仲)]、C-9 [δC51.1(叔)]、C-10 [δC37.8(季)]的远程偶合相关信号峰,可以准确归属C-1、C-9和C-10;通过HSQC谱中相关信号,可分别归属 H-1 [δH1.71(1H,dt,J=13.0/3.5 Hz)、δH0.99(1H,m)]和 H-9 [δH1.30(1H,m)].A环的所有碳原子和质子信号得到归属.
通过 HMBC 谱中 H-21 与 C-17 [δC55.1(叔)]、C-18 [δC44.8(季)]、C-20 [δC27.4(仲)]的远程偶合相关,结合HSQC谱,C-17、C-18、C-20以及H-17 [δH1.53(1H,m)]和H-20 [δH1.85(1H,m)、δH1.78(1H,m)]得到相应归属.基于HMBC谱中δH0.97(3H,s)与C-17和C-18的远程相关信号,将其归属为H-28,C-28 [δC17.0(伯)]可通过HSQC谱图准确指认.借助于HMBC谱中与 H-28 相关的 C-13 [δC50.6(叔)]和 C-19 [δC42.2(仲)],结合 HSQC 谱,可归属 C-13、C-19、H-13 [δH1.46(1H,m)]和 H-19 [δH1.62(1H,m)、δH1.03(1H,m)].E 环的所有碳原子和质子信号得到归属.
HMBC谱中,δH2.24(1H,ddt,J=13.1,4.7,2.4 Hz)与C-18和δC42.6(季)远程偶合相关,HSQC谱中,该质子和δH1.84(1H,m)与δC22.8(仲)相关,NOESY谱中,δH2.24(1H,ddt,J=13.1,4.7,2.4 Hz)与 H-29和H-30相关,归属δH2.24(1H,ddt,J=13.1/4.7/2.4 Hz)和1.84(1H,m)为 H-16,δC22.8(仲)为 C-16,δC42.6(季)为 C-14.HMBC谱中,δH1.02(3H,s)与 C-13、C-14、δC35.2(仲)和δC42.4(季)远程偶合相关,归属δH1.02(3H,s)为H-27,δC35.2(仲)为 C-15,δC42.4(季)为 C-8.结合 HSQC 谱,可准确归属 C-27 [δC17.7(伯)]、H-15 [δH1.43(1H,m)、δH1.29(1H,m)].D环归属完毕.

图4 化合物2的HMBC谱Fig. 4 HMBC spectrum of compound 2
HMBC谱中,δH1.01(3H,s)和C-8、C-9、C-14及δC34.1(仲)远程偶合相关,归属δH1.01(3H,s)为H-26,δC34.1(仲)为 C-7,结合HSQC 谱可准确归属C-26 [δC17.3(伯)]和H-7 [δH1.46(1H,m)、δH1.23(1H,m)].HMBC谱中显示H-5和C-4、C-7、C-9、C-10、C-23、C-24、C-25及δC19.3(仲)远程偶合相关,归属δC19.3(仲)为C-6,结合HSQC可归属H-6 [δH1.61(1H,m)、δH1.46(1H,m)],B环归属完毕.至此,仅余δH1.54(1H,m)、δH1.30(1H,m)、δC21.8(仲)和δH1.47(2H,m)、δC24.9(仲)未归属.借助于NOESY谱中δH1.30(1H,m)与H-25的相关信号,结合HSQC归属δH1.54(1H,m)和δH1.30(1H,m)为H-11,δC21.8(仲)为C-11,则δH1.47(2H,m)为H-12,δC24.9(仲)为C-12.至此,所有数据归属完毕. 值得注意的是,H-29和H-30均与H-16、H-21这两组质子有NOE效应,表明C21-C22键在溶液中可以自由旋转,亦即H-29和H-30的化学位移可以互换.同样由于C21-C22键可以自由旋转,亦无法通过C-H远程偶合来准确归属C-29和C-30.HMBC和NOESY谱中的主要相关信号如图5所示.
化合物2的所有1H NMR和13C NMR数据如表2所示.

图5 化合物2中主要的1H-13C远程偶合相关(→)和1H-1H NOE相关(↔)Fig. 5 Selected key 1H-13C heteronuclear multiple-bond connectivity (→) and 1H-1H NOESY correlations (↔) of compound 2

表2 化合物2的1H和13C NMR实验数据(溶剂:Pyridine-d5)和文献数据(溶剂:CDCl3)Table 2 1H and 13C NMR experimental data (Solvent: Pyridine-d5) and documentary data (Solvent: CDCl3)of compounds 2

续表2Continuation of the Table 2
2.2.2 化合物1的归属
化合物1的1H NMR谱(图S7)中能够直接辨认的信号有8个甲基,δH2.05(1H,m)、δH2.21(1H,ddt,J=12.9/4.5/2.4 Hz)、δH2.40(1H,dt,J=11.1/8.9 Hz)和δH3.65(1H,t,J=2.8 Hz),根据化学位移可归属δH3.65(1H,t,J=2.8 Hz)为H-3,但1H NMR谱中未见到3-OH和22-OH的信号,应与δH4.95处的水峰重叠导致无法辨认.13C NMR谱(图S8)显示化合物有30个碳,DEPT谱(图S9)表明化合物2有8个伯碳,10个仲碳,6个叔碳和6个季碳.1H-1H COSY谱(图S10)中,H-3和δH2.05(1H,m)、δH1.81(1H,m)偶合相关,归属δH2.05(1H,m)和δH1.81(1H,m)为H-2,结合HSQC谱(图S11)归属δH75.7(叔)和δH27.0(仲)为C-3和C-2.由HMBC谱图(图6)可知,H-3和δC23.0(伯)、δC34.3(仲)、δC49.5(叔)远程偶合相关,结合HSQC谱图,C-1[δC34.3(仲)]、C-5 [δC49.5(叔)]和H-1、H-5得到归属.在HMBC谱中,H-5与δC16.5(伯)、19.1(仲)、23.0(伯)、29.8(伯)、34.1(仲)、38.0(季)、38.5(季)、50.9(叔)远程偶合相关,δH1.25(3H,s)与δC23.0(伯)、38.5(季)、C-5、C-3远程偶合相关,δH0.94(3H,s)和δC29.8(伯)、38.5(季)、C-5、C-3远程偶合相关,H-2和δC38.0(季)远程偶合相关,NOESY谱(图S12)中,H-2和δH0.93(3H,s)、δH0.94(3H,s)有相关信号,根据上述信息,H-25 [δH0.93(3H,s)]、H-24 [δH0.94(3H,s)]、H-23 [δH1.25(3H,s)]、C-25 [δC16.5(伯)]、C-24 [δC23.0(伯)]、C-23 [δC29.8(伯)]、C-10 [δC38.0(季)]、C-4[δC38.5(季)]、C-9 [δC50.9(叔)]得到准确归属,结合HSQC可准确归属H-9 [δH1.47(1H,m)].至此,A环的所有碳原子和质子信号归属完毕.

图6 化合物1的HMBC谱Fig. 6 HMBC spectrum of compound 1
13C NMR谱中,C-3和δC72.7(季)处于最低场,归属δC72.7(季)为C-22.HMBC谱中,δH2.40(1H,dt,J=11.1/8.9 Hz)与C-22远程偶合相关,结合HSQC谱,可将δH2.40(1H,dt,J=11.1/8.9 Hz)和δC52.0(叔)归属为H-21和C-21.而借助于H-21和δC27.4(仲)、δC44.8(季)、δC55.1(叔)在HMBC谱中的远程偶合相关信号,H-21与δH1.53(1H,m)、δH1.69-1.89(2H,m)在1H-1H COSY谱中的偶合相关信号,以及HSQC谱图,可归属C-17 [δC55.1(叔)]、C-18 [δC44.8(季)]、C-20[δC27.4(仲)]、H-17 [δH1.53(1H,m)]和 H-20 [δH1.83(1H,m),δH1.78(1H,m)].此外,HMBC谱显示,H-21还与δC30.3(伯)和δC31.9(伯)远程偶合相关,结合HSQC,可归属H-29 [δH1.38(3H,s)]、H-30 [δH1.43(3H,s)]、C-29 [δC30.3(伯)]和 C-30 [δC31.9(伯)].但由于 C21-C22 可以自由旋转,借助于HMBC或者NOESY谱图(图S12)均无法确定H-29(C-29)和H-30(C-30)的准确位移,亦即这两组数据可以互换.基于HMBC谱中δH0.93(3H,s)与C-17和C-18的远程相关信号,将其归属为甲基质子H-28,结合HSQC谱图,可指认C-28 [δC16.9(伯)].H-28和δC50.6(叔)、δC42.2(仲)在HMBC谱中远程偶合相关,结合HSQC谱图,可准确归属 C-13 [δC50.6(叔)]、C-19[δC42.2(仲)]、H-13 [δH1.44(1H,m)]和 H-19 [δH1.60(1H,m)和δH1.00(1H,m)].E环的所有质子和碳原子信号得到归属.
HMBC 谱中,δH2.21(1H,ddt,J=12.9/4.5/2.4 Hz)与 C-18、δC35.1(仲)、δC42.6(季)远程偶合相关,HSQC谱中,该质子和δH1.80(1H,m)与δC22.7(仲)相关,NOESY谱中,δH2.21(1H,ddt,J=12.9/4.5/2.4 Hz)与H-29和 H-30相关,归属δH2.21(1H,ddt,J=12.9/4.5/2.4 Hz)和 1.80(1H,m)为 H-16,δC22.7(仲)为 C-16,δC35.1(仲)为 C-15,δC42.6(季)为 C-14.HMBC谱中,δH0.90(3H,s)与C-13、C-14、C-15远程偶合相关,归属δH0.90(3H,s)为H-27.结合HSQC谱,可准确归属C-27、H-15.D环归属完毕.
HMBC谱中,δH1.03(3H,s)与C-9、C-14、δC34.1(仲)、δC42.6(季)远程偶合相关,H-5与δC19.1(仲)、δC34.0(仲)远程偶合相关,归属δH1.03(3H,s)为H-26,δC19.1(仲)为C-6,δC34.1(仲)为C-7,δC42.6(季)为C-8.结合HSQC谱可归属C-26、H-6和H-7.值得注意的是,C-8和C-14相差仅0.02 ppm,利用HMBC谱中H-16和C-14的远程偶合相关信号可确认C-14位于较低场.B环归属完毕.此时仅余H-11(C-11)和H-12(C-12)未归属,但由于结构中没有仅与C-11或者C-12远程相关的质子,NOESY谱中这两组质子未见与H-25、H-26、H-27、H-28的相关信号,无法准确归属,借助于化合物2中H-11(C-11)和H-12(C-12)的位移,归属δH1.62(1H,m)和δH1.35(1H,m)为H-11,δH1.44(2H,m)为H-12,δC21.7(仲)为C-11,δC24.9(仲)为C-12.所有信号归属完毕.HMBC和NOESY谱中主要相关信号如图7所示.
化合物1的所有1H NMR和13C NMR数据如表3所示.
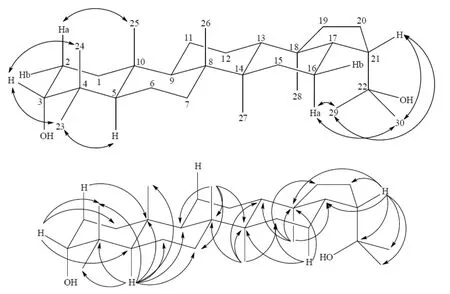
图7 化合物1中主要的1H-13C远程偶合相关(→)和1H-1H NOE相关(↔)Fig. 7 Selected key 1H-13C heteronuclear multiple-bond connectivity (→) and 1H-1H NOESY correlations (↔) of compound 1

表3 化合物1的1H和13C NMR实验数据(溶剂:Pyridine-d5)和文献数据(溶剂:CDCl3)Table 3 1H and 13C NMR experimental data (Solvent: Pyridine-d5) and documentary data (Solvent: CDCl3)of compounds 1
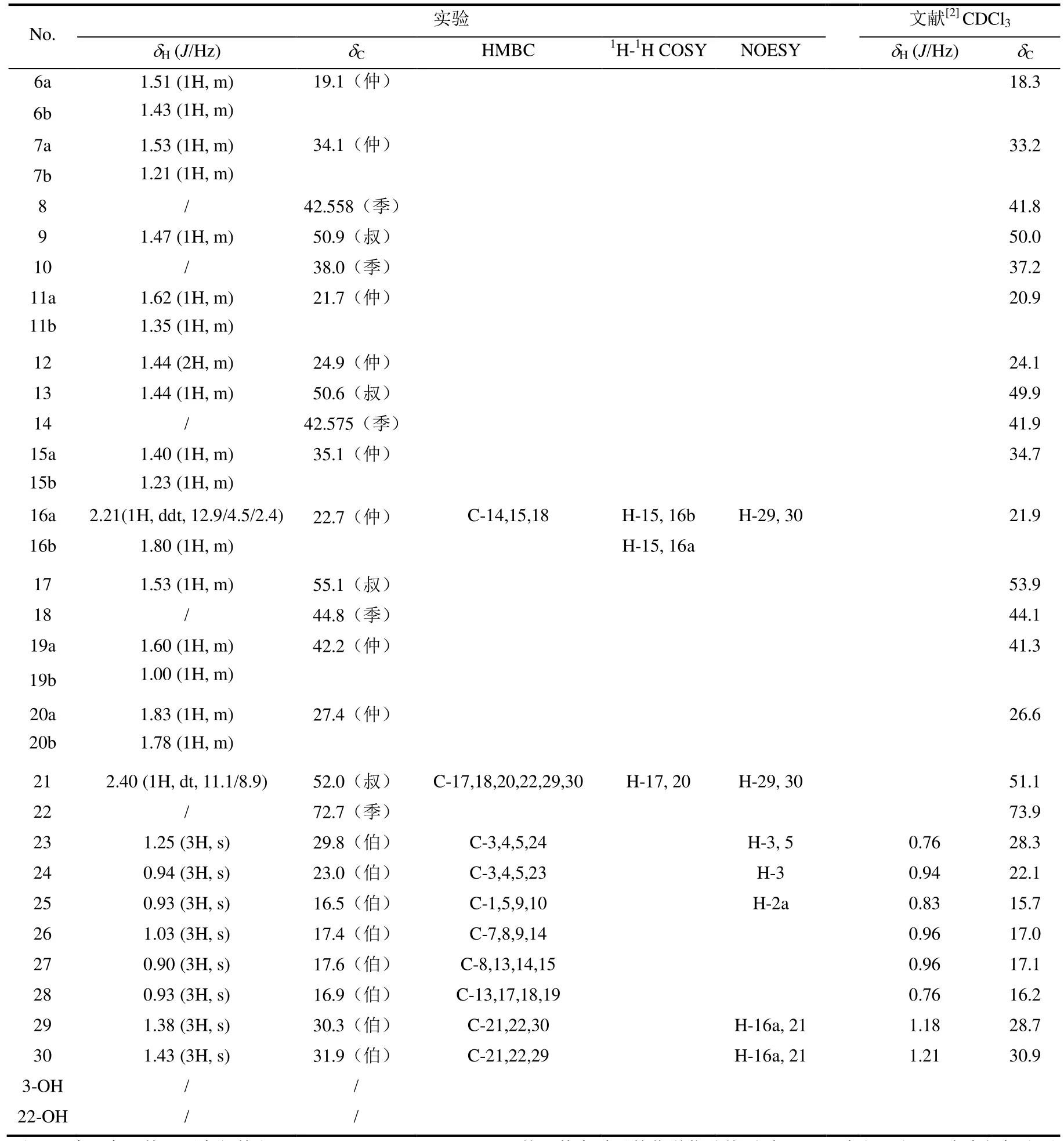
续表3Continuation of the Table 3
2.3 化合物1和化合物2的差异
何伯烷类化合物是重要的五环三萜,但对于其中的 3α,22-二羟基何伯烷(化合物 1)和 3β,22-二羟基何伯烷(化合物2),文献[2,3]仅报道了这两个化合物的部分NMR数据.化合物1和2的1H NMR和13C NMR的完整归属,对何伯烷类化合物的结构确认具有重要的参考意义.
从归属结果可以看出,相较于β-异构体(2),α-异构体(1)的H-3与H-2之间的偶合常数更小,且位于较低场,与文献[5,8]所述相符.NOESY实验表明,α-异构体(1)的H-3与H-23和H-24这两个甲基质子之间均有NOE效应,而β-异构体(2)的H-3仅与H-23有NOE效应,并且与H-5有NOE效应[11].除了H-3的化学位移和偶合常数外,化合物1和2这两种异构体的H-1、H-5和H-24的化学位移差异较其他质子更大,H-5和H-24可以作为鉴别两种异构体的特征信号.此外,两种异构体的C-1、C-5以及C-24的化学位移也存在较大差异.
通过对比发现,本文中归属的NMR数据与文献中数据存在一些出入,一部分可能是由于溶剂不同造成的:文献[2,3]使用溶剂为CDCl3,文献[8]使用溶剂为C6D6,本文选择C5D5N作为溶剂.此外,文献[8]归属δC18.73为3β-羟基何伯烯的C-5和C-7,而本文将δC56.1和δC34.1分别归属为化合物2的C-5和C-7,这可能是由于文献[8]的归属错误造成的.
化合物1和化合物2构型不同除了影响氢核和碳核的化学位移之外,两者的1H-13C远程偶合相关也有差别.最明显的是化合物1的H-3和C-1、C-5、C-24远程偶合相关,而化合物2的H-3与C-4、C-23、C-24远程偶合相关.HMBC谱中氢核和碳核的多键偶合常数(nJH,C)通常选择8 Hz,这个数值能够满足绝大部分的两键(2JH,C)或者三键(3JH,C)的碳氢偶合常数.而化合物1和化合物2的H-3所处位置不同,导致与H-3的偶合常数为8 Hz(nJH,C=8 Hz)的碳原子也不相同.
3 结论
本文通过XRD实验确定了3β,22-二羟基何伯烷(2)的绝对构型,在此基础上,完整归属和确认了3α,22-二羟基何伯烷(1)和3β,22-二羟基何伯烷(2)的1H和13C NMR数据.此外,通过保护羟基来分离单一构型的化合物1和化合物2这两种异构体的方法也同样适用于其他各种难以分离的α-和β-异构体.
致谢
感谢河南城建学院胡继勇教授提供单晶测试和解析帮助.
利益冲突
无
附件材料
图S1 化合物2的1H NMR (a)全谱和(b)局部放大谱图.
图S2 化合物2的HSQC谱图.
图S3 化合物2的COSY谱图.
图S4 化合物2的13C NMR (a)全谱和(b)局部放大谱图.
图S5 化合物2的DEPT谱图.
图S6 化合物2的NOESY谱图.
图S7 化合物1的1H NMR (a)全谱和(b)局部放大谱图.
图S8 化合物1的13C NMR (a)全谱和(b)局部放大谱图.
图S9 化合物1的DEPT谱图.
图S10 化合物1的COSY谱图.
图S11 化合物1的HSQC谱图.
图S12 化合物1的NOESY谱图.
