NOD2基因在巨噬细胞抗结核分枝杆菌中的作用
2021-06-08朱莉萍贾春敏陈南山
朱莉萍,贾春敏,陈南山
(1.武汉市金银潭医院 ICU,武汉 430040;2.武汉市金银潭医院 内科,武汉 430040;3.武汉市金银潭医院 结核科,武汉 430040)
结核分枝杆菌是结核病的致病菌,人体感染结核分枝杆菌后,大多数感染者处于潜伏状态,约有5%的感染者出现临床症状,这种差异主要是由宿主的免疫力不同引起的[1]。当结核分枝杆菌经呼吸道进入肺组织时,肺泡中的巨噬细胞将通过吞噬作用控制或消除结核分枝杆菌的感染[2]。巨噬细胞表达的PRR在上述过程中具有重要作用,如细胞表面的TLR和细胞内的核苷酸结合寡聚化结构域样受体(nucleotide binding oligomerization domain-like receptor,NLR)[3-4]。核苷酸结合寡聚化结构域2(nucleotide binding oligomerization domain 2,NOD2)是NLR家族的成员。研究发现,NOD2可通过诱导一氧化氮和抗菌肽防御素4B的分泌参与人肺泡巨噬细胞抗结核分枝杆菌感染的免疫过程[5]。鉴于炎症反应[6]和自噬[7]在巨噬细胞的免疫过程中具有重要作用,本研究利用人巨噬细胞U937对结核分枝杆菌的吞噬能力,试从炎症反应、自噬角度分析NOD2基因在巨噬细胞抗结核分枝杆菌免疫反应中的作用。
1 材料与方法
1.1 样本来源及分组人巨噬细胞U937购自上海子实生物科技有限公司,结核分枝杆菌购自上海恒斐生物科技有限公司。以受结核分枝杆菌感染的U937细胞为感染组, 以未经结核分枝杆菌感染的U937细胞为对照组。
1.2 试剂与仪器Lipofectamine 3000转染试剂盒购自Invitrogen公司,反转录试剂盒购自GeneCopoeia公司,引物由苏州泓迅生物科技股份有限公司合成,ELISA试剂盒购自南京森贝伽生物科技有限公司,蛋白一抗IL-6兔多克隆抗体、IL-8兔多克隆抗体、TNF-α抗体购自Proteintech公司。细胞培养箱购自上海玉研科学仪器有限公司,酶标仪、qRT-PCR仪购自BIORAD公司,全自动凝胶成像仪购自北京大龙兴创实验仪器有限公司,超净工作台购自江苏苏净集团,高压灭菌锅购自江阴滨江医疗设备有限公司,水浴锅购自上海一恒科学仪器有限公司,离心机购自SCILOGEX有限公司,移液枪购自Eppendorf公司,培养皿、无菌离心管、24孔板、96孔板购自Corning公司。
1.3 方法
1.3.1 细胞培养 从液氮罐中取出U937细胞,置37 ℃水浴中快速解冻。低速离心后弃上清液,加入培养液吹打细胞,混匀后将其培养于37 ℃、5%CO2培养箱中。当细胞密度过大时,吸出细胞液于离心管中,低速离心后弃上清液,加入新的培养液适度稀释细胞,再将其转移至新的培养瓶中培养。收集对数生长期细胞,低速离心后弃上清液,将细胞重悬于细胞冻存液中,放入细胞冻存盒,于-80 ℃冰箱放置过夜,次日移入液氮罐中保存。
1.3.2 细胞转染 根据参考文献[8]合成NOD2 siRNA引物序列。将U937细胞以2×106个/mL密度接种于96孔板,参照Lipofectamine 3000转染试剂盒说明书中的步骤进行操作。每组设置5个复孔,将NOD2 siRNA和无序序列(NC)转染至U937细胞,继续培养4 h,再用无血清培养液洗涤细胞,加入培养液,置于37 ℃、5%CO2培养箱中培养。
1.3.3 内吞细菌试验 采用平板划线法得到结核分枝杆菌单个菌落,将结核分枝杆菌和转染的细胞重悬于培养液中,调整细菌密度(650 nm波长处的光密度约为0.6)。将处于对数生长期的U937细胞接种于24孔板(1×105个/孔),培养24 h,再更换为不含抗生素的培养液继续培养30 min。将细菌以10∶1的比例与U937细胞混合,置37 ℃、5%CO2培养箱中培养30 min。用预冷缓冲液冲洗细胞外细菌,并加入含有庆大霉素的培养液,杀死残留在细胞膜上的细菌。
1.3.4 菌落计数 收集内吞结核分枝杆菌的U937细胞,低速离心后弃上清液,裂解细胞,均匀涂板,于37 ℃培养12~24 h,观察菌落生长情况并计数。计算U937细胞对结核分枝杆菌的杀伤率:48 h时的杀伤率为(lgN24 h-lgN48 h)/lgN24 h×100%,72 h时的杀伤率为(lgN24 h-lgN72 h)/lgN24 h×100%,N为平均菌落数。
1.3.5 U937细胞中NOD2 mRNA表达的qRT-PCR检测 收集内吞结核分枝杆菌的U937细胞,完全裂解细胞后,以氯仿-异丙醇体系提取细胞中总RNA,经反转录扩增合成cDNA,混入SYBR GREEN Mix进行qRT-PCR。根据参考文献[9]设计NOD2和GADPH的引物序列(表1)。参数设置:94 ℃预变性3 min;94 ℃变性20 s、55 ℃退火20 s、72 ℃延伸1 min,共30个循环。采用2-ΔΔCt法,以GADPH的表达为内参,计算NOD2 mRNA的相对表达量。

表1 qRT-PCR引物
1.3.6 细胞上清液中细胞因子水平的ELISA检测 收集内吞结核分枝杆菌的U937细胞上清液,根据ELISA试剂盒说明书中的步骤进行操作,检测细胞上清液中IL-6、IL-8及TNF-α的水平。
1.3.7 细胞中相关蛋白表达的Western blotting检测 收集内吞结核分枝杆菌的U937细胞,充分裂解后以12 000×g离心10 min,取上清蛋白液。检测蛋白浓度后取70 μg蛋白混入蛋白上样缓冲液,置于100 ℃水浴变性10 min。配制10%浓缩胶和5%分离胶,进行电泳。待蛋白完全分离后在冰上湿转至PVDF膜。取出PVDF膜, 将其浸于5%脱脂牛奶中,室温下孵育2 h,封闭非特异性位点。洗膜3次,置于相应的蛋白一抗中,4 ℃孵育过夜。洗膜3次,浸于蛋白二抗中,37 ℃反应40 min。洗膜3次,添加化学发光剂,应用全自动凝胶成像仪显示蛋白条带。以β-actin的表达为内参,计算细胞中p62和微管相关蛋白轻链3(microtubule-associated protein light chain 3, LC3)的表达水平。

2 结果
2.1 各组细胞内NOD2mRNA表达水平的比较采用qRT-PCR检测各组细胞中NOD2 mRNA的表达。结果显示,与对照组比较,感染组U937细胞中NOD2 mRNA的表达水平显著上升(P<0.05);与NC组比较,NOD2 siRNA组U937细胞中NOD2 mRNA的表达水平显著下降(P<0.05)。(图1)

注:与对照组比较,*P<0.05;与NC组比较,#P<0.05。图1 各组细胞内NOD2 mRNA表达水平的比较
2.2 NOD2对U937细胞吞噬能力的影响于吞噬24、48及72 h时收集细胞,检测U937细胞中的结核分枝杆菌密度。与NC组比较,不同时间点NOD2 siRNA组U937细胞中的结核分枝杆菌密度明显降低(P<0.05, 图2);吞噬48及72 h,NC组U937细胞对结核分枝杆菌的杀伤率分别为(38.41±5.69)%和(61.16±8.23)%,NOD2 siRNA组U937细胞对结核分枝杆菌的杀伤率分别为(36.98±5.27)%和(57.28±7.49)%,2组差异均无统计学意义(均P>0.05)。

注:与NC组比较,*P<0.05。图2 NOD2对U937细胞吞噬能力的影响
2.3 NOD2对U937细胞上清液中细胞因子水平的影响与对照组比较,感染组上清液中IL-6、IL-8及TNF-α水平显著上升(P<0.05);与NC组比较,NOD2 siRNA组上清液中IL-6、IL-8及TNF-α水平显著下降(P<0.05)。(图3)

注:A.IL-6表达量;B.IL-8表达量;C.TNF-α表达量。与对照组比较,*P<0.05;与NC组比较,#P<0.05。图3 NOD2对U937细胞上清液中细胞因子水平的影响
2.4 NOD2对U937细胞自噬的影响与对照组比较,感染组U937细胞中p62、LC3Ⅰ/LC3Ⅱ水平显著上升(P<0.05);而NC组与NOD2siRNA组U937细胞中p62、LC3Ⅰ/LC3Ⅱ水平比较, 差异无统计学意义(P>0.05)。(图4)
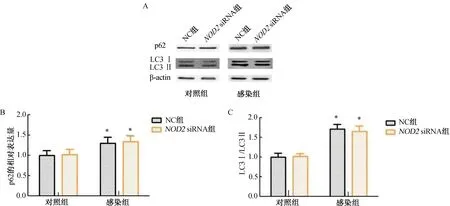
注:A.p62、LC3Ⅰ/LC3Ⅱ蛋白条带图;B.p62的相对表达量;C.LC3Ⅰ/LC3Ⅱ水平。与对照组比较,*P<0.05。图4 NOD2对U937细胞自噬的影响
3 讨论
巨噬细胞是固有免疫系统的重要组成部分,主要分布于肺泡上皮细胞表面,可通过自身的PRR对入侵的细菌产生免疫反应[10]。研究发现,结核分枝杆菌进入人体后,会被巨噬细胞吞噬,巨噬细胞同时募集多种免疫细胞,形成结核性肉芽肿组织;若肉芽肿组织无法控制病原菌的复制,会形成干酪样坏死结构,并释放被包裹着的病原菌,最终发展成结核病[11]。肉芽肿组织在结核病的发生、发展中具有双重作用:一方面,肉芽肿组织可在一定程度上限制病原菌的复制、扩散;另一方面,肉芽肿组织也有“屏蔽”其他免疫细胞及外源性药物的作用[12]。而巨噬细胞不仅是结核分枝杆菌主要的效应细胞,也是其主要的寄生场所。Gordon等[13]研究发现,巨噬细胞功能与结核性肉芽肿组织的形成、转归密切相关。本研究发现,巨噬细胞U937感染结核分枝杆菌后,细胞中NOD2 mRNA的表达水平显著上调,提示NOD2可能参与了U937细胞对结核分枝杆菌的免疫反应,这与Landes等[14]的研究结果相符。
为进一步探究NOD2在巨噬细胞吞噬结核分枝杆菌中的作用,本研究将NOD2 siRNA转染U937细胞。结果显示,沉默NOD2后U937细胞中NOD2 mRNA的表达水平显著下降,这提示U937细胞中NOD2基因干扰成功。巨噬细胞抵抗病原菌感染时会分泌多种细胞因子,如IL-6、IL-8及TNF-α等,其中IL-6和TNF-α具有促炎作用,而IL-8属于趋化因子,可促进巨噬细胞的聚集[15]。本研究结果显示,沉默NOD2基因后U937细胞对结核分枝杆菌的吞噬能力及细胞上清液中IL-6、IL-8、TNF-α的表达水平显著下降,但其杀伤能力并无变化。这可能是因为敲低NOD2的表达后,U937细胞的吞噬数量减少,使其效应炎症反应强度减弱,不利于巨噬细胞杀伤结核分枝杆菌,这也再次验证了NOD2基因可影响巨噬细胞抗结核分枝杆菌的免疫反应,这一效应可能与其介导炎症反应有关。
自噬是机体高度保守且受精密调控的过程,对于细胞稳态、生长分化等有重要作用。有效的自噬对巨噬细胞清除结核分枝杆菌至关重要。研究发现,结核分枝杆菌感染后会阻碍自噬体的融合与成熟,从而抑制细胞自噬[16]。LC3和p62在自噬体的形成过程中有重要作用。本研究发现,巨噬细胞感染结核分枝杆菌后,细胞中p62、LC3Ⅰ/LC3Ⅱ水平显著上调,这提示结核分枝杆菌感染会降低巨噬细胞的自噬水平。但沉默NOD2后,细胞中p62、LC3Ⅰ/LC3Ⅱ水平无明显变化,这提示NOD2在自噬过程中可能不发挥主要作用。
综上所述,巨噬细胞感染结核分枝杆菌后,细胞中NOD2 mRNA的表达水平异常升高,而沉默NOD2 后巨噬细胞吞噬结核分枝杆菌的能力下降,这表明NOD2基因可能参与巨噬细胞抗结核分枝杆菌的免疫过程,可能与诱导IL-6、IL-8及TNF-α的分泌有关。但人体免疫系统是一个复杂且精密的系统,NOD2在抗结核分枝杆菌感染中的免疫作用尚需利用动物模型进一步验证。
