人乳牙牙髓干细胞治疗肝硬化小鼠模型的研究
2021-06-08陆观珠包玉洁白玉盘焉雷许洁
陆观珠 包玉洁 白玉盘 焉雷 许洁
肝移植是治疗终末期肝病的有效方法,但是由于供肝缺乏,治疗费用昂贵,且患者需要终生服用抗免疫排斥药物,临床应用受到限制,因此寻求和探索一种新的肝硬化治疗技术成为临床与转化医学的重要研究热点之一。人乳牙牙髓干细胞(stem cells from human exfoliated deciduous teeth,SHED)具有易获得,低免疫原性和高分化潜能的优点。本研究通过建立小鼠肝硬化模型及SHED治疗肝硬化模型,检测小鼠肝功能、体重、肝脏湿重以及肝脏组织病理学表现,在动物体内初步验证SHED对延缓或逆转肝硬化/肝纤维化的安全性及有效性。
材料与方法
一、实验材料
BABL/c小鼠,雄性,6周龄,体质量为(16±1)g,SPF级。实验涉及的所有动物处理内容均遵从实验动物实验管理和动物福利相关条例和法规,实验设计经过伦理委员会批准并由其监督支持。
实验用SHED在GMP条件下培养,细胞采用0.9% NaCl溶液进行重悬,由卡替(上海)生物技术有限公司提供。
二、小鼠肝硬化模型及干细胞治疗模型建立
15只小鼠饲养于没有病原菌的环境下,在整个实验过程中有充足的水分和食物。将15只小鼠随机分为A、B、C组,每组5只。肝硬化模型的建立:将A组和B组小鼠腹腔注射10% CCl4(4 μL/g),2次/周,C组腹腔注射0.9% NaCl溶液(4 μL/g),2次/周。每2周称量记录小鼠体重1次。在肝硬化模型建立的第4周,A组和C组小鼠予尾静脉注射0.9% NaCl 200 μL,1周1次;同时将1×106SHED悬浮于200 μL 0.9% NaCl溶液中,混匀,经尾静脉注射入B组小鼠,每周注射1次,共4周。在第9周时行乙醚麻醉,各组随机取3只小鼠眼眶取血,离心分离血清,应用小鼠肝功能试剂盒检测肝功能指标。安乐处死小鼠,所有小鼠各取1 cm×1 cm的肝脏组织,4%甲醛固定,进行组织病理学检查。
三、统计学处理
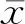
结 果
一、造模9周后3组小鼠肝功能比较
结果显示:A组和B组小鼠的肝功能各项指标均较C组小鼠显著增高。进一步比较B组与A组的肝功能情况,发现B组肝硬化小鼠的肝功能指标均较A组有显著的好转(表1)。由此可见,经尾静脉注射SHED能够明显改善肝硬化小鼠的肝功能,对肝细胞具有一定的修复作用。
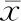
表1 3组小鼠造模9周后的生化指标比较(±s)
二、3组小鼠体质量和肝脏湿重比较
记录3组小鼠的生长曲线发现:A组和B组小鼠的体质量增长较C组小鼠严重滞后(P<0.01),而B组小鼠较A组的体质量增长有所恢复(P<0.01)。第9周处死各组小鼠后,解剖肝脏,肉眼可见C组小鼠的肝脏色泽红润,表面光滑,肝叶边缘锐利,质地柔软。经CCl4造模的小鼠肝脏色泽晦暗,表面粗糙,可见大小不等结节,肝叶边缘粗钝,提示CCl4腹腔注射4周成功建立肝硬化模型。处死时各组小鼠的体重和肝脏湿重均有显著差异:A组的小鼠体质量(22.86±0.97)g及肝脏湿重 (1.88±0.148)g低于C组的小鼠体质量(27.54±1.71)g及肝脏湿重(2.38±0.13)g,差异均有统计学意义(t=5.661、5329,均P<0.01);而B组的小鼠体质量 (25.80±1.02)g及肝脏湿重 (2.16±0.114)g较A组显著增加,差异有统计学意义(t=3.347、4.668,P<0.01)。
三、3组小鼠肝组织光学显微镜下表现
第9周处死小鼠后解剖肝脏组织显示,C组小鼠肝脏切片HE染色可见肝小叶结构清晰,肝窦无扩张,肝细胞索规则,肝细胞形态正常(图1A);A组小鼠的肝脏失去肝小叶正常结构,有多个大小不等的假小叶形成,肝窦扩张,肝细胞索排列紊乱,部分细胞变性、坏死,可见较多炎性细胞浸润(图1B);B组小鼠肝脏病理可见假小叶数量较A组减少,肝细胞排列紊乱明显好转,组织结构有所恢复,且肝细胞变性、坏死有所减轻,炎症细胞浸润明显减少(图1C)。由此可见,SHED可部分缓解肝硬化小鼠的肝脏纤维化程度,同时减轻汇管区的炎症反应。
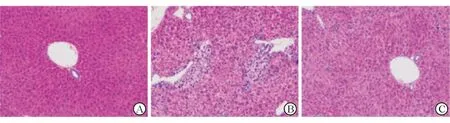
A.C组小鼠肝脏;B.A组小鼠的肝脏病理学表现;C.B组小鼠的肝脏病理学表现图1 3组小鼠肝组织光学显微镜下表现(HE,低倍放大)
讨 论
既往基础研究与临床试验已证实,间充质干细胞(mesenchymal stem cells,MSC)能够有效治疗肝硬化[1]。健康雄性大鼠MSC可以植入肝脏汇管区、肝细胞索,植入细胞最早见于移植后约7 d,植入的MSC能够部分代替肝细胞的功能。张卫光等[2]将人胚胎脐带血分离的MSC植入肝硬化的大鼠体内,发现移植大鼠的体质量明显增加,肝纤维化的程度显著减轻。
牙髓是牙体组织的一部分,含有结缔组织、间充质细胞、神经纤维、血管和淋巴等。人牙髓干细胞(human dental pulp stem cells,hDPSC)是一类存在于人牙髓组织(乳牙、恒牙)中具有较强的自我更新和多向分化潜能的间充质干细胞[3]。Gronthos等[4]收集了19~29岁患者的第三磨牙,取出牙髓组织,用酶消化法得到单细胞悬液进行培养后发现细胞可以自我增殖,其免疫表型与骨髓间充质干细胞(bone marrow stromal stem cells,BMSC)相似,在体外一定条件下可形成矿化结节;将细胞植于免疫缺陷的小鼠体内,有牙本质样组织形成,证明其可分化为类成牙本质细胞。牙髓间充质干细胞是牙髓未分化的外胚间充质细胞,具有高度增殖和克隆能力,在不同诱导剂的作用下,可分化为成牙本质细胞、脂肪细胞和神经样细胞等多种细胞[5]。Chen等[6]证明,从冷冻保存牙髓组织中提取的间充质干细胞不仅有向肝细胞样分化的性能,而且分化后的细胞具有正常的核型,其功能接近正常肝细胞。本研究采用SHED治疗肝硬化小鼠模型。SHED是起源于神经嵴外胚层的多能造血干细胞,是成体干细胞家族的重要成员之一,不仅能分化为典型的中胚层细胞系,如成骨、软骨等,也能分化为外胚层和内胚层细胞系,如肝细胞、胰岛素样细胞等[7]。
SHED较MSC具有更高的增殖活性和端粒酶活性,以及较低的免疫原性、致瘤性、凋亡性和衰老性,在第10代仍可保持其梭形细胞形态,可用于自体干细胞库的构建[8-10]。除此以外,SHED具有介导免疫调节的功能[16],在细胞免疫及治疗炎症相关疾病方面有意义[11]。
本研究显示,经尾静脉注射SHED治疗的肝硬化小鼠的体质量增长,肝脏湿重均较未治疗组肝硬化小鼠有所恢复;同时,血清肝功能指标及肝脏的纤维化程度及炎症浸润程度均有所改善,在动物实验中验证了SHED对肝硬化具有一定的治疗作用,能够起到修复肝细胞的作用,减轻肝细胞的炎症反应,并能进一步逆转肝硬化小鼠的肝脏纤维化及炎症程度。与此同时,本研究在小鼠体内验证了SHED的安全性。
结合既往的SHED相关研究[12],归纳了SHED移植疗法存在以下优点:①与原位移植治疗相比,不受供体肝源短缺的限制,且免疫原性低,可有效避免免疫排斥反应和免疫抑制剂的使用;②SHED来源丰富,可通过无创技术便捷取材;③治疗效果明显,可显著改善肝功能、肝脏纤维化程度;④治疗过程操作简便,创伤小,患者能耐受治疗过程。
对于SHED治疗肝硬化的分子作用机制,仍需要进一步验证。既往的机制研究包括:①SHED可分化为肝细胞样细胞[13],在肝脏损伤微环境的影响下,SHED在损伤部位进行定植、增殖,并分化成为肝细胞样细胞发挥作用,参与肝脏新生组织的形成;②SHED具备强大的分泌功能,可分泌细胞外基质的有效成分及多种营养因子[14],从而形成利于组织再生以及微环境的修复;③在肝损伤环境中SHED分泌不同水平的细胞因子,可能激活肝脏干细胞,促进肝细胞再生;④SHED通过高表达基质金属蛋白酶降解肝内过量沉积的ECM,减轻肝纤维化,激活肝内残存肝细胞、Kupffer细胞,在一定程度上启动内源性肝细胞增殖过程和Kupffer细胞分泌MMP降解ECM等[15];⑤SHED具有免疫调节功能,可使小胶质细胞及巨噬细胞的表型由促炎性M1型转变成抗炎性M2型,抑制CD4+T淋巴细胞增殖及其促炎症细胞因子的释放[16],从而改善肝脏的炎性病变。
本研究初步评估SHED治疗小鼠肝硬化模型的安全性及有效性,为今后进一步开展床牙髓干细胞治疗肝硬化患者的临床试验提供可靠的动物实验依据。
