小儿肝移植术后肠梗阻病因鉴别及预后分析
2021-06-08单禹华陈其民严志龙
单禹华 顾 松 徐 敏 褚 珺 胡 明 陈 盛 陈其民 严志龙
近年来,随着活体肝移植技术的不断成熟,我国儿童肝移植得到了蓬勃发展,儿科医生在日常诊治工作中接诊肝移植术后患者的机会也随之增多。既往研究表明,儿童肝移植的5年生存率可达85%~95%,其中80%的术后死亡发生在手术后1年内[1,2]。因此,及时识别并处理肝移植术后早期并发症对于提高患者术后生存率有重要意义。常见的肝移植术后并发症包括出血、血管并发症、胆道并发症、排异反应、原发性移植物无功能以及感染等。肠梗阻作为肝移植术后的罕见并发症,发生率仅占所有并发症的1.2%,却是极其凶险的术后急症之一[3]。由于婴幼儿表达能力欠缺,肝移植术后移植物体积偏大和术后肠蠕动恢复缓慢易造成腹胀和腹围偏大;该情况往往表现不典型,容易与肠内感染、消化不良、乳糜性或其他漏出性腹水引起的腹胀等良性情况相混淆,加上目前儿童肝移植基本上由综合性医院的肝胆外科医生完成,术者并非专业小儿外科医生,故对一些术后相关并发症易误判,增加了鉴别诊断的难度。
一般腹腔手术后肠梗阻最常见的原因是肠粘连[4]。根据成人肝移植文献报道,肝移植术后肠梗阻的主要原因是肠粘连和内疝[3]。但对于小儿肝移植来说,其术后并发症与成人肝移植有着较大区别,对小儿肝移植术后肠梗阻的认知不能照搬成人的经验。然而,据文献报道小儿肝移植因为腹部并发症进行二次手术的比例高达9%,但绝大多数文献报道集中于血管和胆道的并发症[5]。2011年,Earl等[6]报道了7例小儿肝移植术后肠梗阻的临床总结,发现肠梗阻是由移植后淋巴增生异常(posttransplant lymphoproliferative disorder,PTLD)(n=3)和移植后膈疝(n=4)引起的。因此本研究提出假设,在成人肝移植术后罕见的肠梗阻,或许在儿童肝移植领域是非常常见的。但受限于样本量较小的原因,这一假设尚未得到进一步的论证。国内外尚缺乏有关分析小儿肝移植术后引起肠梗阻病因的研究。
本研究回顾性总结5年来上海交通大学医学院附属上海儿童医学中心在处理儿童肝移植术后肠梗阻的经验,旨在分析小儿肝移植术后肠梗阻的病因,总结病因预判的要素。
材料与方法
一、临床资料
本研究回顾性分析了2013年1月至2018年12月由上海交通大学医学院附属上海儿童医学中心接诊的286例儿童肝移植术后患者资料,其中30例(男15例、女15例)符合肠梗阻诊断标准,具体为:保守治疗(包括禁食禁水、胃肠减压、抗感染、通便等)24 h仍无缓解甚至腹胀加重,肛门排气、排便明显减少,腹部X线立位片看到阶梯状气液平面。本研究收集了肝移植术后肠梗阻患者的基本信息及临床资料,包括年龄、性别、手术年龄、原发病、移植物类型、移植物存活情况、生存情况、入院后治疗及检查措施、术后病理检查结果等。30例中男女比例为1∶1,3例原发病为家族性胆汁淤积,27例为胆道闭锁,其中15例有Kasai手术史,接受Kasai手术比例为55.56%。接受肝移植的中位年龄7.55个月,最小者4.46 个月,最大者35.0 个月。平均起病时间为肝移植术后(4.77±7.71)个月。
二、肠梗阻处理方法
一旦诊断为肠梗阻,立即予以禁食、胃肠减压、补液支持、开塞露通便、广谱抗生素抗炎等保守治疗,并积极行血培养、粪便培养、腹水培养等检查寻找感染源证据,对于肝功能无明显异常的患者选择全肠外营养支持治疗。
完善血尿常规、肝肾功能、电解质、凝血功能、血型、输血前检查等常规实验室检查,并常规拍摄胸部X线平片,行肝血管B超检查。每6 h复查腹部立位X线平片一次,对于高度怀疑腹腔内出现病变的患者行腹部B超、CT检查。
对于临床症状加重(腹胀持续加重,呕吐物性状为胆汁样甚至粪汁样,出现明显腹痛)、临床体征加剧(出现腹膜刺激征、引流液或腹腔穿刺物为血性、脓性、粪汁样、胆汁样改变、出现轻度休克症状)或保守观察72 h临床症状无明显好转或腹部立位X线平片连续3次提示固定宽大的肠袢气液平,或者影像学检查发现膈疝或穿孔的患者,则与家属沟通后,行急诊手术探查。术中切除的标本一律送病理检查。常规留置盆腔引流管(膈疝需根据具体情况具体分析)。术后禁食,行全肠外营养支持治疗,一般7 d后逐渐恢复饮食。
三、统计学方法
结 果
一、肠梗阻患者基本情况及原因
30例中位随访时间1.02年(范围1 d至6.22年),其中8例因PTLD致肠梗阻,6例接受手术探查,2例为空肠吻合口附近肠壁内局限性肿物,2例为回盲部肿物,1例为回肠系膜淋巴结广泛病变;另外2例在高度怀疑PTLD的情况下通过PET-CT诊断,1例为回盲部肿物,1例为十二指肠空肠起始部肿物;PTLD中位随访时间为7.51个月(范围为18 d至6.22年);治疗后病情不能控制引起死亡4例。5例医源性胃肠道穿孔致肠梗阻,其中2例术后24 h内紧急转至我中心;穿孔部位包括:横结肠(2例);吻合袢胆支(1例);空肠吻合口(1例);空回交界处(2例)。5例医源性胃肠道穿孔患者中4例接受手术,1例因一般情况太差放弃手术;3例因严重感染死亡。10例粘连性肠梗阻中,3例发生绞窄接受手术。2例右侧膈疝中,1例经胸微创修补,另1例发生绞窄,切除肠管并接受经腹修补术。5例原发性腹膜炎致肠梗阻,即未见穿孔或明显的机械性梗阻征象,但腹水培养结果阳性;这5例均有不同程度的肺部感染,均未接受手术,1例死于严重感染。所有患者一般特征见表1。在所有需要手术的病例中,高危肠梗阻部位排序如下:空肠吻合口、空回交界处、回盲部、回肠系膜、结肠、吻合袢胆支、十二指肠空肠起始部(图1)。

图1 需要手术的肠梗阻发病部位示意图和构成比 注 PTLD:Posttransplant Lymphoproliferative Disorder 移植后淋巴增生异常
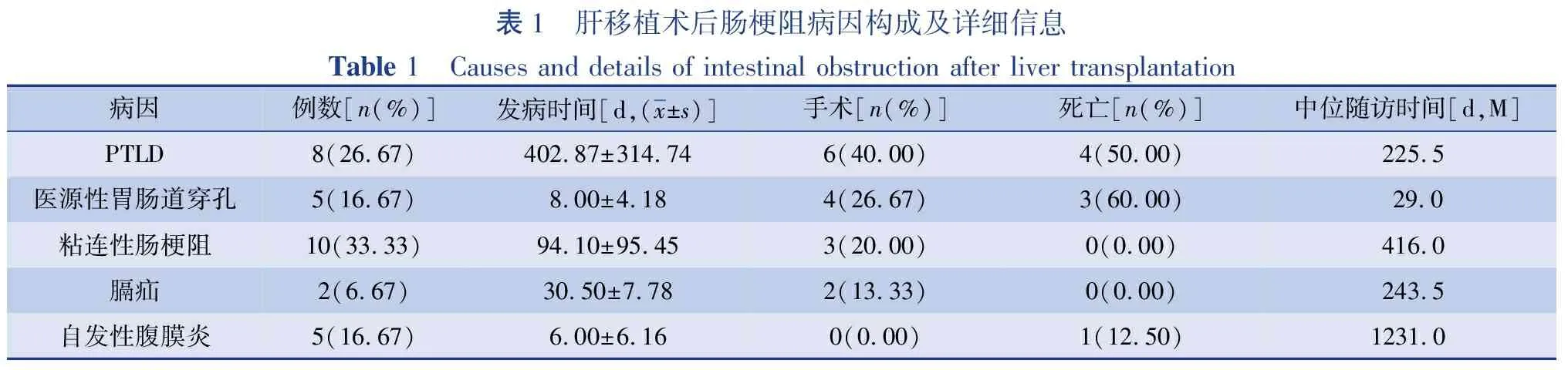
表1 肝移植术后肠梗阻病因构成及详细信息Table 1 Causes and details of intestinal obstruction after liver transplantation病因例数[n(%)]发病时间[d,(x±s)]手术[n(%)]死亡[n(%)]中位随访时间[d,M]PTLD8(26.67)402.87±314.746(40.00)4(50.00)225.5医源性胃肠道穿孔5(16.67)8.00±4.184(26.67)3(60.00)29.0粘连性肠梗阻10(33.33)94.10±95.453(20.00)0(0.00)416.0膈疝2(6.67)30.50±7.782(13.33)0(0.00)243.5自发性腹膜炎5(16.67)6.00±6.160(0.00)1(12.50)1231.0
二、发病时间对肠梗阻病因的提示作用
通过比较不同病因致肠梗阻患者肝移植术后发病时间,发现各病因的发病时间存在差异(F=4.215,P=0.007);与非PTLD患者比较,PTLD患者发病时间平均为肝移植术后(13.4±10.5)个月,差异有统计学意义(t=-2.918,P=0.020);与粘连性肠梗阻患者比较,粘连性肠梗阻发生时间平均为肝移植术后(3.14±3.18)个月,差异有统计学意义(t=0.910,P>0.05);与非自发性腹膜炎患者比较,自发性腹膜炎引起的麻痹性肠道梗阻平均发生在肝移植术后(6.00±6.16)d,差异有统计学意义(t=3.647,P=0.001);2例膈疝自术后1个月起反复出现呕吐,逐渐加重,分别于术后1个月和16个月确诊。与非医源性消化道穿孔患者比较,医源性消化道穿孔都发于术后1周内(8.00±4.18)d,差异有统计学意义(t=3.598,P=0.001),详见图2。
本研究发现,发生在肝移植术后3个月内的肠梗阻由医源性胃肠道穿孔、自发性腹膜炎和膈疝引起,发生在肝移植术后3个月以后的肠梗阻则由粘连性肠梗阻和PTLD引起。 通过发病时间来预测肠梗阻病因发现,ROC曲线下面积(area under curve,AUC)为1.000(P<0.0001),这说明发病时间可以完全区分肝移植术后肠梗阻的这两类病因(图3A)。对于发生在术后3个月以内的肠梗阻来说,手术创伤引起的胃肠道穿孔和感染引起的原发性腹膜炎主要发生在术后1周内,膈疝的发生一般稍晚,在术后1个月左右发现。对于术后3个月之后发生的肠梗阻,PTLD较粘连性肠梗阻发生更晚。通过发病时间可以预测PTLD和粘连性肠梗阻,AUC为0.856(P=0.011),说明发病时间可以基本区分开PTLD和粘连性肠梗阻这两类病因(图3B)。
三、PTLD和消化道穿孔是预后不良的主要因素
30例患者中死亡8例,总体生存率73.33%。共15例最终接受手术治疗,手术后死亡4例,手术后存活率73.33%。不同病因所致肠梗阻患者的生存曲线见图4。
本研究中肝移植术后最常见的梗阻原因是粘连性肠梗阻,占总数的33.33%(10/30),但往往可以通过积极的保守治疗缓解或迁延。10例中仅3例发生绞窄,手术率30%,占手术探查总数的20%。PTLD共8例,占肝移植术后肠梗阻总数的26.67%,是第二位常见病因。其中6例行剖腹探查术,病变处穿孔1例,占手术探查总数的40%。PTLD的表现形式多样,腹胀、发热4例,转移性右下腹痛1例,消化道出血2例,穿孔后弥漫性腹膜炎1例;病死率50%(4/8),是最常见的死亡原因。
医源性胃肠道穿孔共6例,除1例PTLD继发空肠吻合口穿孔外,其余5例(83.33%)均源自手术机械损伤,病死率60%,总的穿孔病死率50%,占8例肠梗阻死亡人数的37.5%,是第二位死亡原因。医源性胃肠道穿孔可通过患者发生进行性加重的腹胀、肌紧张等腹膜炎体征来初步诊断;通过引流液提示粪汁样改变(2例)、CT提示腹腔肠间隙积气影(3例)、B超提示肠管内容物外漏(4例)、腹腔穿刺提示腥臭气体或粪汁样液体(2例)等征象确诊。存活病例手术干预基本均在发病后24 h内(2例),最晚不超过48 h(1例胆瘘),死亡病例(3例)确诊时均超过72 h。
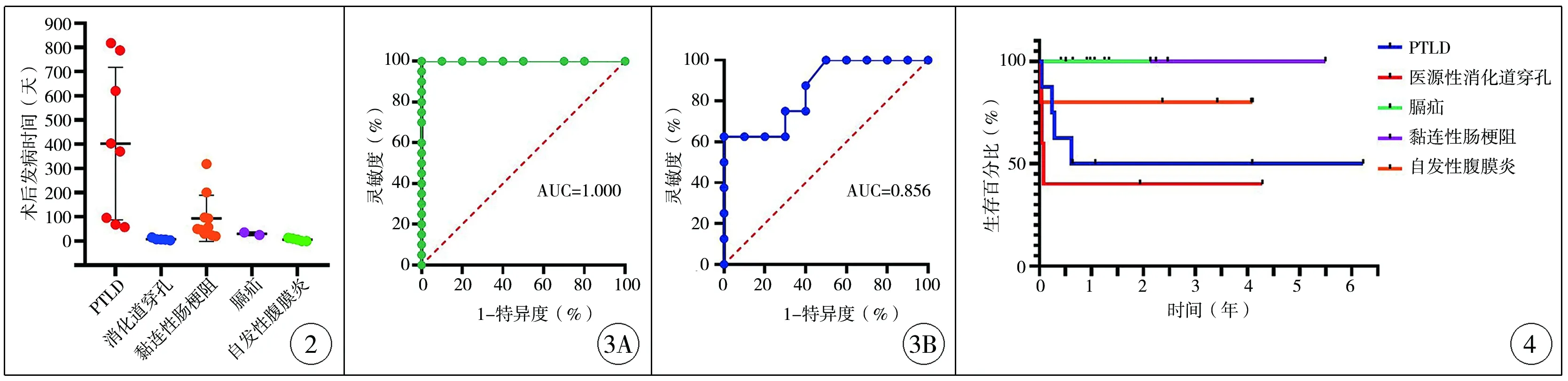
图2 肝移植术后肠梗阻不同病因距离肝移植手术的发病时间 图3 距离肝移植手术的发病时间对不同病因致肠梗阻的预测价值 3A:距离肝移植手术的发病时间对于自发性腹膜炎、医源性消化道穿孔和膈疝诊断价值; 3B:距离肝移植手术的发病时间对于PTLD和粘连性肠梗阻的诊断价值 注 PTLD:Posttransplant Lymphoproliferative Disorder 移植后淋巴增生异常 图4 不同病因导致的肠梗阻患者整体生存曲线
讨 论
本研究是国内样本量较大的针对儿童肝移植术后肠梗阻病因、预后和干预措施的报道。虽然受制于有限的样本量以及可能的选择偏倚和缺乏肝移植术后无并发症的对照等原因,无法对儿童肝移植术后肠梗阻产生的危险因素做出评价,但仍然可以获得很多有指导性意义的结论。
一、PTLD是引起儿童肝移植术后肠梗阻最常见的原因和最主要的预后不良原因
本研究发现PTLD是引起儿童肝移植术后肠梗阻最常见的原因,且通常发生在术后12个月左右(3个月至2年)。鉴于该疾病致死率高,对于肝移植术3个月后发生的慢性、完全或不完全性肠梗阻要首先排除该病因。
根据既往文献报道,儿童PTLD 发生率要明显高于成人,约 3.4%~6.25%的儿童患者肝移植术后会发生PTLD[7,8]。而其中消化道受到波及的比例也远高于成人,占PTLD总数的25%~68%[9,10]。其发生可能与EB病毒感染、免疫抑制剂剂量偏高有关[11]。儿童PTLD 5年生存率约80%~90%,但约18.8%的患者会出现顽固的慢性排异和相应的移植物失功能[9,12]。美罗华作为治疗PTLD的专用药物,配合调整免疫抑制剂的用量可以治愈大多数PTLD患者[11]。手术治疗对于PTLD的意义在于明确病理诊断。目前在有内窥镜以及PET/CT等无创检查方法的情况下,除非同时伴有完全性梗阻或穿孔等危及生命的情况,手术活检不再是必须的步骤[13]。换言之,患者如果在术后1年左右出现不完全性肠梗阻或消化道出血等不典型表现,需警惕PTLD的发生;而在探查过程中如果发现了肠道肿物,一般以活检为主,不建议完整切除。
二、肝移植术后肠梗阻与感染关系密切
本研究发现儿童肝移植术后肠梗阻与感染关系密切,因感染引起的肠梗阻占总数的1/3(5例为医源性穿孔造成的腹腔感染,5例潜在肺部感染引发原发性腹膜炎)。除了积极足量的抗生素治疗外,准确及时的病因判断对于患者的预后有积极意义。
感染是儿童肝移植术后二次移植或死亡的主要原因[14]。感染与肠梗阻密不可分,不仅由于消化道穿孔引起的腹腔内感染粘连会导致肠梗阻,反过来感染和菌群移位也会诱发原发性腹膜炎导致肠梗阻,甚至出现肠道坏死穿孔[15,16]。本研究发现原发性腹膜炎均伴有不同程度肺部感染,可见两者存在一定联系,这也是鉴别肝移植术后原发性腹膜炎和医源性胃肠道穿孔的特征。可能是患者术前已有隐匿的肺部感染,术后因免疫力下降出现感染加重并继发血行性感染而引起原发性腹膜炎。另外,有文献发现移植物发生吻合血管栓塞、出现移植物功能异常,后续会出现血行性感染、肺炎和肠穿孔[17]。而值得注意的是严重感染也是血管栓塞的重要诱因,两者互为危险因素[18,19];炎症反应和凝血机制激活是机体应对感染的两大主要反应[23]。原发性腹膜炎是一个涉及多系统、多器官的症候群,需要密切监护和系统性诊疗,虽然大部分患者不需要手术治疗,但文献报道其病死率可达10%~68%[16]。因此对于肝移植术后肠梗阻的诊断和判断一定不能局限于肠道情况,对肝移植物功能、肝血管情况以及免疫抑制剂使用情况的监测也是非常必要的。
三、肝移植术后膈疝的发生并不罕见,要避免漏诊、误诊
本研究中所有膈疝都发生于右侧,与文献报道一致[20];且术前胸片和术中探查都未见膈疝,因此膈疝应该是由手术引起或者与手术有关。膈疝并不是儿童肝移植术后罕见的并发症,据文献报道其发生率为6.6%[20]。常规的胸片检查能及时发现膈疝,但其发生机制尚不明确,有学者认为左侧移植物、膈肌本身薄弱、免疫抑制剂使用,都是膈疝发生的危险因素[20]。膈疝一经发现要尽快手术,为了方便探查,常规选取经腹探查修补,这是因为继发于肝移植术后的膈疝可能伴有肠粘连和肠绞窄。肠绞窄的患者,虽然肠管位于胸腔,但仍然是绞窄性肠梗阻的症状和体征,如腹痛、呕吐、便血。由于肠道缺血、坏死产生的渗出液会刺激胸膜腔并沿着膈疝裂孔进入腹腔刺激腹膜,从而表现为胸膜刺激征和腹膜刺激征。但对于没有肠绞窄的患者,可以采用经胸腔镜修补,手术更为简单,创伤也更小。
四、早发现、早干预对于医源性胃肠道穿孔的预后有重要意义
由于婴幼儿表述障碍,在出现肠梗阻症状时,对于一些威胁生命的情况,尤其是胃肠道穿孔需要借助辅助手段进行判断。有文献报道,肝移植术后穿孔患者病死率高达22%~50%[21,22]。本研究中胃肠道穿孔若未能在24 h内及时发现,其病死率极高,因此寻找敏感准确的辅助诊断手段,及时准确地判断病情,对其预后有重要意义。
传统推荐观察腹腔引流液以及腹部X线平片来诊断胃肠道穿孔,但两者的灵敏度和特异度均较差。本研究中引流液往往在穿孔初发时没有任何改变或发生引流管堵塞,立位X线平片则在任何一例穿孔病例中都没有阳性表现。近年其他中心的报道也得出了类似结论,甚至指出腹腔引流管会增加腹腔内感染的概率[23]。CT检查对穿孔的灵敏度显著高于X线检查,既往研究也提出CT平扫具有更清晰的图像质量和更高的灵敏度[24]。本研究中确实发现CT对穿孔有更好的提示作用。但是,对于儿童CT的高辐射性始终是无法避避免的,也限制了其广泛应用。而本研究中B超检查发现4例患者有穿孔影像,虽然其进一步的实用性需要更多数据验证,但可能会成为未来更好的诊断方式。
五、腹部探查以上腹部横切口为最常用且最实用的方法
本研究通过观察3例粘连性肠梗阻索带压迫、绞窄的患者,发现3例粘连性内疝中索带位置均位于空肠吻合口附近和空回肠交界处而并不位于肝残面附近。结合PTLD、胃肠道穿孔等需要手术探查的病例,本研究发现在手术探查过程中,空回肠交界处、结肠及回盲部、吻合口周围均为高危部位。一般来说,肝移植术后超过2周的患者,腹腔内已形成粘连,而高危的病变梗阻部位常常不位于原手术区域,为了简化手术步骤,减少出血和损伤,不推荐从原移植切口进入。然而过低的手术切口同样不推荐,因为这会对探查上腹部情况造成困难。尤其是对于亲体移植的患者,原先的肝右叶会被肠管占据,理论上依然是粘连和梗阻的好发部位。故在一般情况下,除膈疝可考虑经胸修补,以及其他有明确部位指向的病例外,探查切口以脐上横切口最可能大概率暴露高危部位。
肝移植术后肠梗阻是一系列不同病因造成的肝移植术后并发症的共同表现之一。PTLD和医源性胃肠道穿孔是引起肠梗阻的两大主要原因,常发生在移植术3个月后,发病的时间对于病因有一定的提示作用。同时两者也是导致再次手术和预后不良的主要原因。总之,对于肝移植术后肠梗阻病因的判断要充分考虑可能存在的内外科因素,并进行针对检查,尽早确诊、果断干预对患者预后有重要的意义。
